肝细胞癌原位与皮下PDX模型的方法学比较分析研究
朱瑞敏,李宝亮,路亚岚,詹相文,刘益豪,韩云林,秦川,高苒*
(1.中国医学科科学院医学实验动物研究所,北京协和医学院比较医学中心,国家人类疾病动物模型资源库 国家卫生健康委员会
人类疾病比较医学重点实验室 北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021;2.首都医科大学附属北京地坛医院,北京 100015)
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内最常见的消化道恶性肿瘤之一,最新研究表明其发病率和死亡率分别为第三和第二[1]。我国肝癌的发病率和死亡率约占全球的46.6%和47.1%[2]。该病患者发病隐匿,早期症状不明显,确诊时一般为中晚期,需接受放疗和化疗在内的综合治疗方案。肝癌与其他肿瘤相似,化疗以经验性用药为主。由于肿瘤患者的异质性,个体差异较大,相同的病理诊断适用药物不尽相同,对部分患者可能出现耐药性延误治疗的最佳时机[3]。因此,为患者选择个体化的治疗方案是目前亟需解决的重要问题。
人源肿瘤异种移植(patient-derived xenografts,PDX)模型是通过手术或穿刺样本植入免疫缺陷小鼠建立的个体化肿瘤模型[4]。该模型能够高度维持原发瘤的组织病理学、遗传异质性和生长特征,在肿瘤药物筛选以及实现个体化治疗方面具有极大优势[5-7]。根据PDX模型的移植部位主要包括皮下移植和原位移植[8]。皮下接种是目前最常用的植入方式,具有操作简单、便于观察等多种优势,但皮下不能提供肿瘤生长的适宜微环境,因此成瘤率相对较低,培养时间长[9];原位模型与原发性肿瘤生长环境相似,能够模拟生长、浸润和转移在内的多种生物学行为,充分体现肿瘤的异质性,再者肝是一个造血器官之一,血供营养丰富,是理想的肿瘤移植模型[10]。目前国内还未报道HCC的原位PDX模型,原位与皮下PDX模型的方法学比较更是一个空白。因此,本研究旨在探索一种HCC的原位PDX模型的构建方法,并将原位移植模型与皮下模型进行比较。
本文从北京地坛医院收集新鲜的肝癌肿瘤组织,选择NCG免疫缺陷小鼠构建肝癌患者的原位和皮下PDX模型并进行鉴定,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
21只5~6周龄SPF级雄性NCG小鼠,体重18~22 g,用于构建肝癌PDX模型,购自江苏集萃药康科技有限公司【SCXK(苏)2018-0008】;NCG小鼠饲养于中国医学科学院医学实验动物研究所屏障环境动物房【SYXK(京)2019-0014】,环境温度24~26℃,光照12 h,黑暗12 h,小鼠均自由饮水取食,所有动物实验均获得了中国医学科学院医学实验动物研究所伦理委员会的批准(GR18001)。
1.1.2 实验患者标本
本实验所涉及的16例肝细胞癌标本均收集自首都医科大学附属地坛医院,肿瘤患者标本取材使用均通过了伦理审查委员会的批准(京地伦科字[2019]第(071)-02号)。
1.1.3 主要试剂与仪器
RPMI-1640培养基购自美国Gibco公司,胎牛血清(FBS)购自以色列Biological Industries公司,PBS缓冲液购自美国Gibco公司,戊巴比妥钠购自美国Sigma公司,青霉素购自AMRESCO公司,10%中性多聚甲醛购自北京索莱宝生物科技有限公司,75%乙醇溶液购自山东安捷高科消毒科技有限公司;缝合线购自上海浦东金环医疗用品股份有限公司,1 mL注射器购自中国双鸽集团聚民生物科技有限公司,腰椎穿刺针购自扬州市江州医疗器械有限公司,备皮刀购自吉康医疗器械有限公司,压敏胶带购自北京阳光益康科技发展有限责任公司,眼科镊购自上海医疗器械(集团)有限公司手术器械厂,眼用剪购自上海三友外科器材有限公司,持针器购自上海医疗器械(集团)有限公司手术器械厂;生物安全柜购自美国Thermofisher-Scientific公司,核磁扫描仪购自美国Agilent公司,呼吸麻醉机购自美国Matrx公司。
1.2 方法
1.2.1 肝癌PDX模型原位接种方法
临床肝癌患者手术切除组织标本离体后立即放入含20%FBS的4℃RPMI-1640培养基中,24 h内转移至生物安全柜内操作。取适量组织切成小块作为接种组织,并从剩余组织中,取适量放入10%中性甲醛溶液中固定,其余组织冻存备用(接种编号见表1)。每个标本接种一只NCG小鼠,具体操作如下:NCG小鼠腹腔注射1%戊巴比妥钠溶液,麻醉剂量为60 mg/kg,腹部备皮,碘伏消毒,沿腹中线稍偏右,开5~10 mm竖切口,用高温灭菌后的棉签,轻轻挤压肝部,使其肝部曝露出体外,RPMI-1640培养基浸洗组织,去除结缔组织和坏死组织,并将组织剪碎成小块备用;选取合适的肿瘤组织1~2块,吸入穿刺针;将穿刺针直接穿入肝小叶中,缓慢推出肿瘤组织块,用棉签轻微按住针口,缓慢拔出,完成接种。使用可吸收线缝合切口处1~2针,并在切口处滴一滴青霉素防止伤口感染,用经高压灭菌的纱布包裹手术部位,小鼠保温,小鼠侧放于新换的笼具中,放入笼内。术后3 d内每天观察小鼠精神状态及进食、饮水及活动情况,之后每周观察记录。
1.2.2 肝癌PDX模型皮下接种方法
接收新鲜组织,放入含20%FBS的4℃RPMI-1640培养基中,24 h内转移至生物安全柜内操作。于PBS缓冲液中将组织剪成约1 mm×1 mm×1 mm的小块,去除结缔组织和坏死组织(中间渣样物),选取合适的肿瘤组织1~2块,吸入穿刺针。每个标本(接种编号见表1)接种1只NCG小鼠皮下组织(前肢腋下和后肢内侧),具体操作如下:1%戊巴比妥溶液腹腔注射受体小鼠,诱导并维持麻醉,小鼠取仰卧位,腹部皮肤备皮并消毒,眼科剪于腹正中横向剪开皮肤约2 mm,形成进针小口。将穿刺针从切口处进入皮下,轻缓到达皮下上肢腋下,迅速推出组织块,用镊子轻摁穿刺针下部,旋转拔出,完成接种;使用可吸收线缝合切口处1~2针,并在切口处滴一滴青霉素防止伤口感染,用经高压灭菌的纱布包裹手术部位,小鼠侧放于新换的笼具中。术后3 d内每天观察小鼠精神状态及进食、饮水及活动情况,之后每周观察记录。

表1 肝癌PDX模型患者信息Table 1 Clinical characteristics of orthotopic PDX models for hepatocellular carcinoma
1.2.3 核磁共振扫描肝癌原位肿瘤
接种原位肝细胞癌PDX模型小鼠在进入扫描室前除去体内或体表所有的金属和铁磁性物品(例如金属耳号,芯片等),然后对小鼠通过异氟烷气体(2%的异氟烷和O2混合气体)麻醉,然后将小鼠放进连通气体麻醉剂的线圈内固定。先将动物床置于扫描架,并固定好,传至扫描位置。动物摆放俯卧姿,使头正中矢状面与身体长轴平行,身体中轴线与床板中轴重合,动物门牙勾住固定装置。通过调节扫描架位置,将扫描部位放置于磁场中心位置。T2WI对小鼠进行横断面和矢状面扫描,TR为2000~3000 ms,TE为48~84 ms,矩阵:256×256,ETL为8。在整个扫描过程中,小动物的呼吸、心电和温度等生理状态需持续监测。小动物麻醉后体温会降低,为防止体温过低动物死亡,MRI腔体内需连接电热水浴垫或使用热风持续加温等方法维持动物体温。
1.2.4 肿瘤生长曲线测定
皮下移植的肿瘤,每7 d测量1次肿瘤的长径(L)与短径(W),计算肿瘤体积,肿瘤体积计算公式为V=1/2×(L×W2),绘制肿瘤生长曲线,当肿瘤长径达到1 cm时传代或冻存。
1.2.5 肿瘤组织病理学检查
MRI检查后的原位肝癌模型和肿瘤长径达到1 cm的皮下肝癌模型小鼠,通过颈椎脱臼法处安乐死,剥离肝上肿瘤组织,拍照记录。然后取适量肿瘤组织于10%的中性甲醛溶液中固定至少24 h,通过梯度乙醇脱水和二甲苯透明后,浸蜡包埋,待组织块变硬后切片(4μm),贴于玻片上烘干;染色前使用二甲苯脱蜡,再经梯度乙醇最后至蒸馏水中即可染色;染色时先在苏木精中染色2 min,酸水和氨水中分色后,入酒精伊红染色2 min,然后脱水封片。经过HE染色的组织切片,在光镜下观察并扫描染色结果。
1.3 统计学方法
使用Graphpad Prism 8.0统计软件对数据进行统计分析及图片制作,结果以平均值±标准误(±s¯x)表示,两组间的数据采用Student’s t检验和卡方检验(超过20%的方格n<5时,采用Fisher exact test)计算,P<0.05为差异具有显著性。
2 结果
2.1 成功构建肝癌PDX原位和皮下模型
构建肝癌原位PDX模型,模式图如图1A。术中出血少,无需止血,视野清楚。术后6 h内,精神欠佳活动减少,能顺利进食;12 h后,精神状态正常,能正常活动与进食,小鼠术后均成活。构建的肝癌皮下PDX模型,术中基本无出血状况,无需止血。小鼠术后均成活。术后4 h内,精神欠佳活动略少,能顺利进食,12 h后,精神状态正常,能正常活动与进食。在肝癌PDX原位与皮下模型构建过程中小鼠状态良好,毛色光顺、进食进水正常、粪便和尿量均无异常反应。
本次实验中有5例标本同时构建了肝原位和皮下的PDX模型,其中原位模型的LC30和LC31患者原位PDX模型分别在第43天和第23天在腹部肝部位触摸到小软包,似肿瘤生长,持续观察记录。LC30和LC31分别于73、42 d时通过核磁成像检测,结果显示,T2WI上呈现高信号,提示有肿瘤生长(图1B)。解剖后发现肿瘤位置与MRI扫描图一致(图1C)。这5例肝癌PDX皮下模型中,LC31皮下模型建立成功,接种后18 d,开始可能触摸到小芝麻粒样的肿物,于35 d时肿物明显。这例PDX模型通过游标卡尺测量,统计其生长曲线,发现呈对数生长(图1D)。
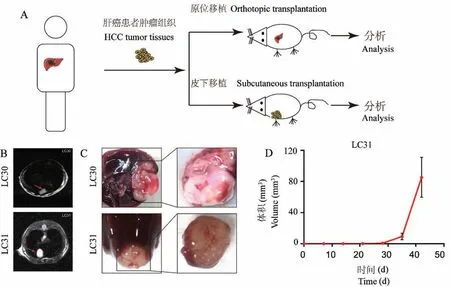
图1 肝癌PDX原位和皮下模型的生长特征Note.A.Schematic diagram of HCC orthotopic and subcutaneous PDX model establishment.B.MRI results of the LC30 and LC31 HCC orthotopic PDX model at 73,42 d,respectively.C.Anatomy images of the LC30 and LC31 HCCorthotopic PDX model at 73,42 d,respectively.D.The growth curve of LC31 HCC subcutaneous PDX model.Figure 1 HCC orthotopic and subcutaneous PDX model growth characterization
2.2 肝癌PDX原位和皮下模型组织病理形态均与原始肿瘤相似
肝癌PDX模型成功荷瘤后,将肝癌患者肿瘤组织、PDX模型肝原位和皮下成瘤的组织,用10%中性甲醛固定、石蜡包埋、组织切片后进行HE染色,光镜下观察成瘤前后肿瘤组织类型变化。结果显示,LC30肝癌PDX模型肝原位法(P1)得到的肿瘤细胞呈巢团状排列,间质较少,细胞异质性明显,核近圆形,不规则,核仁明显,胞浆丰富,嗜酸性染色,形态同LC30患者(图2A)。LC31肝癌PDX模型肝原位法(P1)肿瘤细胞弥漫性增生,细胞较小,大部分肿瘤呈筛状生长方式(图2A);LC31肝癌PDX模型皮下法(P1)细胞弥漫性增生,细胞较小,胞核较大,大部分肿瘤细胞排列较为整齐,呈筛状生长方式(图2B)。原位与皮下模型两者与LC31患者原始肿瘤形态具有较高的相似性,表明原位与皮下成瘤均能较好的保持组织病理学特征。为了进一步明确PDX模型中是否有癌旁组织和小鼠肝组织细胞,比较了人源和小鼠源的肝组织的形态,发现两者的细胞核圆形、较大,位于细胞中央,不同于PDX的P0和P1代肿瘤细胞形态,表明建立的PDX模型来源于肿瘤组织而非癌旁部分(图2C)。
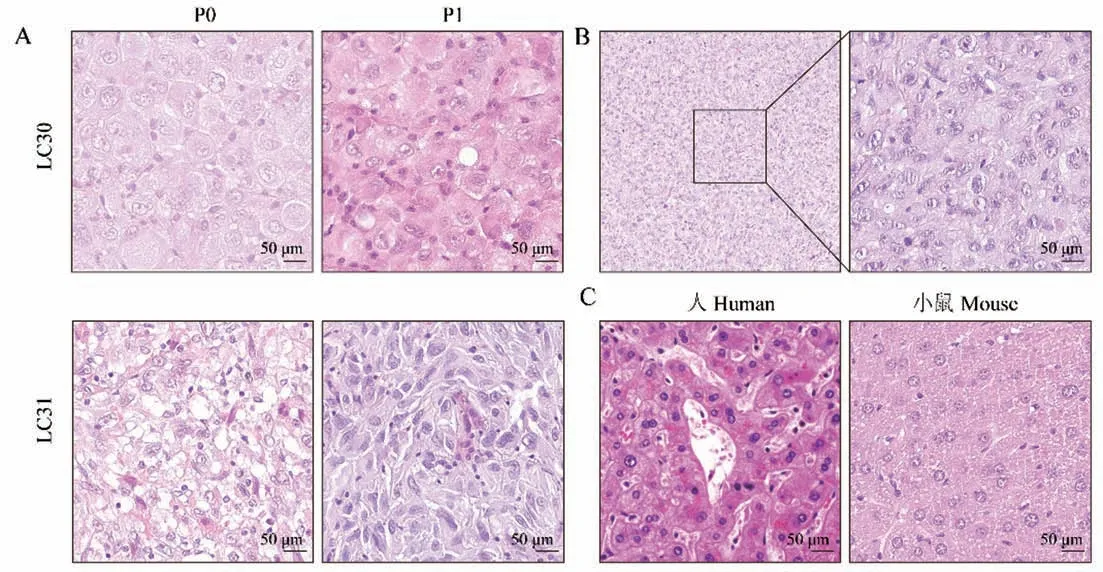
图2 肝癌PDX原位和皮下模型的组织病理形态Note.A.LC30 and LC31 HCCorthotopic PDX model,HE staining.B.LC31 HCC subcutaneous PDX model HE staining.C.Human and mouse liver HE staining.Figure 2 Histology of HCC orthotopic and subcutaneous PDX tumor tissues and human tumor tissues
2.3 肝癌PDX原位模型较皮下模型成瘤率高
PDX模型的成瘤率和成瘤周期是制约该模型应用的两个重要指标。本次实验配对5例原位模型中成瘤2例(编号为LC30和LC31,成瘤率40%),皮下成瘤1例(编号为LC31,成瘤率20%)两者差异具有显著性(图3A);成瘤时间分别为:原位模型LC30:23 d,LC31:43 d;皮下成瘤LC31:35 d(图3B)。由于本次实验数量较少,因此增加PDX模型(原位模型共6例,皮下模型共15例,编号见表1)综合统计成瘤率,其中原位模型6例患者中3例成瘤,成功率为50%,皮下模型的15例患者中成功建模3例,成功率为20%(图3C);原位肿瘤的平均成瘤时间为30 d,而皮下平均成瘤时间为68 d(图3D)。综上,原位PDX的成瘤率较皮下模型高100%~150%,成瘤时间比皮下模型相对短22.86%~126.67%(图3)。

图3 肝癌PDX原位和皮下模型的成瘤率与成瘤时间Note.A.The tumor formation rate in 5 paired HCC orthotopic and subcutaneous PDX model.B.The tumor formation time in LC31 HCC orthotopic and subcutaneous PDX model.C.The tumor formation rate in 6 HCC orthotopic and 15 subcutaneous PDX model.D.The tumor formation time in 6 HCC orthotopic and 15 subcutaneous PDX model.**P<0.01,****P<0.0001.Figure 3 Tumor formation rate and time in HCC orthotopic and subcutaneous PDX model
3 讨论
肝细胞癌是我国最常见的恶性肿瘤之一,是第二大致死性肿瘤,5年生存率约为18%,世界卫生组织预计到2030年会有将近1亿的死亡病例[11]。目前肝癌的治疗方法包括手术切除,肿瘤消融法,肝动脉治疗和系统性治疗。对于早期肝癌患者(BCLC分期0或者A),手术和消融法是一线治疗的首选方案。对于中期的肝癌(BCLC分期B)则考虑肝动脉治疗法。对于晚期进展期肝癌患者(BCLC分期C)和部分中期患者则推荐以药物为主的系统性治疗[12]。肝癌进展隐匿,早期症状不明显,确诊时大多为中晚期,需接受放疗和化疗在内的综合治疗方案,其中化疗以经验性用药为主。由于肿瘤患者的异质性,个体差异较大,相同的病理诊断适用药物不尽相同,临床用药有效性较低。
PDX模型是目前最接近临床患者的药物筛选模型,有望提供个体化的药物策略,这些模型可以预测临床结果,用于临床前药物评价,并用于肿瘤的生物学研究,同时也是新药研发的重要工具。本实验成功构建了原位和皮下的PDX模型,通过组织病理学检测发现构建原位和皮下PDX后,与原发灶的组织结构和肿瘤类型十分接近。原位模型操作相对复杂,而且需要核磁等配套设备检查成瘤情况。而皮下移植模型操作简单,是没有特殊要求和设备的情况下的常用模型构建方法(见表2)。
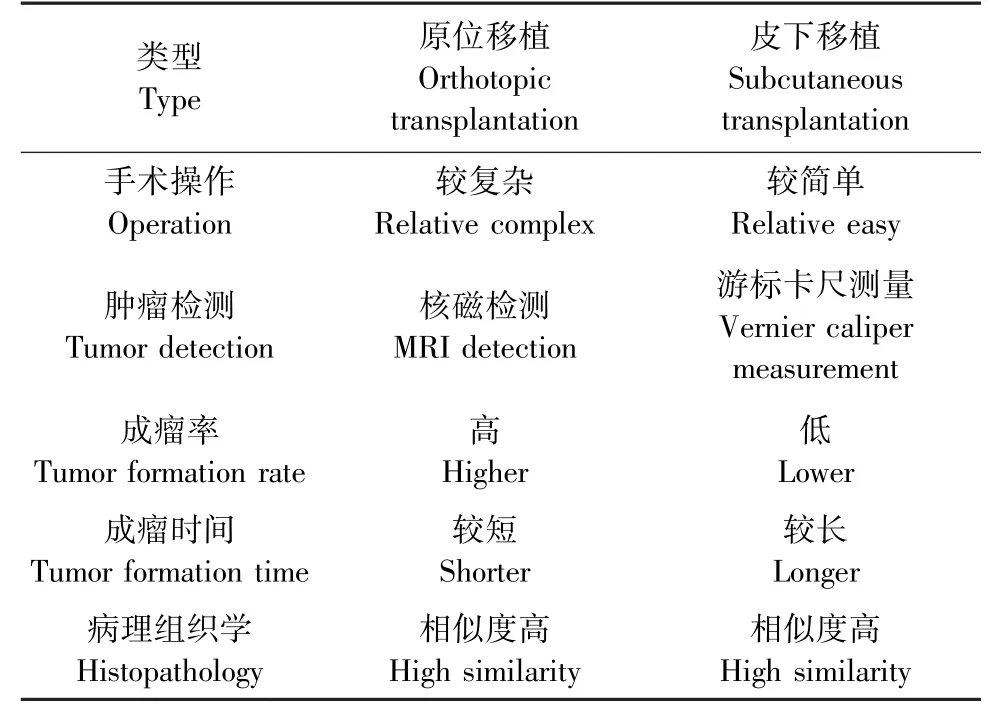
表2 肝癌原位与皮下PDX模型比对Table 2 Compatative analysis of HCC orthotopic and subcutaneous PDX models
皮下模型由于肿瘤组织生长的微环境与生理状态不同,而且血供营养较少,因此导致PDX移植失败率高,并且生长缓慢。在PDX模型建立中P1代建模的成功率是“卡脖子”问题,本实验中构建的肝癌原位PDX成功率为50%,皮下PDX成功率约为20%,原位的成功率高于皮下成瘤率PDX模型,约2~3倍,且差异具有显著性,这为难生长的肿瘤的模型建立提供一个较高生存几率的建模方法;同时我们发现原位模型平均成瘤时间为30 d,明显肿瘤产生时间为68 d,平均成瘤缩短一半左右(见表2)。研究报道肝肿瘤细胞皮下P1代的平均成瘤时间为97 d,都长于原位PDX模型成瘤时间[9]。尽管目前还因为数量比较少,bar值较高还没有统计学差异。在以后的实验中增加样本量,预期获得有统计学差异的成瘤时间。
综上,本次研究成功构建肝癌原位和皮下PDX模型,肝癌原位PDX模型的高成瘤率为难生长肿瘤的建模提供了一个新方法,但皮下模型操作相对简单,观察方便。在具体科学实践中根据需求具体选择,例如:对于较难生长和样本珍贵的肿瘤,优先选择原代接种;当样本易得,无特殊设备,或者数量较大时可选择皮下模型造模;而且原位模型成瘤后传代也可以考虑使用皮下模型。两种模型为深入探索HCC的发病机制,及药物筛选提供了有效的动物模型。在本实验使用肿瘤组织块构建PDX模型,在实际应用中还有胸腹腔积液,循环系统的肿瘤细胞等[13-14],这些模型构建需要针对各自特点调整操作;本实验涉及的标本均为原位肝癌,关于原位与皮下PDX模型在转移瘤中的特点需要今后收集肝癌转移病例验证;而且实验样本量相对较少,在以后的科研实践中需要增加肝癌患者样本量,丰富原位和皮下PDX模型的构建方法和效能评价数据。此外,原位和皮下PDX模型是将患者肿瘤组织接种在免疫缺陷小鼠身上,因此,破坏了肿瘤-免疫相互作用,如果在目前模型的基础上,使用免疫系统人源化的小鼠模型,将会为研究人免疫系统与肿瘤之间相互作用提供有力模型工具[15]。