丹参酮IIA对阿尔茨海默症模型小鼠神经保护作用及对PI3K/AKT通路的影响
方毅,宋光捷*,陈黎,冯建青
(1.湖北文理学院附属医院 襄阳市中心医院,湖北 襄阳 441000;2.中国人民解放军联勤保障部队第九九一医院,骨科,湖北 襄阳 441003;3.中国人民解放军96608部队医院,内一科,陕西 汉中 723100)
阿尔茨海默症(Alzheimer’s disease,AD)是老年痴呆症中最为常见的类型,可发生于老年期和老年前期,病理表现为脑内淀粉样蛋白斑沉积、神经纤维缠结和神经元丢失,这种神经和血管损伤会引起记忆功能受损和认知障碍,严重影响老年患者的生活质量[1-2]。随着世界各国人口结构进入老龄化阶段,AD患者的发病率也逐渐升高[3]。目前,关于AD的发病机制尚未阐明,可能是生活习惯、激素水平、脑血管疾病、炎症反应、遗传等多种因素相互作用的结果[4]。现有针对AD的治疗药物仅能缓解初期病症,还无法达到令人满意的治疗效果[5]。中药是我国传统药物,具有多靶点、多系统、多途径的特点,在AD的治疗方面表现出独特的优势,也是药物研究的重要来源[5]。丹参酮IIA(Tanshinone IIA,Tan IIA)是经典中药材丹参中的主要活性成分,已被证实可改善AD小鼠症状[6],但Tan IIA的药理活性丰富多样,在AD小鼠模型中是否还有其他的作用途径仍不清楚。本研究为明确Tan IIA在AD中的神经保护作用,以脂多糖(lipopolysaccharide,LPS)诱导AD小鼠模型,观察Tan IIA对AD小鼠学习记忆功能损伤的影响及可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
60只6周龄雄性清洁级ICR小鼠,18~22 g,购自中科院上海动物中心【SCXK(沪)2019-0050】,动物实验开展于湖北文理学院医学院动物房【SYXK(鄂)2017-0005】,各项动物实验操作均符合医院伦理委员会标准伦理审查批号(20180601247)。动物房饲养条件为:温度20~24℃,相对湿度40%~60%,自然光线,每12 h昼夜交替。适应性喂养1周后进行实验,自由摄食饮水。
1.1.2 主要试剂与仪器
Tan IIA、LPS(美国Sigma);ELISA试剂盒、ECL发光剂(武汉博士德生物工程有限公司);蛋白一抗(美国Abcam);蛋白二抗(美国Abbkine);Morris水迷宫、Y迷宫、自主活动能力测试小室(上海软隆科技发展有限公司);光学显微镜(日本奥林巴斯)。
1.2 方法
1.2.1 动物分组、建模与给药
60只ICR小鼠随机分为空白组、模型组、Tan IIA低、中及高剂量组,各12只。模型组、Tan IIA处理组建立AD小鼠模型,麻醉,根据脑立体定位图谱确定侧脑室进针位置[7]:两眼连线中点偏右1 mm与后眼角连线后2 mm处,消毒后针头垂直于颅骨进针2 mm注射0.5 g/L LPS溶液,空白组小鼠以生理盐水替代。LPS注射后次日,Tan IIA处理组分别给予1、5、10 mg/kg Tan IIA腹腔注射,每天1次,连续给药7周,空白组、模型组以等量生理盐水替代。
1.2.2 行为学实验
(1)Morris水迷宫实验,实验分为学习阶段和测试阶段,学习期训练频率为每天2次,连续训练4 d,将小鼠面朝水池壁从3个入水点放入水池,通过摄像仪记录小鼠第3次从平台对位象限(第三象限)入水到站立于隐匿平台的所需时间,记为潜伏期。第5天开始测试,撤去平台,从第三象限同一入水位置放入小鼠,检测90 s内穿过原平台象限的时间。
(2)Y迷宫实验,将Y迷宫的3个支臂分别标记为A、B、C,随机将小鼠放入1个臂的末端,使其自由探索,记录8 min内小鼠进臂的总次数(除尾部外的全部身体进入即为进臂)、进臂的顺序,其中连续进入3个不同臂为1次正确交替反应,计算自发交替反应率[正确交替反应次数/(进臂的总次数-2)×100%]。
(3)自主活动能力测试,将小鼠放入测试小室,通过光电传感器记录5 min内小鼠的水平运动总距离。
1.2.3 脑组织病理染色
行为学实验完成后,处死小鼠,快速分离脑组织,制成石蜡切片,进行常规HE染色,光镜下观察小鼠脑组织海马区形态变化。
1.2.4 ELISA检测
取脑组织制备10%匀浆液,12 000 r/min离心10 min取上清液,参照ELISA试剂盒说明书操作,检测脑组织匀浆上清液中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胆碱系统(Ach、AchE)和白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)的含量。
1.2.5 免疫组化检测
取脑组织石蜡切片,脱水、脱蜡、复水处理后,置于通透液中18 min,抗原修复后滴加过氧化氢去离子水阻断内源性过氧化物酶,室温下静置10 min,再滴加正常山羊血清,室温下封闭30 min,先滴加一抗(1∶200),4℃下孵育过夜,再加入信号增强剂,室温下反应1 h,然后进行二抗孵育,室温下孵育1 h,最后加入DAB试剂进行显色,封片后光镜下观察脑组织中IBA-1和GFAP的表达。
1.2.6 Western Blot检测
取适量脑组织提取蛋白,经SDS-PAGE凝胶分离蛋白,再采用湿转法转移至PVDF膜,5%脱脂奶粉封闭2 h后,分别孵育蛋白一抗、二抗,在添加ECL发光剂显色。以β-actin为内参,计算核因子κB(NF-κB)、p-NF-κB、Toll样受体4(TLR4)、PI3K、p-PI3K、AKT及p-AKT的表达。
1.3 统计学方法
应用SPSS 17.0软件统计实验数据,以平均值±标准差(±s)表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 对AD小鼠Morris水迷宫实验逃避潜伏期的影响
各组小鼠在水迷宫的逃避潜伏期时间均随着训练的增加而缩短;与空白组比较,模型组小鼠逃避潜伏期增加,差异具有统计学意义(P<0.05);与模型组比较,Tan IIA处理组逃避潜伏期减少,差异具有统计学意义(P<0.05),以高剂量组变化最为显著,差异具有统计学意义(P<0.05)(见表1)。

表1 Tan IIA对AD小鼠Morris水迷宫实验逃避潜伏期的影响(s)Table 1 Effects of Tan IIA on escaping latency of Morris water maze test in AD mice(s)
2.2 对AD小鼠自由交替反应率和自主活动能力的影响
与空白组比较,模型组小鼠自由交替反应率降低,差异具有统计学意义(P<0.05);与模型组比较,Tan IIA中、高剂量组自由交替反应率升高,差异具有统计学意义(P<0.05),以高剂量组变化最为显著,差异具有统计学意义(P<0.05)。但各组小鼠自主活动距离比较,差异无统计学意义(P>0.05)(见表2)。
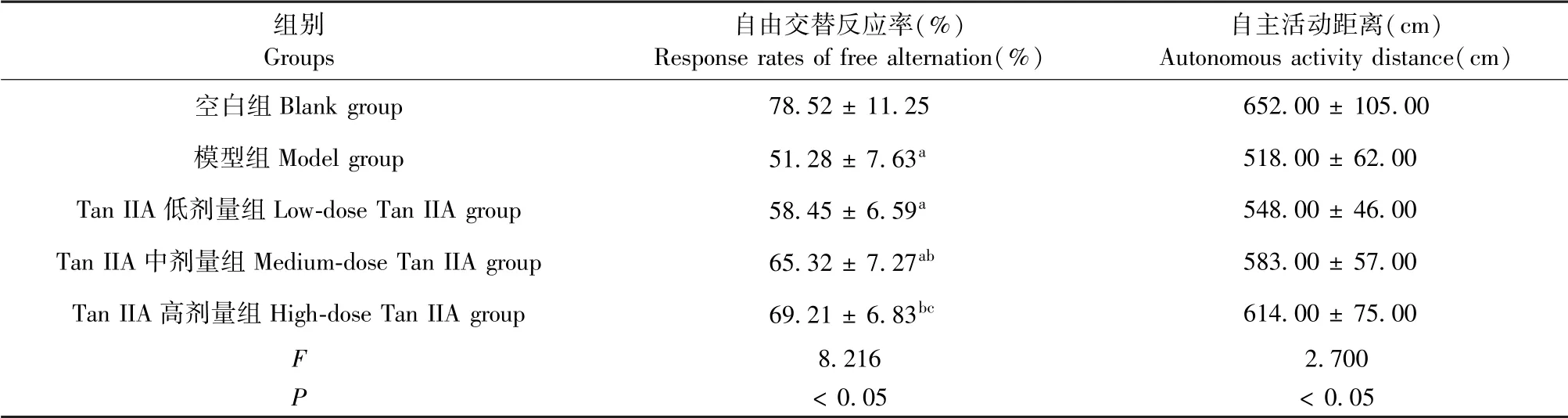
表2 Tan IIA对AD小鼠自由交替反应率和自主活动能力的影响Table 2 Effects of Tan IIA on response rate of free alternation and autonomous activity ability in AD mice
2.3 对AD小鼠脑组织海马区病理损伤的影响
如图1,空白组大鼠脑组织细胞结构正常完整、排列紧密、胞核深染且形状规则;模型组细胞形态不规则、排列紊乱、胞核与胞质界限模糊、神经元细胞缩小、且伴有大量的神经元细胞变性与坏死;Tan IIA中、高剂量组神经元细胞状态介于空白组和模型组之间,且随着给药浓度的增加,细胞状态越接近空白组。

图1 Tan IIA对AD小鼠脑组织海马区病理损伤的影响Figure 1 Effects of Tan IIA on hippocampal pathological damage of brain tissues in AD mice
2.4 对AD小鼠脑组织匀浆液中相关因子的影响
与空白组比较,模型组小鼠脑组织匀浆液中BDNF、Ach水平降低,AchE、IL-6、TNF-α水平升高,差异具有统计学意义(P<0.05);与模型组比较,Tan IIA中、高剂量组BDNF、Ach水平升高,AchE、IL-6、TNF-α水平降低,差异具有统计学意义(P<0.05),以高剂量组变化最为显著,差异具有统计学意义(P<0.05)(见表3)。

表3 Tan IIA对AD小鼠脑组织匀浆液中相关因子的影响Table 3 Effects of Tan IIA on the related factors in brain tissue homogenate of AD mice
2.5 对AD小鼠脑组织中IBA-1和GFAP表达的影响
与空白组比较,模型组小鼠脑组织中IBA-1和GFAP表达升高,差异具有统计学意义(P<0.05);与模型组比较,Tan IIA中、高剂量组IBA-1和GFAP表达降低,差异具有统计学意义(P<0.05),以高剂量组变化最为显著,差异具有统计学意义(P<0.05)(见表4,图2)。
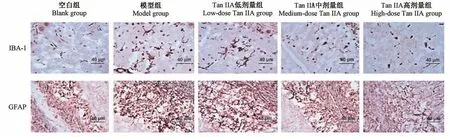
图2 Tan IIA对AD小鼠脑组织中IBA-1和GFAP表达的影响Figure 2 Effects of Tan IIA on the expression of IBA-1 and GFAP in brain tissue of AD mice
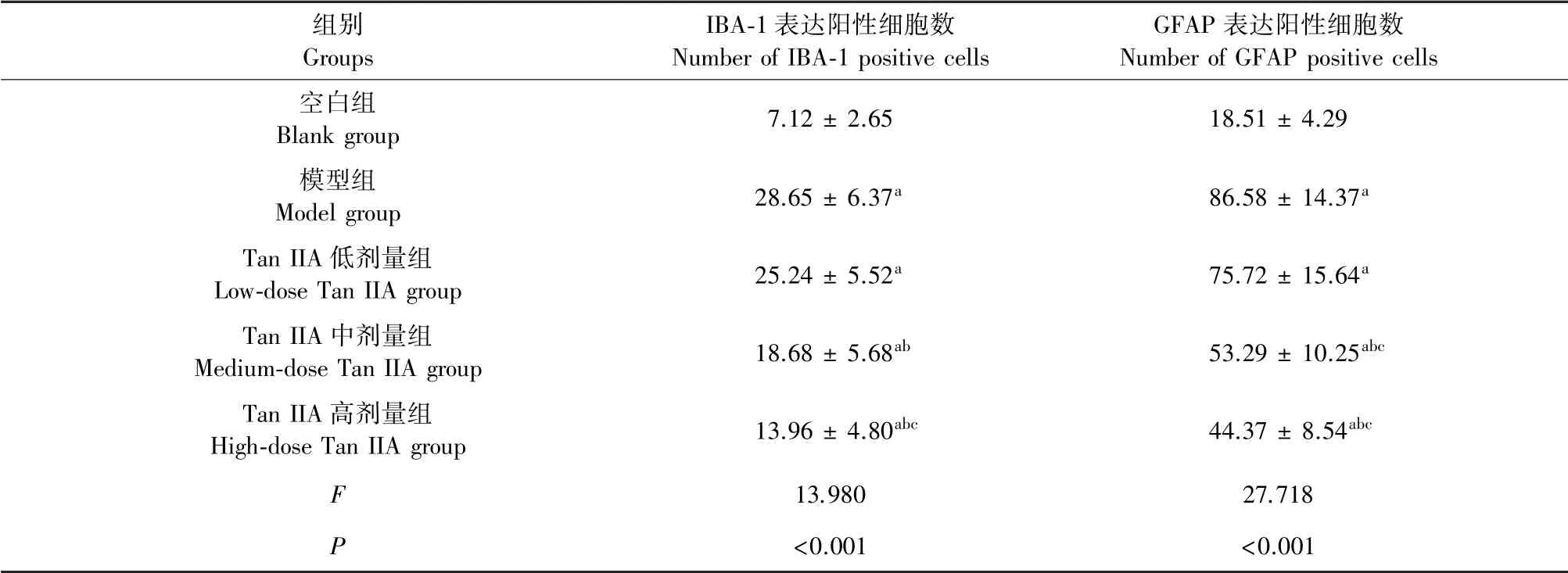
表4 Tan IIA对AD小鼠脑组织中IBA-1和GFAP表达的影响Table 4 Effects of Tan IIA on the expression of IBA-1 and GFAP in brain tissue of AD mice
2.6 对AD小鼠脑组织中相关蛋白表达的影响
与空白组比较,模型组小鼠脑组织匀浆液中p-NF-κB/NF-κB、TLR4水 平 升 高,p-PI3K/PI3K、p-AKT/AKT水平降低,差异具有统计学意义(P<0.05);与模型组比较,Tan IIA中、高剂量组p-NF-κB/NF-κB、TLR4水平降低,p-PI3K/PI3K、p-AKT/AKT水平升高,差异具有统计学意义(P<0.05),以高剂量组变化最为显著,差异具有统计学意义(P<0.05)(见表5,图3)。

图3 Tan IIA对AD小鼠脑组织中相关蛋白表达的影响Note.A.Blank group.B.Model group.C ~ E.Low-dose,medium-dose and high-dose Tan IIA groups.Figure 3 Effects of Tan IIA on the expression ofrelated proteins in brain tissues of AD mice

表5 Tan IIA对AD小鼠脑组织中相关蛋白表达的影响Table 5 Effects of Tan IIA on the expression of related proteins in brain tissues of AD mice
3 讨论
理想的AD动物模型应具备以下特征[8]:(1)表现出认知和记忆功能障碍;(2)具备AD主要的神经病理学表现。LPS是革兰阴性菌外膜的主要成分,可刺激多种炎性因子IL-6、TNF-α等的合成和分泌,诱导级联式炎症反应。据报道,向脑室注射或慢性输入LPS均可诱导学习记忆功能损伤,建立神经炎性AD模型[9]。本研究通过将LPS注入小鼠侧脑室构建AD小鼠动物模型,行为学实验表明,模型小鼠出现明显的空间学习认知障碍和记忆障碍,但并未影响小鼠自发活动能力,同时HE染色显示,模型小鼠神经元结构出现明显改变,排列杂乱,且伴有神经元丢失,这一定程度上模拟了AD神经炎症发病的特点。
现代药理研究表明,Tan IIA可介导多重信号转导通路,发挥抗炎、抗氧化、抗凋亡、神经元保护等作用,广泛应用于心脑血管疾病、肿瘤、更年期综合征等多种疾病的治疗[10]。本研究结果显示,Tan IIA处理后可改善LPS引起的神经细胞形态结构异常,减轻神经元损伤,这与文献报道Tan IIA的神经元保护作用相符[11]。同时,Tan IIA各浓度处理组小鼠逃避潜伏期减少,自由交替反应率升高,这种行为学变化提示Tan IIA可减轻LPS诱导的学习记忆能力损伤。IL-6、TNF-α是强效的促炎细胞因子,在AD患者脑中高表达,诱发神经元过度炎症反应,导致神经元损伤和凋亡,加剧小胶质细胞和星形胶质细胞的活化[12]。ELISA和免疫组化实验表明,Tan IIA处理组小鼠与模型组比,脑组织中IL-6、TNF-α、IBA-1及GFAP表达明显降低,提示Tan IIA在AD小鼠中具有抗炎作用,减少小鼠脑内小胶质细胞和星形胶质细胞增生。
NF-κB是重要的核转录因子,具有多种转录活性调节作用,当受到LPS刺激时,TLR4可特异性识别LPS,将细胞外信号传递至细胞内,激活NF-κB的核转移,进一步上调下游TNF-α等多种炎症介质的表达,参与炎症反应[13]。本研究结果显示,Tan IIA明显抑制AD小鼠脑组织中NF-κB的磷酸化和TLR4的表达,提示Tan IIA可能通过抑制TLR4-NFκB信号转导途径,从而减轻脑内炎症反应。Li等[14]研究指出,Tan IIA可通过激活PI3K/AKT/mTOR信号通路,保护心肌缺血再灌注损伤。PI3K/AKT信号通路也是机体重要的信号通路,研究表明,PI3K/AKT信号通路可参与神经元细胞的分化、生长、增殖及修复等过程,与AD有密切联系[15]。Zhang等[16]研究还显示,隐丹参酮可通过PI3K/AKT信号转导通路,在神经病理性疼痛大鼠中发挥抗炎作用。本研究结果表明,AD小鼠脑组织PI3K/AKT磷酸化水平降低,给予不同剂量Tan IIA处理后,可上调PI3K/AKT磷酸化水平,提示Tan IIA对AD小鼠神经保护作用,可能与上调PI3K/AKT通路有关。
综上所述,Tan IIA可保护AD小鼠神经受损,提高学习记忆能力,可能与激活PI3K/AKT通路、降低脑内炎症反应、抑制小胶质细胞和星形胶质细胞过度激活有关。本研究进一步证实了Tan IIA辅助治疗AD的可能,为Tan IIA的临床应用提供分子理论基础。