小鼠模型脂肪组织中GIPR信号传导在胰岛素抵抗和肝脂肪变性中作用
杨晨,刘宇宏,杨慧玲
(1.西安交通大学医学院附属医院三二〇一医院超声科,陕西 汉中 723000;2.延安大学医学院,陕西 延安 716000;3.解放军第四军医大学第一附属医院西京医院消化内科,西安 710032)
肥胖会导致胰岛素抵抗,其特点是空腹和餐后通过高胰岛素血症以维持血糖正常[1]。它是发展为2型糖尿病和心血管疾病的主要危险因素之一[2-3]。减肥可以使高胰岛素血症正常化,并改善2型糖尿病和动脉硬化的进展。
抑胃多肽/葡萄糖依赖性胰岛素性多肽(GIP)是一种肠内分泌K细胞消化后分泌的肠促胰岛素并通过GIP受体(GIPR)增强胰岛素分泌[4]。HFD诱导肠内分泌K细胞分泌GIP[5],有文献指出,与正常脂肪饮食的老鼠相比,HFD的肥胖老鼠B细胞对GIP的反应使胰岛素分泌增加[6],这表明在HFD诱导的肥胖条件下,GIP在餐后高胰岛素血症中起关键作用。体外研究表明,GIP通过增加脂蛋白脂肪酶诱导脂肪组织的能量积累(LPL)通过CREB和CREB调节的转录共激活因子2(TORC2)介导途径表达,并通过akt介导途径增加LPL酶活性和浆膜GLUT4表达[7]。因此,在HFD条件下,GIP和肥胖之间有很强的联系[5]。GIPR敲除(GIPR-/-)小鼠,GIP拮抗剂和GIP免疫中和抑制GIPR信号转导可改善HFD喂养条件下的肥胖症,提示该情况可能是由于缺乏对脂肪组织的直接和间接GIP作用[8-9]。但是,GIPR信号传导对体内脂肪组织的作用仍不清楚。
在本研究中,建立了GIPRadipo-/-小鼠,采用超声评估脂肪组织中表达的GIP受体在体内HFD诱导的肥胖和胰岛素抵抗中是否起作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
采用小鼠B6N BAC克隆,构建靶向载体。构建的靶向载体注射到C57BL/6小鼠胚胎干细胞中,建立Neo耐药株。从转基因小鼠的杂交中获得了GIPRfl/fl小鼠。通过GIPRfl/fl小鼠繁殖脂肪细胞蛋白2-Cre(Ap2-Cre)小鼠来建立杂合子小鼠(GIPRadipo+/-)。通过与GIPRadipo+/-小鼠杂交获得纯合(GIPRadipo-/-)小鼠。GIPRfl/fl小鼠用作野生型小鼠(WT)。清洁级GIPRadipo-/-和WT小鼠各16只,7周龄,体重约为20 g,来自西安交通大学实验动物中心【SCXK(陕)2020-001】,饲养于西安交通大学实验动物中心实验室【SYXK(陕)2020-001】。各组小鼠饲喂CFD(能量中10%的脂肪)或HFD(能量中60%的脂肪),每组8只小鼠,持续15周。饲养环境:相对湿度约为50%,温度控制在22~25℃,饲养于不锈钢丝笼盖,保持室内空气新鲜,氨浓度不超过20 ppm,换气次数为每小时15次。动物实验通过西安交通大学医学院附属医院动物伦理审查委员会的审批(审批号:DW-HZ3201-005)。
1.1.2 主要试剂与仪器
TRIzol试剂(Invitrogen),PrimeScript RT试剂盒(TaKaRa Bio),ELISA试剂盒:胰岛素(Shibayagi),C肽(Shibayagi),总GIP(Shibayagi),脂联素和瘦素(Millipore),白介素6(IL-6)(R&D Systems),LDLC、HDL-C、TG、NEFA检测试剂盒(Sekisui Medical)。
实时PCR系统(ABI,StepOnePlus,美国),BZ Analyzer软件(KEYENCE Corp.,日本),GE B超扫描仪(GE Healthcare,Logiq P5,美国),图像软件(NIH,ImageJ 1.41o,美国)。
1.2 方法
1.2.1 PCR和微阵列芯片分析
使用TRIzol试剂提取总RNA,采用PrimeScript RT试剂盒将1μg总RNA反转录成cDNA。采用ABI实时PCR系统进行实时定量PCR。采用GAPDH或β-肌动蛋白作为内参对每个样本中表达水平进行标准化。采用8×60 K SurePrint G3基因表达微阵列芯片进行分析。
1.2.2 酶联免疫吸附(ELISA)
采用胰岛素、C肽、总GIP、白介素6(IL-6)、脂联素和瘦素ELISA试剂盒分别测量小鼠胰岛素、C肽、总GIP、IL-6、脂联素和瘦素的水平。1.2.3 口服葡萄糖、胰岛素和丙酮酸耐量试验
禁食16 h后,进行口服葡萄糖耐量测试(OGTT)(1 g/kg体重)。通过葡萄糖氧化酶法测量血糖水平。计算了胰岛素抵抗的HOMA(HOMAIR)。对于胰岛素耐受性试验(ITT),禁食2 h后将人胰岛素按0.75×体重(kg)的剂量对两组小鼠进行皮下注射。对于丙酮酸耐受性测试(PTT),禁食16 h后,将丙酮酸按1 g/kg体重剂量皮下注射到HFD喂养的小鼠中。
1.2.4 脂质指标
HFD喂养15周后,取小鼠空腹血浆标本。通过LDL-C测定试剂盒、HDL-C检测试剂盒、TG检测试剂盒和非酯化脂肪酸(NEFA)检测试剂盒测定LDL-C、HDL-C、甘油三酯(TG)和NEFA水平。提取肝脂质,并测量TG和总胆固醇水平。
1.2.5 超声对肝重量和脂肪含量的定量测量
HFD喂养15周后,将小鼠用戊巴比妥麻醉,固定在小室内,由专业的超声医师对小鼠进行肝超声检查,并使用NIH图像软件对肝体积、肝重量和肝中脂肪含量进行定量评估[10]。
1.2.6 免疫组化
将肝和内脏脂肪样本固定在10%福尔马林缓冲液中,包埋在石蜡中,切成3μm的切片。肝的石蜡切片用苏木精和曙红染色。采用具有BZ-8100系统的显微镜拍摄图像。内脏脂肪切片用3%BSA封闭,并在4°C下与兔抗perilipin-2单克隆抗体一起孵育过夜,然后在室温下与二抗孵育1 h。免疫染色后,通过BZ Analyzer软件分析脂肪细胞平均大小。
1.2.7 免疫印迹
将冷冻的组织提取物切碎并在缓冲液中进行匀浆,然后12 377 r/min离心5 min,对蛋白质进行免疫印迹分析,采用了抗Akt和抗磷酸化Akt(Ser473)抗体进行分析。
1.2.8 细胞培养和体外实验
为了研究了GIP对分化的3T3-L1脂肪细胞中IL-6表达影响。在10μg/mL胰岛素,0.5μmol/L异丁基甲基黄嘌呤,2.5μmol/L地塞米松和10%FBS/DMEM中培养诱导3T3-L1细胞。在10%FBS/DMEM与10μg/mL胰岛素中孵育2 d后,每2 d更换1次培养基。在分化的第9天,将3T3-L1脂肪细胞用100 nmol/L人GIP和2.5μmol/L二肽基肽酶4抑制剂K579预处理3 h,然后分别在5 ng/mL或10 ng/mL小鼠肿瘤坏死因子-α(TNF-α)条件下,用100 nmol/L人GIP和2.5μmol/L二肽基肽酶4抑制剂处理24 h,然后测定各组中IL-6表达水平。
1.3 统计学分析
本研究采用IBM SPSS Statistics 20.0软件开展分析。所有数据均采用平均值±标准差(±s)表示。采用t检验和单因素方差分析Bonferroni事后检验进行数据分析。P<0.05为差异具有统计学意义。
2 结果
2.1 CFD喂养条件下,脂肪组织中GIPR缺乏对体重,葡萄糖耐量和胰岛素敏感性的影响
在CFD喂养条件下,WT和GIPRadipo-/-小鼠的体重增加无显著性差异,两组小鼠间血糖水平、胰岛素水平、GIP总水平差异无显著性。与WT小鼠相比,GIPRadipo-/-小鼠的内脏和皮下脂肪中GIPR mRNA的表达水平显著降低了90%,两组间GIPR mRNA在胰岛,脑和十二指肠中的表达水平差异无显著性(见表1)。

表1 CFD喂养条件下,脂肪组织中GIPR缺乏对体重,葡萄糖耐量和胰岛素的影响Table 1 Effect of GIPR deficiency in adipose tissue on body weight,glucose tolerance and insulin were observed under CFD-fed conditions
2.2 HFD喂养条件下脂肪组织中GIPR缺乏对体重,葡萄糖耐量和胰岛素敏感性的影响
在HFD喂养下,GIPRadipo-/-小鼠的体重增加明显低于WT小鼠(图1A)。两组之间的血糖和总GIP水平无统计学差异。与WT小鼠相比,GIPRadipo-/-小鼠的C肽水平和胰岛素水平显著降低(P<0.05),但两组之间的食物摄入量差异不显著。此外,两组之间的葡萄糖AUC、胰岛素的AUC和GIP的AUC差异均无统计学意义(见表2)。
GIPRadipo-/-小鼠的HOMA-IR值显著低于WT小鼠(P<0.001)。ITT数据显示,与WT小鼠相比,GIPRadipo-/-小鼠的血糖水平显著降低(P<0.001)。与WT小鼠相比,GIPRadipo-/-小鼠PTT期间血糖水平显著降低(P=0.009)(见表2)。此外,与WT小鼠相比,GIPRadipo-/-小鼠的组织中Akt磷酸化都增加(见图1B)。

表2 HFD喂养条件下,脂肪组织中GIPR缺乏对葡萄糖耐量和胰岛素的影响Table 2 Effect of GIPR deficiency in adipose tissue on glucose tolerance and insulin under HFD-fed conditions

图1 小鼠的体重变化及不同组织中的总Akt(P)和磷酸化-Akt(Ser473)结果Note.Compared with WT mice,**P<0.05,***P<0.01.Figure 1 Changes in body weight of mice and results of total Akt(P)and phosphorylated-Akt(Ser473)in different tissues
GIPRadipo-/-小鼠的空腹TG水平显著低于WT小鼠。两组之间的LDL-C,HDL-C和NEFA水平无显著差异(见表3)。以上结果表明,在HFD条件下,脂肪组织中的GIPR缺乏会降低肝胰岛素抵抗。

表3 HFD喂养WT和GIPRadipo-/-小鼠空腹血脂水平Table 3 Fasting plasma lipid levels in HFD-fed WT and GIPRadipo-/-mice
2.3 脂肪组织中的GIPR缺乏可减少HFD喂养小鼠的肝脂肪变性,但不能减少脂肪量
通过对perilipin-2进行免疫染色来比较脂肪细胞的大小,两组之间的脂肪细胞大小无显著性差异(图2A)。超声结果显示,GIPRadipo-/-小鼠肝体积、脂肪含量及肝重量显著低于WT小鼠。肝的组织学分析表明,GIPRadipo-/-小鼠的脂滴大小和数量均比WT小鼠小(图2B),此外,GIPRadipo-/-小鼠的肝中TG含量显著低于WT小鼠,但总胆固醇含量差异无显著性(见表4)。结果表明,在HFD喂养的条件下,脂肪组织中的GIPR缺乏可减轻肝脂肪变性。
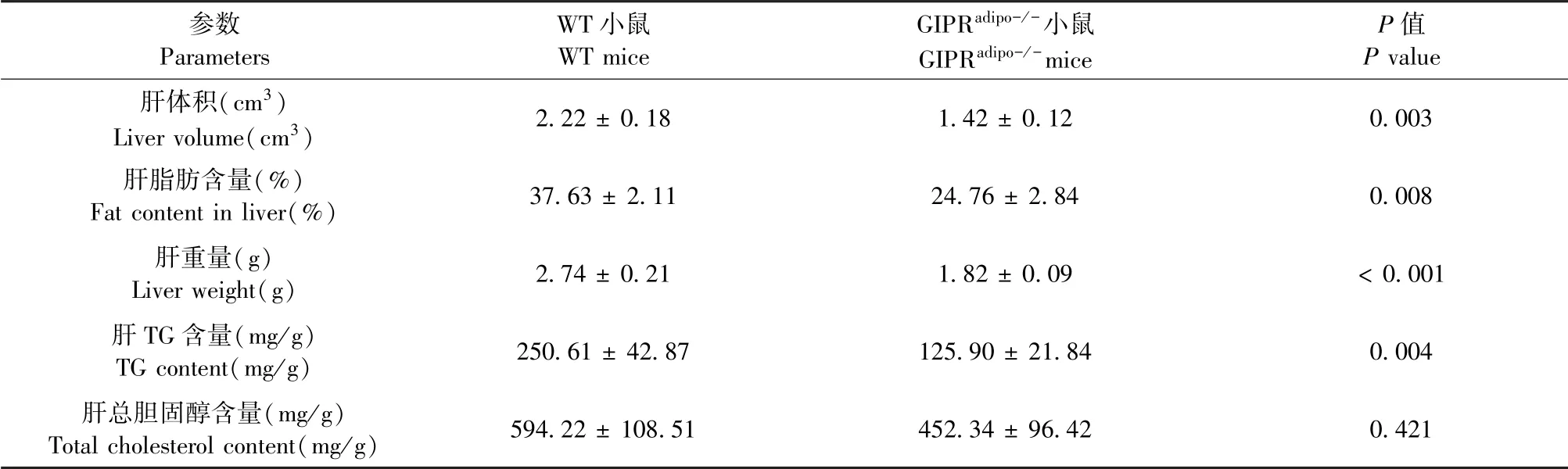
表4 HFD喂养小鼠肝脂肪及胆固醇水平Table 4 Liver fat and cholesterol levels in HFD-fed WT and GIPRadipo-/-mice

图2 小鼠皮下脂肪免疫组化及肝的苏木精和曙红染色结果(n=8)Figure 2 Immunohistochemical results of subcutaneous fat and hematoxylin and eosin staining results of liver in mice(n=8)
2.4 GIPR缺乏抑制脂肪组织中HFD诱导的IL-6 mRNA表达
两组在HFD喂养的条件下,TNF-α、单核细胞趋化蛋白1(MCP1)和IL-1βmRNA的表达水平没有差异。HFD喂养的GIPRadipo-/-小鼠的IL-6 mRNA表达水平显著低于WT小鼠。在HFD喂养的条件下,两组之间的血浆脂联素和瘦素水平也无显著性差异(见表5)。

表5 HFD喂养条件下相关炎性细胞因子相对mRNA表达水平(n=8)Table 5 Relative mRNA expression levels of related inflammatory cytokines under HFD-fed conditions(n=8)
此外研究了GIP对分化的3T3-L1脂肪细胞中IL-6表达影响。IL-6 mRNA表达没有被GIP刺激所增强(图3A)。GIP处理后,细胞中IL-6水平显著增加,但IL-6水平的增加非常小(图3B)。然而,GIP显著增强了IL-6 mRNA表达(图3C)和IL-6产生(图3D)在存在TNF-α的3T3-L1脂肪细胞中,表明GIP增强了TNF-α诱导的3T3-L1脂肪细胞中IL-6的表达和产生。
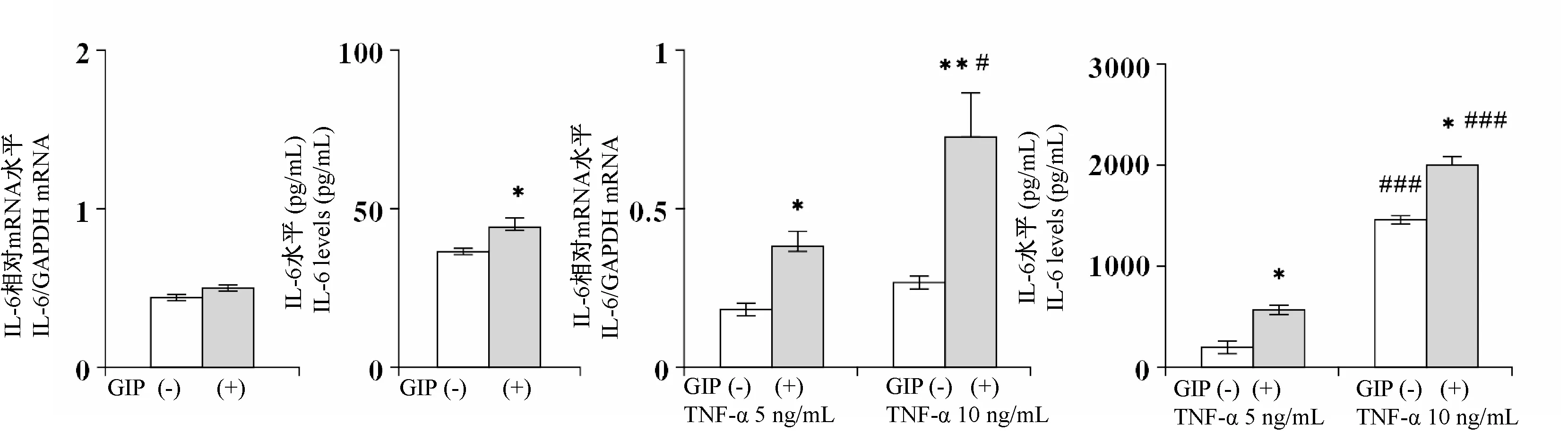
图3 在存在或不存在TNF-α的情况下,经GIP(100 nmol/L)处理24 h的3T3-L1脂肪细胞中IL-6 mRNA表达水平和血浆IL-6水平Note.Compared with untreated groups,*P<0.05,**P<0.05.Compared with GIP treatment groups in the prescience of 5 ng/mL TNF-α,#P<0.05,###P<0.001.Figure 3 IL-6 mRNA expression levels and plasma IL-6 levels in 3T3-L1 adipocytes treated with GIP(100 nmol/L)for 24 h with or without TNF-α
3 讨论
本研究采用超声评估了GIP在GIPRadipo-/-小鼠体内脂肪组织中的直接作用。与HFD喂养的WT小鼠相比,GIPRadipo-/-小鼠表现出更低的体重,胰岛素抵抗降低和改善肝脂肪变性。
尽管食物摄入,能量消耗方面的差异不明显,但GIPRadipo-/-小鼠的体重增加明显低于WT小鼠。这种作用可能是由于GIPRadipo-/-小鼠从肠道吸收的卡路里减少或用于检测小鼠之间体重差异的方法存在一定局限性。此外,超声分析发现和WT小鼠比,GIPRadipo-/-小鼠肝重量、脂肪含量及肝体积下降。在HFD喂养的条件下,与WT小鼠相比,GIPRadipo-/-小鼠肝重量减少对总体体重减轻的贡献约为45%,说明体重的降低部分是由于GIPRadipo-/-小鼠肝重量的减少。已有研究发现与对照组GIPR-/-小鼠相比,具有Ap2启动子-GIPR转基因的GIPR-/-小鼠体重增加,这不是由于脂肪量的增加而是瘦肉质量的增加[11]。
脂肪组织中由GIPR信号传导调节的关键分子可能与HFD诱导的胰岛素抵抗和肝脂肪变性有关,因为在由HFD喂养的GIPRadipo-/-小鼠中胰岛素抵抗和肝脂肪变性降低。对脂肪组织的微阵列分析显示,在GIPRadipo-/-小鼠的脂肪组织中,IL-6的表达降低。IL-6参与炎症和代谢过程的调节,IL-6的循环水平与肥胖呈正相关,脂肪来源的IL-6在诱导胰岛素抵抗和肝脂肪变性中起关键作用[12-13]。已有体外研究报道了GIP直接增加脂肪组织IL-6的表达水平[14],GIP还可激活脂肪组织中的CREB[15]。本研究结果表明TNF-α以剂量依赖的方式显著提高了GIP诱导的IL-6表达,表明在脂肪组织存在的情况下,GIP可以增强脂肪组织中IL-6 mRNA的表达。
有文献指出,在人脂肪细胞中存在TNF-α的情况下,GIP诱导IL-6 mRNA表达并增强IL-6分泌[15]。与此一致,本研究在喂食HFD的GIPRadipo-/-小鼠的脂肪细胞中IL-6 mRNA表达降低。因此,GIPRadipo-/-小鼠可能有助于研究GIPR在体内脂肪组织中表达的GIPR在肥胖和胰岛素抵抗中的作用。这些数据表明,在HFD诱导的胰岛素抵抗和肝脂肪变性的治疗中,GIP信号的抑制可能具有作为治疗靶标的潜力。
总之,在体内,脂肪组织中的GIPR信号传导在HFD诱导的胰岛素抵抗和肝脂肪变性中起重要作用,这可能涉及IL-6信号传导。