丛枝菌根真菌对砷胁迫下棉花根系形态和生理特征的影响
刘凯洋,邱智军,张巧明,张盎然, 龚明贵*
(1 河南科技大学 食品与生物工程学院,河南洛阳 471023;2 河南科技大学 园艺与植物保护学院,河南洛阳 471023;3 河南科技大学 食品与生物工程学院,微生物资源开发与利用重点实验室,河南洛阳 471023)
砷(As)是一种在自然界中有着广泛分布的类金属元素,其毒性极强且难以降解。由于含砷矿物的开采冶炼、农药化肥的应用以及煤的燃烧等因素,大量的砷元素排放到土壤或水环境中,造成全球范围内不可逆的砷污染[1]。据世界卫生组织公布,全球至少有5000多万人口正面临着严重的砷中毒状况,极大地威胁了全球的环境安全和人类健康,其中大多数为亚洲国家,而中国正是受砷中毒危害最为严重的国家之一[2]。砷可与植物体内咪唑、羧基等结构间接结合或与DNA、蛋白直接结合,从而干扰植物体内一系列正常的酶促反应[3-4]。过量的砷可使植物体内积累大量的活性氧,其极强的氧化性能够破坏核酸结构、影响相关氨基酸同化,使植物抗氧化、渗透调节系统遭到损伤,影响植物的根系发育和生长品质[5-7]。砷还可通过在作物食用部分的积累经食物链危害人体健康[8],如何提高重金属污染土壤修复效率成为备受瞩目的问题。
丛枝菌根真菌(arbuscular mycorrhizae fungi,AMF)广泛存在于土壤中,可与大多数陆生植物建立菌根共生体系,能够明显提高植物抵御生物和非生物胁迫的能力[9]。菌根共生系统可加强寄主植物对磷、氮、钾等养分的吸收,在增强宿主植物生长发育的同时保证AMF正常的生命活动[10]。在重金属污染土壤中,AMF可发挥过滤、螯合作用,通过巨大的菌丝网络吸附大量重金属,或通过丛枝、泡囊等结构将重金属“区室化”,将其固定在共生界面中从而抑制重金属在植物体内的转运能力,进一步减弱重金属毒害效应[11-12]。利用AMF提高植物的重金属耐受性成为植物修复重金属污染土壤的重点。AMF接种可促使As污染土壤中刺槐(RobiniapseudoacaciaL.)植株菌根化,通过刺激刺槐的生长和根系发育增强其自身砷耐受能力[5]。AMF能通过提高接种玉米(ZeamaysL.)叶片中保护酶活性,降低根系对砷的吸收及砷向地上部的转移系数来减轻砷毒害,从而使玉米耐砷性得到提升[13]。
棉花(Gossypiumspp.)又名陆地棉,为锦葵科棉属,是中国重要的农作物和经济作物,其种植范围广,易于栽培管理。有研究表明,棉花抗逆性良好,是土壤重金属污染修复的优势作物,其较大的生物量或可从土壤中吸收更多的重金属,且棉花本身易于拔除转移,不会造成再次污染[14]。近年来广大学者就植物对砷的耐受机理做了大量研究,但主要集中在蔬菜作物和粮食作物上,有关砷对棉花生长、生理特征影响的报道并不多,砷胁迫下AMF影响棉花耐砷性的研究更为鲜见。因此,本研究采用盆栽试验方式对不同浓度砷胁迫下AMF接种棉花的生长状况、砷稳定性、根系形态特征以及根和叶的渗透调节能力、抗氧化能力等方面进行综合性考察,进一步明确AMF对棉花耐砷能力的影响,旨在探究AMF提高棉花耐砷性的可能机制,为AMF在土壤砷污染修复中的应用提供新思路。
1 材料和方法
1.1 试验材料
参试棉花品种为‘大铃棉69号’,种子由中国农业科学院棉花研究所提供。供试菌种由北京市农林科学院植物营养与资源研究所提供,分别为根内根孢囊霉(Rhizophagusintraradices,编号BGC BJ09)和摩西斗管囊霉(Funneliformismosseae,编号BGC XZ02A)。接种体由菌根碎片、孢子、根外菌丝体和沙子组成。供试土壤为黄土和沙土,均从河南科技大学植物园获得。
1.2 材料培养与处理
选取饱满的棉花种子用75%乙醇消毒15 min,再用去离子水将种子冲洗数次直至其表面无乙醇残留,在恒温水浴30 ℃下泡发12 h使其充分吸收水分,将泡发后种子的种皮剥去,然后置于搪瓷托盘中,28 ℃恒温条件下培养至出芽。
将黄土、沙土过2 mm筛网,黄土在121 ℃和0.11 MPa条件下蒸压2 h,沙土在180 ℃下干热灭菌2 h,将灭菌后的黄土和沙土按2∶1均匀混合成土壤基质,土壤基质中有机质含量为17.38 g/kg,有效氮含量为37.84 mg/kg,有效磷含量为8.17 mg/kg,有效钾含量为103.47 mg/kg,pH 7.8,As5+浓度为7.72 mg/kg,Fe3+浓度为4.82 mg/kg,Mn2+浓度为1.87 mg/kg,Cu2+浓度为0.21 mg/kg,Zn2+浓度为1.02 mg/kg。以喷洒Na3AsO4·12H2O水溶液的方式加入外源As,使土壤As浓度分别为100 mg/kg(中度污染)、200 mg/kg(重度污染)(下文中包含As含量测定在内所提及的As浓度均为As5+浓度),不喷洒砷盐溶液的土壤基质设为空白对照,即0 mg/kg。在塑料花盆(底径15 cm、上径18 cm、高度25 cm)中分别装入3.0 kg不同As浓度的土壤基质。
盆栽试验在2020年5月至8月进行,设计不接种(CK)、根内根孢囊霉接种(简称RI)和摩西斗管囊霉接种(简称FM)3组接种处理,在RI和FM处理组的每个花盆距土壤表面1/3深度层接种30 g相应的菌根混合物,CK处理组接种经高温灭菌的同重量菌种。在距土壤表面2 cm深度层播种4~5粒出芽程度一致的棉花种子,出苗2周后每盆保留2株长势较好的棉花幼苗,每组处理10次重复。本试验在自然环境条件下进行,生长温度为20~35 ℃,相对湿度为50%~75%。棉花生长过程中,为了减轻磷对丛枝菌根真菌菌丝生长的抑制,每周浇磷含量为原配方1/4的Hoaglang’s营养液[15]50 mL。
1.3 测定指标及方法
棉花培养90 d后(8月16日)收获取样,将每组处理收获后的新鲜棉花植株随机分为三部分,一部分新鲜的植株用于侵染率、生长指标和根系形态参数测定,一部分植株用于As含量及转移系数测定,一部分植株冲洗干净后取根系和叶片保存于4 ℃冰箱进行生理指标的测定。每项指标取样均重复3次。
1.3.1 菌根侵染率将新鲜的棉花根系冲洗干净吸去表面水分,按照Philips的方法进行染色[16],在光学显微镜下观察其根外菌丝及丛枝的侵染情况,并应用Giovannetti的菌根侵染评价方法测定侵染率[17]。
1.3.2 幼苗生长指标将收获后的棉花根部多余土壤扫去,用去离子水冲洗后吸去多余水分。先用刻度尺测量其株高,然后将其分为根和地上部分,一部分根用于根系活力测定,余下的根与地上部分于70 ℃烘干至恒重,称得干重,并依据测定结果计算根冠比(根冠比=根干重/地上部干重)。根系活力采用TTC还原法测定[17]。
1.3.3 植株As含量及转移系数采用HNO3-HClO4法将植物样品消解后,使用ICP-OES测定棉花体内As浓度,引入转移系数评价棉花体内As积累状况及耐性[18],转移系数=地上部As浓度/地下部As浓度。
1.3.4 根系形态参数与构型用自来水将棉花植株完整的根部冲洗干净,使用根系扫描仪扫描,并用配套的Win-RHIZO2003b软件分析其总根长、根直径、根表面积、根体积、根尖数和根叉数与根系直径构型。
1.3.5 根系及叶片生理指标采用浸提法测定棉花根、叶的相对电导率。精确称取0.2 g植物组织,加50 mL去离子水,25 ℃下静置12 h,测电导率记为R1,而后沸水浴10 min,测电导率记为R2,相对电导率= R1/R2×100%。丙二醛(MDA)含量、可溶性糖、可溶性蛋白、脯氨酸含量参照李合生的方法测定[19]。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性参照高俊凤的方法测定[20]。
1.4 数据分析
以上所有试验均重复测量3次,采用SPSS 23.0软件进行数据统计分析,结果用平均值±标准差表示。采用单因素方差分析(Duncan多重对比检验,P<0.05)检验各指标在不同处理间的差异显著性。采用Excel 2019 制作图表。
2 结果与分析
2.1 As胁迫对棉花根系AMF侵染率的影响
在不接种处理组所有植株中均未观察到AMF侵染的棉花根系,即AMF侵染率均为0;在接种处理组中,AMF与棉花根系的共生关系明显,根外有相互缠绕的菌丝,根细胞内有丛枝出现(图1)。由图2可知,随着As浓度的增加,棉花根系总侵染率和丛枝侵染率均呈逐渐下降的趋势,可能是由于As的胁迫对AMF侵染根细胞和菌根共生体发育环境产生了不利影响。其中,RI接种组棉花根系的总侵染率和丛枝侵染率在As胁迫下均比空白对照(0 mg/kg)显著降低,降幅分别为28.14%、44.06%和21.11%、39.03%;FM接种组棉花根系的总侵染率和丛枝侵染率在200 mg/kg As胁迫下也显著降低,降幅分别为33.29%和31.32%。同时,在同一As胁迫条件下,FM接种组根系的总侵染率和丛枝侵染率大多显著高于RI接种组。可见,摩西斗管囊霉对棉花根系的侵染率更高,受到As胁迫后侵染率下降幅度更小,它在As污染土壤环境下更具与棉花建立菌根共生体系的优势。
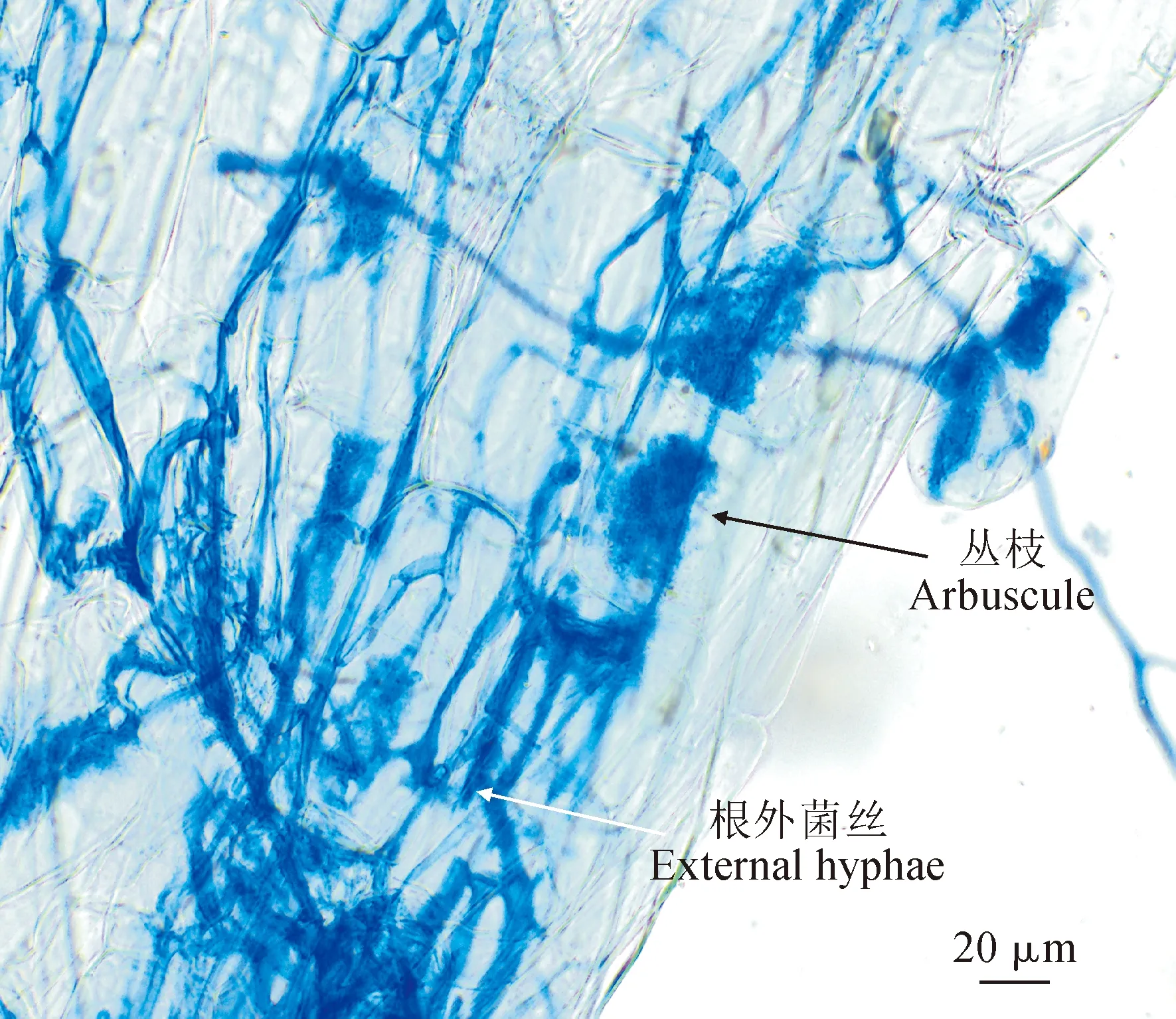
图1 棉花根系AMF(根内根孢囊霉)侵染情况Fig.1 AMF (Rhizophagus intraradices) infection status in the cotton roots
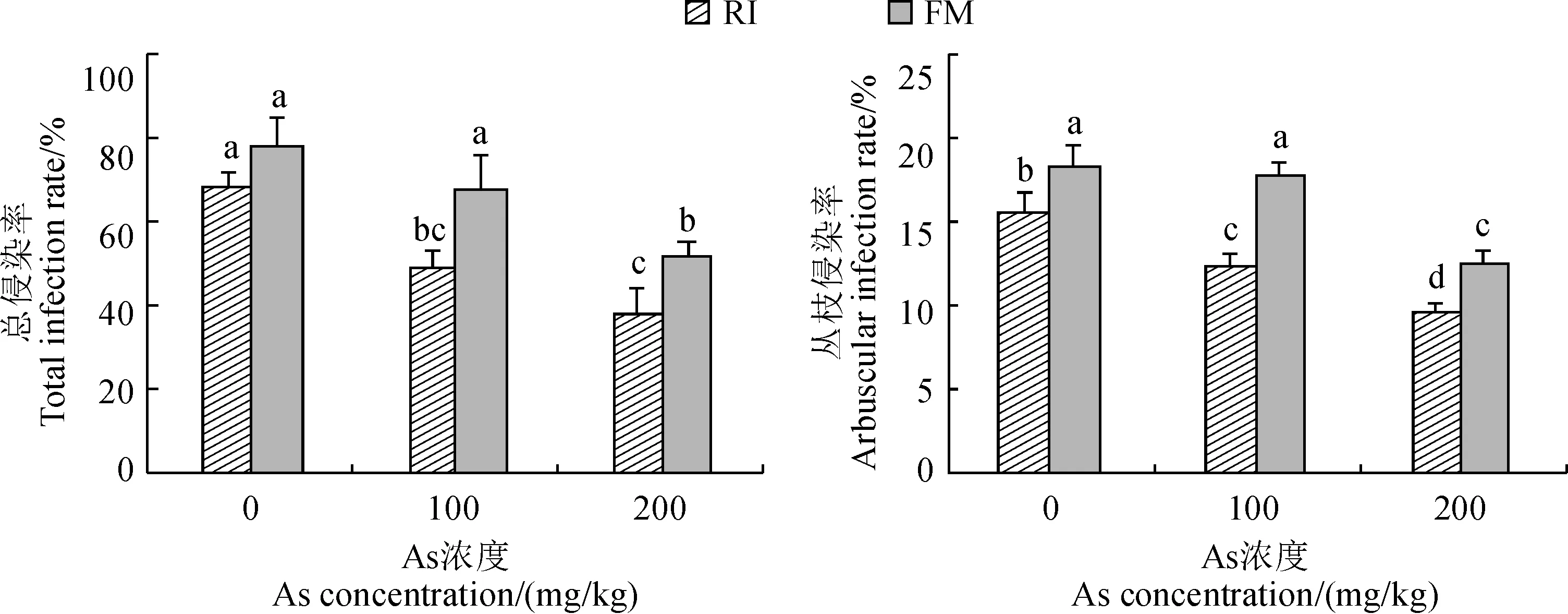
RI.根内根孢囊霉接种;FM.摩西斗管囊霉接种,柱上不同小写字母代表处理间在0.05 水平存在显著性差异(P<0.05),下同图2 不同As浓度下棉花根系中AMF侵染率RI. Inoculation with Rhizophagus intraradices; FM. Inoculation with Funneliformis mosseae; The different normal letters on the column indicate significant differences among treatments at 0.05 level (P < 0.05), the same as belowFig.2 AMF infection rate in the cotton roots under different As concentration treatments
2.2 As胁迫下AMF接种对棉花植株生长指标的影响
随着As浓度的增大,各接种处理组棉花株高、根干重、地上部干重、根冠比和根系活力均呈下降趋势;在相同As浓度下,AMF接种组棉花各生长指标相比于不接种处理(CK)均有不同程度的增加,且FM接种处理的效果优于RI接种处理(表1)。其中,无外源As胁迫时,RI接种组棉花株高、单株干重、根冠比和根系活力分别比CK显著提高了22.05%、28.15%、8.33%和30.13%,FM接种组则分别显著提高34.55%、31.96%、22.22%和57.21%;在100 mg/kg As胁迫下,RI和FM接种处理以上各生长指标分别提高了15.10%、37.50%、35.65%、36.00%和37.93%、59.76%、44.35%、93.73%,且除RI接种处理的株高外均达到显著水平;在200 mg/kg As胁迫下,RI接种处理仅根系活力比CK显著提高了28.97%,FM接种处理以上各指标仍均显著高于CK,增幅分别为31.78%、54.81%、27.35%和98.63%。可见,As胁迫可抑制棉花生长,AMF接种可以同时显著促进非胁迫和胁迫下棉花植株的生长,显著缓解As胁迫的抑制效应,且FM接种缓解As毒害的作用比接种RI程度更高、效果更好。

表1 不同As浓度下AMF接种对棉花植株生长状况的影响
2.3 As胁迫下AMF接种对棉花体内As积累的影响
棉花地上部和地下部的As浓度均随外源As浓度增大而快速增加,但地上部As浓度总是低于地下部(表2)。其中,在无外源As胁迫时,AMF接种组棉花地上部、地下部As浓度与CK差异性不显著;在外源As浓度为100 mg/kg时,RI和FM接种组棉花地上部As浓度分别显著降低44.24%和49.92%,而其地下部As浓度均无显著变化;在外源As浓度为200 mg/kg时,RI和FM接种组棉花地上部As浓度分别显著降低11.14%和31.94%,地下部As浓度分别显著降低了8.14%和20.62%。同时,外源As浓度为0、100、200 mg/kg时,RI接种组棉花As转移系数分别显著降低了22.92%、38.10%和2.44%,FM接种组则分别显著降低了47.92%、47.62%和12.20%。可见,AMF可能通过促进植株生长来显著稀释、降低棉花体内的As浓度,同时能够改变棉花体内As的分配,限制其向地上部迁移,降低了As在棉花地上部的富集,且FM接种的效果更好。

表2 不同As浓度下AMF接种对棉花体内As积累的影响
2.4 As胁迫下AMF接种对棉花根系形态与构型的影响
各接种组棉花根系特征参数均随着外源As浓度的增大而减小,CK和RI接种组多在100 mg/kg As胁迫时就比无As胁迫处理(0 mg/kg)显著降低,而FM接种组仅在200 mg/kg As胁迫时显著降低;AMF接种可使棉花总根长等根系形态指标比不接种组(CK)显著提高,且FM接种组的促进效果总是优于RI接种组(图3)。其中,RI接种组棉花总根长在0和100 mg/kg As处理时与CK无显著差异,在200 mg/kg As时比CK显著提高26.07%,而FM接种组棉花总根长在0、100、200 mg/kg As时均比CK显著提高,增幅分别为41.67%、70.85%和71.21%;与无As胁迫相比,CK、RI接种和FM接种处理总根长在200 mg/kg As胁迫时分别显著下降36.07%、38.17%和22.74%。由此可知AMF接种可有效促进As胁迫下棉花根系发育,提高总根生长量,但随着As胁迫加重FM接种处理组的总根长下降的幅度更小。除总根长外,As胁迫下各接种处理组其余根系特征参数根直径、根面积、根体积、根叉数和根尖数的表现亦是如此。
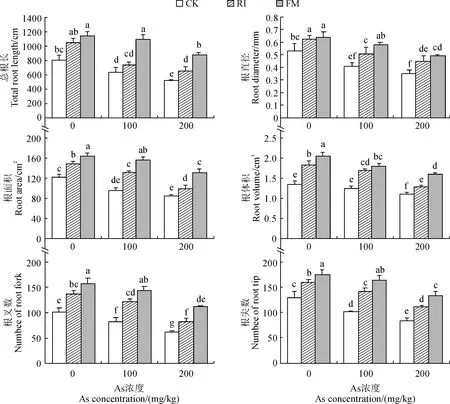
图3 不同As浓度下AMF接种对棉花根系形态参数的影响Fig.3 The morphological parameters of cotton roots with AMF inoculation under different As concentration treatments
同时,图4显示,无接种处理(CK)时,随着As胁迫加重,棉花0~0.2 mm径级根长百分比逐渐增大,而0.5~1.0 mm和 >1.0 mm径级根长百分比逐渐降低。在相同As胁迫浓度下,AMF接种降低了棉花0~0.2 mm径级根长百分比,而增加了0.5~1.0 mm和 >1.0 mm径级根长的百分比。其中,在无外源As胁迫时,RI和 FM接种组棉花0~0.2 mm径级根长百分比分别下降了21.43%和23.43%,而 >1.0 mm径级的根长百分比分别增加了58.97%和97.44%,FM接种使棉花表现出更高的耐As性;在100、200 mg/kg As胁迫时,FM接种组棉花1.0 mm径级根长百分比的增长幅度低于RI接种组,但其0.2~0.5 mm、0.5~1.0 mm径级根长百分比的增长幅度却高于RI接种组。结合图3可知,FM接种处理使棉花表现出的整体耐As性更优,减缓As毒性能力更强。可见,As胁迫能够明显抑制棉花根系发育,而AMF接种能有效促进As胁迫根系生长发育,减缓在As污染土壤中遭受的根际胁迫。

CK.不接种;RI.根内根孢囊霉接种; FM.摩西斗管囊霉接种; 0、100、200分别表示外源As浓度为0 、100 和200 mg/kg图4 不同As浓度下AMF接种对棉花各径级根长占总根长百分比的影响CK. Non-inoculation; RI. Inoculation with Rhizophagus intraradices; FM. Inoculation with Funneliformis mosseae; 0, 100 and 200 mg/kg. The concentration of exogenous As was 0, 100 and 200 mg/kg, respectivelyFig.4 Percentage of root length in different diameter classes in cotton plants with AMF inoculation under different As concentration treatments
2.5 As胁迫下AMF接种对棉花根系和叶片细胞膜透性的影响
相对电导率和MDA含量是评价细胞膜过氧化及损伤程度的重要指标。由图5可知,随着As胁迫浓度增大,各接种组棉花根和叶相对电导率和MDA含量均呈逐渐显著增大的趋势,说明As胁迫使棉花体内产生大量自由基,降低了棉花根、叶细胞膜的稳定性。在同一浓度As胁迫下,AMF接种组棉花根和叶的相对电导率、MDA含量基本表现出一致的下降趋势,而根系相对电导率和MDA含量均明显高于相应叶片,说明As胁迫对棉花根细胞膜的损伤程度高于叶细胞膜,接种AMF能有效缓解这种损伤。其中,在无外源As胁迫时,仅FM接种组棉花叶片相对电导率显著降低,而RI和FM接种组根系、叶片的MDA含量均显著降低,FM接种组降幅分别为36.33%、38.7%;在100、200 mg/kg As胁迫下,FM接种组表现出比RI接种组更强的缓解效应,FM接种组棉花根和叶中相对电导率分别降低了31.12%、23.69%和30.88%、44.09%,其根和叶中MDA含量分别相应降低了41.71%、39.44%和45.90%、27.61%。说明AMF接种能够有效缓解As胁迫诱导的过氧化作用,显著提高其细胞膜的稳定性,有效降低了As对棉花根、叶细胞的毒害。

图5 不同As浓度下AMF接种对棉花膜透性的影响Fig.5 The membrane permeability in cells of cotton leaves and roots with AMF inoculation under different As concentration treatments
2.6 As胁迫下AMF接种对棉花根系和叶片渗透调节物质含量的影响
由表3可知,各接种组棉花根和叶中可溶性糖含量均随着As胁迫浓度增大呈逐渐降低趋势,但仅叶中可溶性糖含量在As浓度间差异显著;在0、100、200 mg/kg As处理下,接种组棉花根和叶中可溶性糖含量均比不接种组(CK)不同程度增加,且FM接种组增幅大于RI接种组,根增幅大于叶片,其中的FM接种组根系可溶性糖含量分别比CK显著提高了101.45%、78.16%和83.62%,而其叶片分别增加32.68%、15.90%和46.43%。同时,各接种组棉花根和叶中可溶性蛋白含量也随As浓度升高而显著降低,且根中降幅更大;AMF接种组棉花根中可溶性蛋白含量在0、100 mg/kg处理时均比CK组显著提高,在200 mg/kg As胁迫下稍有增加,而其叶部可溶性蛋白含量在各As浓度胁迫下均与CK无显著差异,但总体上FM接种组叶部可溶性蛋白的积累能力均优于RI接种组;FM接种组根系可溶性蛋白含量在0、100 mg/kg As浓度下分别比相应CK组显著提高了17.97%、29.80%,RI接种组则分别显著增加22.61%和33.52%。另外,各AMF接种组棉花叶和根中脯氨酸含量均随As浓度升高而降低,RI接种组降幅在100 mg/kg处理时即达到显著水平,CK和FM组降幅均在200 mg/kg处理时达到显著水平;AMF接种组脯氨酸含量大多比相应CK显著提高,RI接种组根和叶中脯氨酸含量分别提高了4.67%~23.24%和19.31%~27.87%,FM接种组则分别提高了12.83%~26.85%和32.23%~39.09%。可见,As胁迫使棉花根和叶内可溶性糖、可溶性蛋白、脯氨酸积累受到了阻碍,体内渗透平衡遭到了明显破坏;AMF接种可使这种毒害效应得到显著缓解,有效促进棉花根和叶片中渗透调节系统的平衡。

表3 不同As浓度下AMF接种对棉花根和叶渗透物质含量的影响
2.7 As胁迫下AMF接种对棉花根系和叶片抗氧化酶活性的影响
如图6所示,随着外源As胁迫浓度的增加,各接种组棉花根和叶的SOD、POD、CAT活性均呈现出相似的逐渐降低趋势,且其降幅均在200 mg/kg As胁迫时达到显著水平,说明As胁迫下棉花根和叶的抗氧化酶活性被抑制,抗氧化能力明显减弱。在同一As浓度胁迫下,AMF接种组棉花根和叶的SOD、POD、CAT活性均比不接种处理(CK)有不同程度提高,而FM接种组又始终高于相应的RI接种组,且FM接种组根和叶的抗氧化酶活性多与相应CK差异显著,RI接种组与相应CK组差异大多不显著,即FM接种对棉花抗氧化酶活性提升幅度高于RI接种。其中,在200 mg/kg As胁迫时,FM接种组棉花根部SOD、POD、CAT活性分别比相应CK组显著提高32.55%、37.50%和81.80%,叶部活性分别显著提高71.94%、53.75%和91.35%。以上结果表明As胁迫会明显抑制棉花体内抗氧化酶活性,AMF接种可增强体内酶促抗氧化系统调节能力从而缓解As对棉花毒性作用,提高棉花酶促抗氧化系统在As污染环境中的稳定性,且FM接种缓解As氧化胁迫的能力更强。

图6 不同As浓度下AMF接种对棉花根和叶抗氧化酶活性的影响Fig.6 The antioxidant enzyme activities in the leaves and roots of cotton with AMF inoculation under different As concentration treatments
3 讨 论
AMF接触到植物细胞壁后可在细胞内部形成“丛枝”结构,丛枝是吸附、固定重金属的一种主要结构[21]。本研究中两种AMF(根内根孢囊霉和摩西斗管囊霉)接种后棉花根系总侵染率和丛枝侵染率均随As浓度增大而下降,但FM接种总侵染率与丛枝侵染率下降幅度均较RI接种低。Zhang等[5]的研究表明随着As胁迫的加重RI对刺槐侵染率有不同程度的下降,本试验结果与之具有一致性,可能是由于As毒害抑制了AMF孢子萌发和菌丝生长[11];张莘等[11]发现不同种类的AMF对As耐受性不同,本研究通过测定侵染率表明FM较RI具有更强的耐As能力。
植物株高、生物量等生长指标是植物受重金属伤害最直观的表现,根系活力直接影响植株生长状况。As的化学结构与P相似,As5+可通过细胞膜上的磷转运通道进入植物体内造成ATP产能下降,影响其光合代谢,进而影响其生长发育[7]。本研究中,As胁迫明显抑制了棉花生长发育与根系活力,AMF接种可显著提升As胁迫棉花株高、生物量与根系活力,并提高了生物量在根系的分配比,这可能是由于AMF提升了棉花吸收微量元素及水分的能力或抑制了磷高亲和吸收系统,从而促进了植株生长[11]。同时,本研究中棉花地下部As浓度总是高于地上部,AMF接种可降低棉花地下部和地上部分的As浓度并显著降低其转移系数,阻止As向地上部迁移。赵宁宁[22]报道,As胁迫蜈蚣草(PterisvittataL.)叶片中As浓度高于根部,而玉米各同器官中As积累量依次为根>茎>叶,这与不同种类植物的富集差异性有关;有研究表明,幼套近明球囊霉(Claroideoglomusetunicatum)接种可有效促进As污染下玉米的生长发育,并将As固定在玉米根系中,降低其叶中As浓度和有效转移系数,缓解As毒害作用[22],本研究结果与之一致。
根系作为与土壤接触最近的部分以及植物吸收、合成的主要器官,其发育经常受到重金属毒性的影响,根伸长程度、根叉和根尖数等指标是判断根系发育是否良好的形态特征参数[23],根系形态参数是植物重金属耐受性的重要衡量标准。本研究中棉花各根系形态参数均随着As胁迫加重而呈逐渐下降的趋势。这是植物逆境下自我保护的表现,通过减少根的分布来抵御逆境带来的伤害,以最小化的生理代谢最大限度地获取养分[24],但AMF接种可显著提高根系形态指标以缓解毒害效应。同时,As胁迫增大了0~0.2 mm直径级的根长比,减小了0.5~1.0 mm和 >1.0 mm直径级的根长比,而AMF接种降低了0~0.2 mm径级的根长百分比,增大了0.5~1.0 mm和 >1.0 mm径级的根长百分比。这与Zhang等[5]报道的RI接种可有效促进As胁迫下刺槐根系发育的研究结果相似,由此说明AMF接种可通过影响植物根系形态来提高其耐As性。
在生理代谢方面,植物具备一套渗透调节保护机制来维持As胁迫下细胞的结构和功能[25]。随着As胁迫加重,本研究中棉花渗透调节系统受损伤程度逐渐加深,棉花根、叶细胞膜结构遭到破坏,细胞内可溶物外渗,相对电导率逐渐增大;AMF接种能有效促使棉花根和叶的相对电导率降低,可溶性糖等渗透调节物质含量得到提升,进而证明AMF接种可有效缓解As对棉花细胞的损伤,诱导根、叶中渗透调节物质的积累,维持其细胞内正常的渗透压调节、水分运输等生理代谢活动。除渗透调节系统外,本研究中As胁迫下棉花根、叶中的抗氧化酶活性也均受到不同程度的抑制,MDA含量显著升高,这是由于活性氧产生速率大于分解速率,破坏了活性氧代谢的稳态平衡。赵秀峰等[26]研究发现,小白菜(BrassicacampestrisL.)叶片和根系中抗氧化酶活性随As胁迫浓度增大而增大,但王春梅[27]的试验结果表明,As对不同基因型的谷子(OryzasativaL.)SOD等抗氧化酶均呈现出“低促高抑”的效应,As浓度高于谷子耐受阈值便会破坏其抗氧化系统,使其酶活性受到抑制,MDA含量升高。本研究中,棉花根和叶中抗氧化酶活性均随As胁迫加重而下降,应是‘大铃棉69号’棉花的耐As阈值较低。Garg等[28]的研究表明摩西球囊霉(Glomusmosseae)接种能够有效提高As胁迫下豌豆(PisumsativumLinn.)抗氧化酶活性,本试验也得到了相似的结果,AMF接种使棉花体内抗氧化酶活性升高,且MDA含量显著降低。说明AMF接种激活了棉花抗氧化机制,降低了As对棉花根、叶细胞膜脂过氧化损伤,增强了棉花对活性氧自由基的清除作用,有效缓解As毒害,最终提高了棉花逆境适应能力。
综上所述,As胁迫可对棉花生长、根系发育、渗透调节系统及抗氧化系统造成一定的损伤,AMF接种可有效地促进棉花生长,降低棉花体内As浓度并增强其根系固定能力,缓解As对棉花根系发育的抑制,减轻棉花根和叶遭受过氧化伤害程度,提升渗透调节系统及抗氧化系统的调节能力。两种丛枝菌根真菌根内根孢囊霉和摩西斗管囊霉对棉花耐As性均表现出良好且一致的促进作用,但由于不同菌种自身耐As性不同,摩西斗管囊霉表现出更强的接种促进效应。虽然丛枝菌根真菌接种降低了As对棉花的毒害作用,提高了棉花耐As性,但植物重金属耐受性是一个极其复杂的生理过程,不同品种植物的耐性不尽相同,本研究为丛枝菌根真菌接种缓解棉花As毒害机制提供了一定的理论支撑。

