一种非酒精性脂肪肝小鼠模型的建立方法
马浩鑫 朱桂达 张晓霞 杨若男 谢雨婷 刘小泽 王报贵

摘要 [目的]建立一種由高脂高糖膳食导致小鼠患非酒精性脂肪肝病的方法,具体症状为伴有严重血脂异常、肝功能受损和炎症反应。[方法]选用SPF级雄性C57BL/6J小鼠,7~8周龄,采用随机数字法分为正常组和模型组,每组20只,模型组灌胃高脂高糖肠内营养液,正常组灌胃PBS,试验期间自由摄食基础饲料和水。于第10、12、14、16周分别处死3只小鼠,检测是否达到NAFLD脂变程度;16周后,处死全部小鼠进行常规血脂4项和肝功能检测;观察肝脏的外观,测定肝脏中TG和TC含量;另取肝脏、脾脏和腹部脂肪分别进行HE染色;测定血清中IL-6和TNF-α水平。[结果]随着灌胃时间的增加,模型组肝脏系数、TG、TC含量均呈逐渐增加的趋势,正常组对应指标变化不明显;当灌胃时间达到12周时,模型组肝脏TC含量显著高于正常组;14周时,模型组中TG、TC含量与正常组相比均显著增加;通过HE染色发现,灌胃16周时模型组肝细胞排序混乱,肝细胞脂肪严重;血液中炎症因子和肝功能水平显著高于正常组,说明灌胃高脂高糖肠内营养液16周,模型组内肝脂变严重,肝细胞损伤并出现明显的炎性病变。[结论]该研究建立NAFLD小鼠模型操作简便,检测的指标稳定性好、可重复性高且更接近模拟人类该疾病的自然发病规律,为建立深入研究NAFLD发病机制、相关防治措施和治疗药物的筛选提供了可靠的动物模型。
关键词 非酒精性脂肪肝;脂质沉积;炎症因子;高脂高糖饮食
中图分类号 R-332 文献标识码 A
文章编号 0517-6611(2021)14-0080-05
Abstract [Objective] A method of nonalcoholic fatty liver disease in mice caused by a highfat,highsugar diet was established,specifically with severe dyslipidemia,impaired liver function,and an inflammatory response.[Method] SPF male C57BL/6J mice (78 weekold) were selected and divided into normal and model groups by random number method,with 20 mice in each group.Mice in model group was fed with high fat and high glucose enteral nutrition,mice in the normal group was fed with PBS.Mice were freely fed with the basal diet and water during this period.Three mice were killed at 10,12,14,and 16 weeks respectively to determine whether NAFLD lipid change was achieved. All mice were killed after 16 weeks for routine lipid 4 tests and liver function tests.The appearance of the liver was observed,and the contents of TG and TC in the liver were measured.Furthermore,liver,spleen,and abdominal fat were taken for HE staining.IL6 and TNFα levels in the serum were determined.[Result]The liver coefficient,TG and TC contents in the model group gradually increased with the increase of the gastric irrigation time,and the corresponding indices in the normal group did not change significantly.When the gastric irrigation time reached 12 weeks,TC content in the liver of the model group was significantly higher than that in normal group.At 14weekage,the contents of TG and TC in the model group were significantly increased compared with the normal group.The results of HE staining revealed that the liver cells in the model group were disordered and intrahepatic cells are severely fat.The levels of inflammatory factors and liver function in the blood were significantly higher than those in the normal group.These indicated that the intragastric highfat and highsugar enteral nutrition solution was administered for 16 weeks.The liver lipids in the model group became severe,and the hepatocytes were damaged with obvious inflammatory lesions. [Conclusion]The establishment of NAFLD mouse model was easy to operate,and the indicators tested were stable,highly reproducible,and closer to stimulate the natural occurrence of the disease in humans.The research results provided a reliable animal model for the indepth study of the pathogenesis of NAFLD,related prevention and treatment measures and the screening of therapeutic drugs.
Key words Nonalcoholic fatty liver;Lipid deposition;Inflammatory factors;Highsugar and highfat diet
基金项目 山东省创新训练项目(S202010449007);滨州学院博士科研启动费资助项目(2018Y18)。
作者简介 马浩鑫(2000—),女,山东滨州人,研究方向:食品质量与安全。*通信作者,讲师,从事食品(含生物质)资源开发与利用研究。
收稿日期 2020-11-23
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,以三酰甘油(又名甘油三酯,triglyceride,TG)在肝细胞沉积为主要特征,疾病谱包括非酒精性肝脂肪病变、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化和肝细胞癌[1-2]。近年来,随着高热量饮食(高糖高脂类)的过多摄入、久坐少动的工作方式、社交应酬增多和人均寿命的延长,致使肥胖和代谢综合征(metabolic syndrome,MetS)的流行,导致NAFLD已成为导致我国第一大慢性肝病和健康体检肝脏生物化学指标的首要原因。
横断面研究[3]显示,全球有西方膳食习惯的成人中,20%~30%的成人存在肝脏过量脂肪沉积,2%~5%的NAFLD患者存在明显的肝脏损伤,1%~2%的成人存在患NASH导致肝硬化的风险,目前已成为全球范围内的重大公共卫生问题。我国有学者调查了6 450名职业人群NAFLD的患病率,结果发现NAFLD的患病率为21.71%,男性为28.68%,女性为14.47%,表明NAFLD在我国广泛流行的严峻形势。与单纯的脂肪变性相比,炎症反应是NASH必需的病理特征[4]。NAFLD严重程度与IL-6的表达水平呈正相关,TNF-α促进巨噬细胞迁移至肝脏组织,增强肝脏局部炎性反应,最终导致NAFLD疾病的发生。NASH作为NAFLD较严重的进展阶段,发病常常伴随全身MetS,表现为严重的肝脏脂肪堆积、炎症反应和纤维化。临床研究[5]表明,NASH患者10年内肝硬化和肝癌发生率高达25%,预计NASH将成为未来10年肝移植的主要原因。
为深入研究NAFLD的发病机制,建立一个与人类病变相似的动物模型极为重要。然而,目前国内外的NAFLD动物模型缺少统一的标准,一定程度上限制了NAFLD病理机制及治疗药物的深入研究。
在多种造模方式中,高脂饮食诱导的NAFLD模型在发病机制上与人类最为相似,且多伴有肥胖、胰岛素抵抗等代谢综合征的表现[6]。目前国内外主要采用高脂饲喂Wistar或SD大鼠,或者胆碱-蛋氨酸缺乏饮食(MCD) C57BL/6J小鼠模型,其中C57BL/6J小鼠对高脂较为敏感[7-8]。前者炎症的产生和造模时间较长,后者可以较快复制模型,但模型中血清TG含量和肝功能水平下降,且由于缺少胆碱和蛋氨酸成分,不符合人类实际的饮食情况。现有MCD诱导的肝脂变模型中动物体重严重下降,试验期间体重下降约40%,该模型存在很大的缺陷[9-10]。人类生活中高脂饮食是导致非酒精性脂肪肝的主要因素,而使用的一些药物或者摄入的毒性物质也会损伤肝脏。目前对模型动物的选择、造模时间、高脂饲料的配比以及是否应用辅助药物干预等各不相同,但由于小鼠的自由摄食存在摄入量不可控问题,影响模型成功率的缺陷。基于生物大分子药物的开发和NAFLD发病率的增大,亟需建立解决上述模型问题的动物模型。该研究在小鼠饲养过程中灌胃肠内营养液,模拟人群高脂高糖不良饮食习慣的生活方式,诱导与人类NAFLD的发生、发展接近的小鼠模型。通过基础饲料联合高脂肠内营养剂灌胃诱导,建立C57BL/6J小鼠NAFLD模型,旨在为该疾病模型的建立及疾病相关研究提供参考和借鉴。
1 材料与方法
1.1 试验材料
SPF级雄性C57BL/6J小鼠,40只,7~8周龄,体重(20±2)g,购自济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)20140007;试验鼠标准饲料购自济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)20180003;白细胞介素6(IL-6)、肿瘤坏死因子(TNF-α)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)ELISA试剂盒,均购自南京建成生物工程研究所;TG和TC试剂盒,购自日本协和医药诊断株式会社。蔗糖、猪油和鸡蛋均购自滨州全福元超市;胆固醇购自江苏源盛通生物工程有限公司;胆酸钠购自上海远慕生物科技有限公司;丙硫氧嘧啶购自德国赫尔布兰德制药厂。
1.2 主要仪器与设备
显微镜,由日本欧林巴斯光学株式会社生产;SW-CJ-2D型双人单面净化工作台,由苏州净化设备有限公司生产;DNM-9602型酶标分析仪由北京普朗新技术有限公司生产;高温蒸汽压力灭菌锅由上海博讯医疗生物仪器股份有限公司生产。
1.3 试验方法
1.3.1 动物分组及造模方法。
试验小鼠适应性喂养1周后,将试验小鼠按照随机数字的方法分为正常组和模型组,每组20只。正常组灌胃PBS,模型组灌胃肠内营养液(配方为10%蔗糖、10%猪油、3%鸡蛋黄、2%胆固醇、1%胆酸钠、0.5%丙硫氧嘧啶)。为减少灌胃对小鼠造成的应激反应,第1周按0.01 mL/g的剂量进行灌胃,第2周灌胃剂量增加至0.02 mL/g,第3周恢复至正常灌胃剂量0.03 mL/g,持续灌胃16周,每天2次。于第10、12、14、16周分别处死3只小鼠,检测是否达到NAFLD脂变程度。试验期间所有小鼠均自由采食和饮水。
1.3.2 造模成功标准。
在显微镜下观察,肝组织脂肪变性程度30%以上的肝细胞脂肪变性者视为脂肪肝,75%以上的肝细胞脂肪变性者视为重度脂肪肝。判断标准参考中华肝病学会脂肪肝和酒精性肝病学组制订的《非酒精性脂肪性肝病诊疗指南》(2018年修订版)。
1.3.3 标品收集。造模开始后,每周称量体重。血液样本采集:动物禁食、不禁水12 h后,进行眼球取血后颈椎脱臼法处死小鼠。分离到的血清采用生化分析仪进行肝功能指标和血脂的检测,处死小鼠后称重肝脏、脾脏和腹部脂肪,并用4%多聚甲醛固定,由武汉芭菲尔生物技术服务有限公司进行病理学分析。
1.3.4 脏器系数。
完整取出肝脏和脾脏,用生理盐水洗净,用滤纸擦干后称重,按以下公式计算肝脏系数和脾脏系数:肝脏系数(或脾脏系数)=肝湿重(或脾湿重)/末次体重×100%。
1.3.5 血清学指标检测。试验末期,小鼠禁食、不禁水12 h,用1%的戊巴比妥酸钠腹腔注射麻醉,仰卧于动物试验台上,固定四肢并脱毛后暴露胸腹部,采用摘眼球方法采血。将采集的血液于4 ℃下静置2 h后,3 000 r/min,离心15 min,吸取血清分装在1.5 mL离心管内,取部分血清使用全自动生化分析仪检测甘油三酯(TG)、总胆固醇(TC)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、高密度脂蛋白(HDL-c)和低密度脂蛋白(LDL-c)的含量。
1.3.6 免疫因子检测。
血清样本中肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的含量采用ELISA方法测定。
1.3.7 肝脏脂质测定。
取肝脏左叶1 g,按1∶9匀浆介质(生理盐水)中,用电动匀浆机4 ℃下制成10%匀浆,离心取上清液,采用二辛可宁酸法(BCA)检测肝脏蛋白质浓度。另外,称取一块100 mg的肝组织,置于900 μL的匀浆介质氯仿/甲醇(体积比=2∶1)中,然后冰浴条件下进行电动匀浆,制成10%的组织匀浆;置于4 ℃下过夜,3 000 r/min离心15 min,取有机溶剂层,参考试剂盒说明书检测TG、TC含量;最后,根据肝脏蛋白浓度,计算肝脂水平。
1.3.8 数据处理。试验数据均使用SPSS 19.0软件进行统计分析,两组间采用 t检验进行差异显著性分析。P<0.05表示差异显著,P <0.01表示 差异极显著。
2 结果与分析
2.1 灌胃高脂高糖肠内营养液对小鼠体重和脏器系数的影响 从图1A可以看出,正常组和模型组小鼠体重在试验期间小鼠体重均无统计学差异,但随着时间的变化,模型组小鼠体重从第2周开始大于正常组。从图1B可以看出,模型组小鼠肝脏系数大于正常组( P <0.05),说明模型组肝脏重量显著增加;模型组脾脏系数大于正常组,但两组间不存在显著差异,说明肠内营养液灌胃可使肝脏重量显著增加,但不会引起脾脏重量的显著增加。
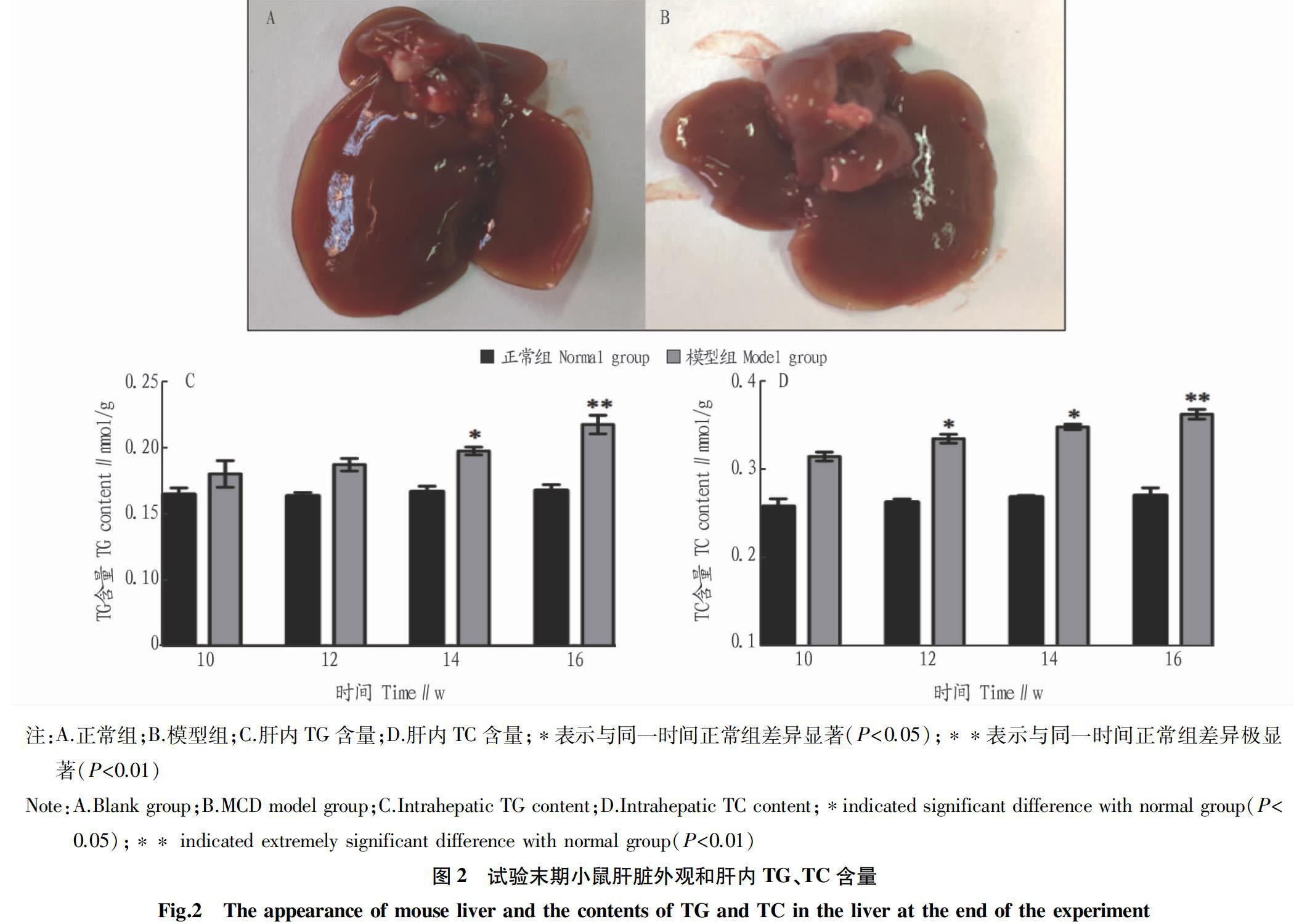
2.2 模型小鼠肝脏外观和TG、TC含量 从外观来看,正常组肝表面颜色普遍暗红,色泽鲜亮,边缘锐利,无油腻感;模型组肝脏颜色发黄,肝脏体积增大,包膜紧张,切面有油腻感(图2A、B)。从图2C、D可以看出,随着灌胃时间的增加,模型组TG、TC含量均呈现逐渐增加的趋势,正常组TG、TC含量随着灌胃时间的延长变化不明显;灌胃12周时模型组肝脏TC含量显著高于正常组 (P <0.05),TG含量的增加不显著;当灌胃至14周时模型组TG、TC含量与正常组相比均显著增加( P <0.05);灌胃至16周时,模型组TG、TC含量与正常组相比均显著增加( P <0.01)。这表明灌胃16周时模型组小鼠肝脏内有大量的脂质沉淀。
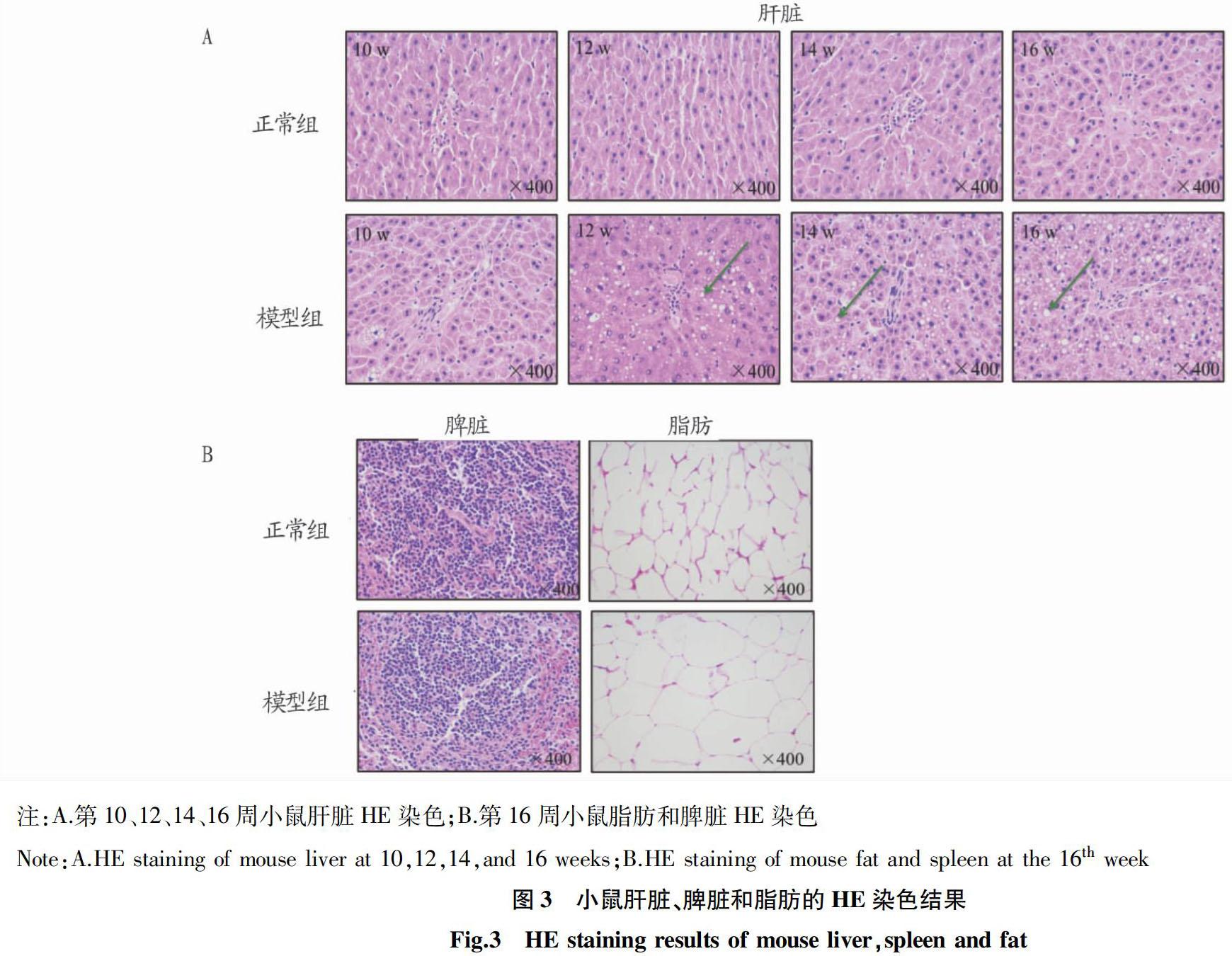
2.3 模型小鼠HE染色 从图3A可以看出,正常组小鼠肝细胞在不同时间的肝组织中结构完整清晰、肝小叶结构正常,肝细胞排列成肝索,在中央静脉周围呈放射性分布,细胞中央有大而圆的核,细胞质均匀,无脂滴;模型组小鼠肝脏随着时间的延长脂肪变性明显,肝细胞肿大变圆,细胞质疏且内含大的脂肪滴(图3A箭头所示),肝细胞排序混乱,肝细胞脂肪严重。从图3B可以看出,与正常组相比,模型组小鼠的脾脏细胞核均被不同程度破坏,且排列不规整,有一定程度的炎症;脂肪细胞HE染色发现,模型组脂肪细胞的体积较正常组明显增大。
2.4 模型小鼠体内炎症水平 从表1可以看出,模型组小鼠血清TNF-α含量显著高于正常组,说明模型组小鼠肝脏发生炎症反应;模型组小鼠血清内IL-6含量比正常组高3.48倍 (P <0.05),说明高糖高脂膳食可引起血清中炎症因子分泌增多,使小鼠体内发生炎性病变。
2.5 模型小鼠血脂和肝功能水平 从表2可以看出,与正常组相比,模型组TC、TG含量显著增加( P <0.01),HDL-c含量有一定程度的降低,但差异不显著,而LDL-c含量显著增加( P <0.05);模型组血清中AST、ALT含量显著高于正常组( P <0.05),说明模型组小鼠血脂含量升高并且肝脏功能受到一定程度的损伤,出现明显的炎性病变。
3 结论与讨论
NAFLD的发病机制尚未明确,而该疾病由于TG在肝脏内的大量沉积引起一系列代谢应激相关性肝病,给人类的健康带来很大威胁,因此建立与人类自然发病规律相近的动物模型迫在眉睫。现有的采用高脂摄食喂养SD大鼠或胆碱-蛋氨酸缺乏(MCD)喂养C57BL/6J构建NAFLD模型[11]。前者造模时间过长,造成试验资源的浪费;后者因为采用MCD饲料,不符合正常饮食情况,虽然造模时间较快,但模型小鼠血清中TG和肝脂水平下降不符合病变情况[12]。刘锋等[13]使用联合化学药物(四氯化碳)的方法,虽然提高了造模的成功率,但偏离了正常饮食。理想的动物模型构建方法应具有模型重复性好、试验中动物死亡率低、试验方法简便、构建的疾病随时间有发展过程等特点,才能使构建出的模型与人类自然發病规律相接近。
该试验采用高脂高糖肠内营养液灌胃C57BL/6J雄性小鼠16周,结果发现模型组小鼠体重上升,血脂、肝脂水平升高,血清中AST、ALT含量显著提高,表明造模16周小鼠肝脏出现明显脂肪积累、肝损伤和炎症,是明显的NAFLD特征。肝脏、脾脏和脂肪组织的病理学检测表明,试验末期小鼠肝细胞出现脂质空泡(超过30%),形成典型的NAFLD病变,结合肝功能受损检测结果,可判断出肝细胞已出现明显的炎症坏死现象。该试验在自由摄食普通饲养喂养的基础上灌胃高糖高脂的肠内营养液以及一定量的胆酸钠和丙硫氧嘧啶诱导动物肝组织脂肪变、血脂异常和炎症反应的肝脏脂肪病变动物模型,该方法建立的肝脂变模型稳定性好,能形成中重度肝脂变特征,为更好地研发NAFLD以及新药开发,特别是大分子药物的开发提供了可靠的模型保证。
参考文献
[1] MICHELOTTI G A,MACHADO M V,DIEHL A M.NAFLD,NASH and liver cancer[J].Nature reviews gastroenterology & hepatology,2013,10(11):656-665.
[2] YOUNOSSI Z,ANSTEE Q M,MARIETTI M,et al.Global burden of NAFLD and NASH:Trends,predictions,risk factors and prevention[J].Nature reviews gastroenterology & hepatology,2018,15(1):11-20.
[3] GOH G B B,MCCULLOUGH A J.Natural history of nonalcoholic fatty liver disease[J].Digestive diseases & sciences,2016,61(5):1226-1233.
[4] ESMAILZADEH S,HUANG Y,SU M W,et al.BIN1 tumor suppressor regulates Fas/Fas ligandmediated apoptosis through cFLIP in cutaneous Tcell lymphoma[J].Leukemia,2015,29(6):1402-1413.
[5] MITTAL S,ELSERAG H B,SADA Y H,et al.Hepatocellular carcinoma in the absence of cirrhosis in United States veterans is associated with nonalcoholic fatty liver disease[J].Clin gastroenterol hepatol,2016,14(1):124-131.
[6] CASTRO R E,DIEHL A M.Towards a definite mouse model of NAFLD[J].Journal of hepatology,2018,69(2):272-274.
[7] OWADA Y,TAMURA T,TANOI T,et al.Novel nonalcoholic steatohepatitis model with histopathological and insulinresistant features[J].Pathology international,2018,68(1):12-22.
[8] The institute of model animals of Wuhan University,China[J].European heart journal,2016,37(43):3257-3259.
[9] 邹堂斌,黄明元,冼叶明,等.虾青素抑制MCD饮食诱导的小鼠非酒精性脂肪肝纤维化[J].现代预防医学,2016,43(4):700-703.
[10] LUO Z L,TANG L J,WANG T,et al.Effects of treatment with hydrogen sulfide on methioninecholine deficient dietinduced nonalcoholic steatohepatitis in rats[J].Journal of gastroenterology and hepatology,2014,29(1):215-222.
[11] 李曉冲,徐尚,张秀英,等.C57BL/6J小鼠非酒精性脂肪肝模型的建立[C]//国毒理学会兽医毒理学与饲料毒理学学术讨论会暨兽医毒理专业委员会第4次全国代表大会会议论文集.北京:中国毒理学会,2012:100-101.
[12] 吴婷.非酒精性脂肪性肝病合并病毒性肝炎小鼠模型的建立及其免疫学损伤机制的研究[D].武汉:华中科技大学,2014.
[13] 刘锋,向志钢,许继凡,等.高脂饲料结合CCl4诱导小鼠非酒精性脂肪肝模型的建立[J].江苏医药,2010,36(1):69-71,125.

