绞股蓝皂苷内生真菌菌株的筛选及培养基优化试验研究*
尚 菲,汪 慧,王春林,宋 曦,段春燕
(1.甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃 庆阳 745000;2.陇东学院 生命科学与技术学院 甘肃 庆阳 745000;3.陇东学院 农林科技学院,甘肃 庆阳 745000)
植物内生真菌(Endophytic fungi)是和植物共同生长、互惠互利、协同作用的一类真菌[1]。内生真菌能够产生相似或相同于植物的新型天然活性物质,此活性物质能够发挥其抗菌、抗病毒、抗癌、抗氧化等多种生物的活性作用[2]。绞股蓝(Gynostemma pentaphyllum)为葫芦科多年生蔓生草本植物,为我国的传统中药,其有效的成分绞股蓝皂苷内含多种重要生物学作用[3]。近年来生态环境破坏导致药材资源减少,研究绞股蓝内生真菌资源及其代谢产物,可为寻找绞股蓝皂苷资源等紧缺、新型的具有活性的天然产物奠定基础[4]。
国内外诸多学者对绞股蓝内生真菌进行了研究。马生龙[5]用HPLC 法检测皂苷A 含量,探讨了不同产地、类型的绞股蓝内生真菌的多样性和其有效成分绞股蓝皂苷A 的关系。孟素香[6]利用实验方法研究绞股蓝内生真菌(JY25)对金黄色葡萄球菌的抗菌机制。范文慧[7]以金黄色葡萄球菌和大肠杆菌为标准指示菌对绞股蓝内生真菌(JY25)的发酵培养基进行优化分析。李传民[8]以胞外多糖量产作为指标,用单因素分析及正交试验对接种量、培养时间、碳氮源进行分析优化,以期达到胞外多糖高产的效果。现有文献大多是对内生真菌抗菌性、多样性等研究,而对于绞股蓝内生真菌发酵条件优化的研究较少。文章拟采用微生物学常规分离方法从绞股蓝的根组织中分离内生真菌,再采用TLC 法和HPLC 法筛选出与宿主植物产生相似或相同活性成分的绞股蓝皂苷菌株。再通过单因素分析和正交试验的方法,优化绞股蓝菌株的培养基及培养基础条件,以期实现绞股蓝皂苷的代谢产量,为保护药用植物资源等提供实验依据。
1 材料
1.1 样品
绞股蓝全草(栽培七叶),于2017 年4 月采集于陕西师范大学(长安校区)绞股蓝栽培基地,样品经陕西师范大学生科院鉴定均为葫芦科绞股蓝属植物绞股蓝 Gynostemma pentaphyllum (Thunb)Makino。
1.2 主要试验用培养基
PDA培养基:200g新鲜马铃薯,去皮煮沸30min后过滤收集滤液,20g 葡萄糖,1.5%琼脂,加水至1000mL,自然pH,121℃灭菌30min。
豆芽汁液体培养基:黄豆芽100g,葡萄糖50g,水1000 mL,pH 自然。称鲜豆芽100g 煮沸约30min,用纱布过滤,加入葡萄糖溶化后补足水至1000 mL。
查氏液体培养基:NaNO32g,K2HPO41g,KCl 0.5g,MgSO40.5g,FeSO40.01g,蔗糖30g,水1000mL,pH 自然。
玉米粉液体培养基:玉米粉60g,KH2PO43g,维生素B1 100mg,蔗糖10g,MgSO4·7H2O1.5g,水1000mL。
1.3 主要试剂
链霉素(Amresco,批号:LOT2010/07);青霉素钠(哈药集团制药厂,批号:A061115207.80 万单位∕瓶);二苯基苦基苯肼(DPPH 购于Sigma 公司);绞股蓝皂苷标品(辽宁生物医药研究中心121311-200402);PCR 相关试剂(北京经科宏达生物技术有限公司,DOUPSON)。
2 方法
2.1 产绞股蓝皂苷内生真菌的筛选及鉴定
2.1.1 TLC 初筛
将0.4% CMC-Na 溶液置于硅胶薄层板(GF254),活化后再冷却待用。采用氯仿-甲醇-水(13∶7∶2)在10℃以下放置一段时间后,用其下层溶液为展开剂,点样层析,待取出进行晾干后喷洒硫酸乙醇(10%),105℃高温进行加热(10-30 min),直至出现清晰的斑点,然后放置在紫外光灯下检视(365nm)。
2.1.2 HPLC 复筛
将TLC 呈阳性的样品用无菌滤膜过滤,HPLC进行检测,利用绞股蓝皂苷标准品甲醇溶液(2mg/mL)阳性对比,色谱条件为Diamomsil C18(2)色谱柱(4.6 mm×250mm,5μm);流动相条件为乙腈-水(7:3);流速为0.85 mL/min;柱温为30℃;检测波长为203 nm;进样体积为10μL。
2.1.3 产绞股蓝皂苷内生真菌菌株的鉴定
对产绞股蓝内生真菌菌株的基因进行提取,用琼脂糖凝胶电泳进行检测,1%琼脂糖凝胶进行电泳(加入1μL EB),用凝胶成像系统紫外灯下观察凝胶。用通用引物ITS1 和ITS4 进行扩增,扩增的条件为94℃预变性3min、变性1.5min,56℃复性30s,72℃延伸1.5min,共30 个循环,最后72℃延伸10min。对PCR 的产物测序,利用BLAST 软件进行对比测序得到的真菌部分(rDNA 序列)与Gen-Bank 库中已有的序列,从而获得真菌的分类地位[18]。
2.2 产绞股蓝内生真菌菌株发酵条件的优化
采用精密仪器吸取0.2mL 的待测液体放置于具塞试管(对照为100%甲醇),用80℃的高温蒸干,再加入0.2mL 的香草醛-冰醋酸(5%),0.8mL 的高氯酸,密塞后,用60℃热水浴约15min,待冷却以后加入5.0mL 的冰醋酸,最后进行测定标准品和样品的吸光度(于550nm 处)。用10%的接种量接种到产绞股蓝内生真菌菌株种子液装入液量为100 mL/250mL 的PDA、查氏、豆芽、玉米粉的液体培养基里,用28℃恒温振荡进行培养[19]。每天采样一次,并对菌株的菌丝体干重进行测定,发酵液按标准流程处理,然后用对紫外分光光度法对提取物中的绞股蓝皂苷的含量进行测定,明确发酵培养时间的终点。依据试验中筛选的最佳氮源、碳源。为进一步优化发酵条件,对氮源浓度、碳源浓度、温度和pH 等四个因素进行正交试验,见表1。
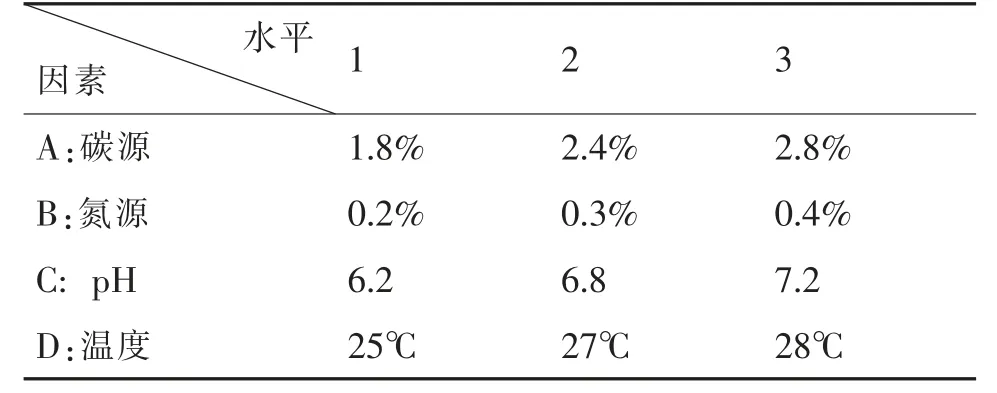
表1 正交实验设计方案
3 结果
3.1 TLC 初筛结果
分别用紫外灯和日光灯对样品和标准品进行TLC 检视对比分析,结果表明G4 菌株的胞内产物和标准品Rf 值相同的斑点(绞股蓝),表明G4 菌株可能会产生绞股蓝皂苷内生真菌,检视结果如图1所示,a 和b分别为绞股蓝皂苷标准品和G4 菌株的发酵菌丝体提取成分。

图1 TLC 法检测G4 菌株的菌丝体提取成分
3.2 HPLC 复筛结果
采用HPLC 方法分别对绞股蓝皂苷标准品与菌株G4 胞内产物进行检测,检测结果如图2 所示。结果显示G4 菌株的胞内产物,在相同的色谱条件下与标准品在约18min 时出现了相同吸收峰,从而进一步印证G4 菌株的胞内产物中会含有与宿主相似或相同的活性成分(绞股蓝皂苷)。

图2 绞股蓝皂苷标准品与G4 菌株胞内产物的HPLC 图谱
3.3 产绞股蓝皂苷内生真菌菌株的鉴定
产绞股蓝皂苷的G4 菌株菌落及显微照片如图3 所示,G4 菌株嵌入PDA 培养基上生长,培养基的颜色逐渐变黄,生长较缓慢,图3-A 为菌落真面,3-B 菌落反面,生长时间为10d。菌落正面为白色,反面为黄色,表面呈凸起,菌落较干燥,边缘为不规整分布。G4 菌株的孢子基本为圆形或椭圆,呈串珠状,菌丝较细,如图3-C 和3-D 为G4 菌株孢子及菌丝的显微观察示意图。

图3 G4 菌株的形态学观察
4 产绞股蓝内生真菌菌株发酵的优化
4.1 不同培养基的选择
G4 菌株在不同的培养基当中表现的情况不同。图4 为G4 在不同培养基中的绞股蓝皂苷含量曲线,绞股蓝皂苷含量最多是在豆芽汁培养基中,达到0.06433±0.001796μg/mL,PDA 液体培养基次之,达 到0.03844±0.000454ug/mL,玉米 粉 培 养 基 为0.02682±0.000568μg/mL,查氏培养基为0.01355±0.000781μg/100mL,表明各培养基之间对于菌株G4的皂苷相对量有明显的差异性,说明培养基的不同成分对绞股蓝皂苷的相对含量影响较大。图5 表明菌丝干重最大为豆芽汁培养基中,达到0.79880±0.01439g/100mL,豆芽汁培养基中菌丝干重比查氏培养基大约0.6 g/100mL,约为其4 倍。充分说明不同的培养基中不同的营养成分对菌丝的生长影响差异性巨大。综上所述,G4 菌株的培养基选择豆芽汁培养基为最佳,利于后续培养条件的研究。

图4 不同培养基中的绞股蓝皂苷含量曲线

图5 不同培养基中的菌丝干重曲线
4.2 发酵条件的单因素选择
4.2.1 碳源选择
图6 为G4 菌株在不同碳源条件下绞股蓝皂苷含量和菌丝干重的曲线变化。F 检验结果显示,不同碳源条件下二者含量变化具有明显的差异性(F=414.622>F0.05,P<0.05)。结果表明五种碳源条件下的菌丝干重均比空白对照的高,且葡萄糖碳源的菌丝干重最大,蔗糖次之。结果表明五种碳源条件下的绞股蓝皂苷含量均比空白对照的高,且葡萄糖碳源的绞股蓝皂苷含量最大,蔗糖次之。综述所述,G4 菌株在不同碳源条件下的能力表现出一定差异性,葡萄糖与其它的碳源相比,既有利菌丝体的生长,又有利绞股蓝皂苷含量的积累,最佳碳源为葡萄糖。

图6 不同碳源中的菌丝干重和绞股蓝皂苷含量变化曲线
4.2.2 氮源选择
图7 为G4 菌株在不同氮源条件下不同氮源中的菌丝干重和绞股蓝皂苷含量变化曲线示意图。F检验结果显示,不同氮源的培养基上G4 菌株的菌丝干重和绞股蓝皂苷含量具有显著的差异性(F=414.622>F0.05,P<0.05)。菌丝干重曲线结果表明,当氮源为硝酸铵时,菌丝干重为最大值,为0.7455±0.01384g/100mL;当氮源为硝酸钠时,菌丝干重为第二大值,为0.5355±0.01433g/100mL;当氮源为蛋白胨、酵母膏和尿素时,分别为0.4288±0.01645g/100mL、0.4605 ±0.00983g/100mL、0.4088 ±0.01101g/100mL;菌丝干重数值基本相等;空白对照组数值基本为0.3855±0.01243g/100mL;不同氮源均高于空白对照组。绞股蓝皂苷含量曲线结果表明,氮源为硝酸钠、蛋白胨和酵母膏时,绞股蓝皂苷含量基本相等。氮源为尿素和空白对照时,二者之间的绞股蓝皂苷含量也无显著差异。综上所述,G4 菌株在不同氮源条件下的能力表现出一定的差异性,硝酸铵与其它氮源对比,既有利于菌丝体的生长,又有利于绞股蓝皂苷含量的积累,最佳氮源为硝酸铵。

图7 不同氮源中的菌丝干重和绞股蓝皂苷含量变化曲线
4.3 发酵条件的正交优化
利用正交试验对产绞股蓝内生真菌的菌株培养条件进行优化,其结果与分析见表2。从表中可以得出,当培养基采用A3B1C3D2时,G4菌株发酵所得的菌丝干重值最大,为0.822 g/100m;从K1到极值R1,四个因素对发酵所得菌丝干重影响的排序依次为RA>RC>RD>RB,即碳源影响最大,温度影响次之,第三影响因素为pH,氮源时最小影响因素。在G4菌株的发酵培养基中,如若要获得大量的菌丝,则可对豆芽汁培养基进行调整,即硝酸铵0.2%,葡萄糖3.0%,温度28℃,pH7.0,即能节省时间,又能降低成本;若想获得大量的绞股蓝皂苷,则以豆芽汁培养基作为基础进行微调整,即硝酸铵0.3%,葡糖糖3.0%,温度28℃,pH7.0。通过对比初始配比的豆芽汁培养基和正交试验优化的最佳配比,采用这两种培养基分别对G4 菌株培养,结果表明,菌丝干重最大值为0.854 g/100mL,增加了5.13%;绞股蓝皂苷含量最大值为0.069μg/mL,增加了11.30%;同时发酵最大值从原来的8d 减低为6d,节约了发酵时间成本。

表2 正交试验结果与分析
5 结论
(1)采用TLC 法和HPLC 法成功筛选出G4 菌株为产绞股蓝皂苷内生真菌的菌株。TLC 结果表明G4 菌株的胞内产物与标准品有相同的Rf值;HPLC结果表明G4 菌株的胞内产物与标准品有相同的吸收峰(18min)。从而推断G4 菌株会产生与宿主相似或相同的活性成分。

续表2
(2)利用豆芽汁、PDA 液体、查氏、玉米粉培养基对产绞股蓝皂苷内生真菌菌株发酵条件的进行优化。结果表明,豆芽汁培养基为最佳培养基,既有利于菌丝体生长,又有利于绞股蓝皂苷积累。通过单因素分析,确定葡萄糖为最佳碳源,硝酸铵为最佳氮源。通过正交试验分析,菌丝生长和绞股蓝皂苷积累的最佳配比是将豆芽培养基的配比分别控制在硝酸铵0.2%或硝酸铵0.3%,葡萄糖3.0%,温度28℃,pH7.0;二者的配比仅仅硝酸铵浓度有区别,其他条件保持一致。

