高产酸本土非酿酒酵母菌株的筛选及发酵性能研究
董琦楠,叶冬青,梁艳英,姜 娇,刘延琳,3*
(1.西北农林科技大学 葡萄酒学院,陕西 杨凌 712100;2.广西壮族自治区农业科学院 果蔬贮藏与加工新技术重点实验室,广西 南宁 530007;3.西北农林科技大学 宁夏贺兰山东麓葡萄酒试验示范站,宁夏 永宁 750104)
近年来,我国西部葡萄酒产区葡萄原料糖分过高、酸度过低的现象愈发突出,因此,导致所酿造的葡萄酒口感风味不平衡[1],葡萄酒色泽变暗[2],易遭到微生物的污染[3]。如何提高葡萄酒酸度,突出葡萄酒典型性风格特征,已成为我国西部地区葡萄酒酿造急需解决的问题。目前较为普遍的增酸方法包括物理增酸、化学增酸及生物增酸三类[4-7]。化学方法主要通过添加酒石酸调节葡萄酒的酸度,但这可能会引起酒石酸沉淀[3],进而对葡萄酒产生复杂影响,而且添加量受到法律的严格限制[8]。物理方法增酸主要是采用离子交换法,其价格昂贵,且易引入大量其他离子[7]。生物增酸使葡萄酒稳定性高、口感柔和,成为理想的增酸方法。
随着近年来对非酿酒酵母(non-Saccharomyces)研究的不断深入,发现葡萄酒在发酵过程中可利用非酿酒酵母产生乳酸,使其口感柔和,性质稳定[9]。非酿酒酵母用于葡萄酒生物增酸具有极大潜力,逐渐成为近年来的研究热点[10-12]。有研究发现,耐热克鲁维酵母(Lachancea thermotolerans)及葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)能够提高葡萄酒的酸度、降低pH值,同时也能够增加葡萄酒的香气[13-16],其有较强的发酵能力,对酒精、SO2耐受性较高[17-18]。
本研究以25株本土非酿酒酵母(18株耐热克鲁维酵母、7株葡萄汁有孢汉逊酵母)为研究对象,将其在酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)10、Triple M改良模拟汁中进行发酵,测定产酸能力,筛选增酸菌株,并对所筛选菌株的乙醇、SO2、糖及pH耐受性进行研究,最后利用筛选菌株对葡萄汁进行发酵,进而筛选能够有效增加葡萄酒酸度的优良本土非酿酒酵母菌,以期为非酿酒酵母在发酵低酸葡萄汁中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株本研究所用实验菌株的类型及来源见表1。
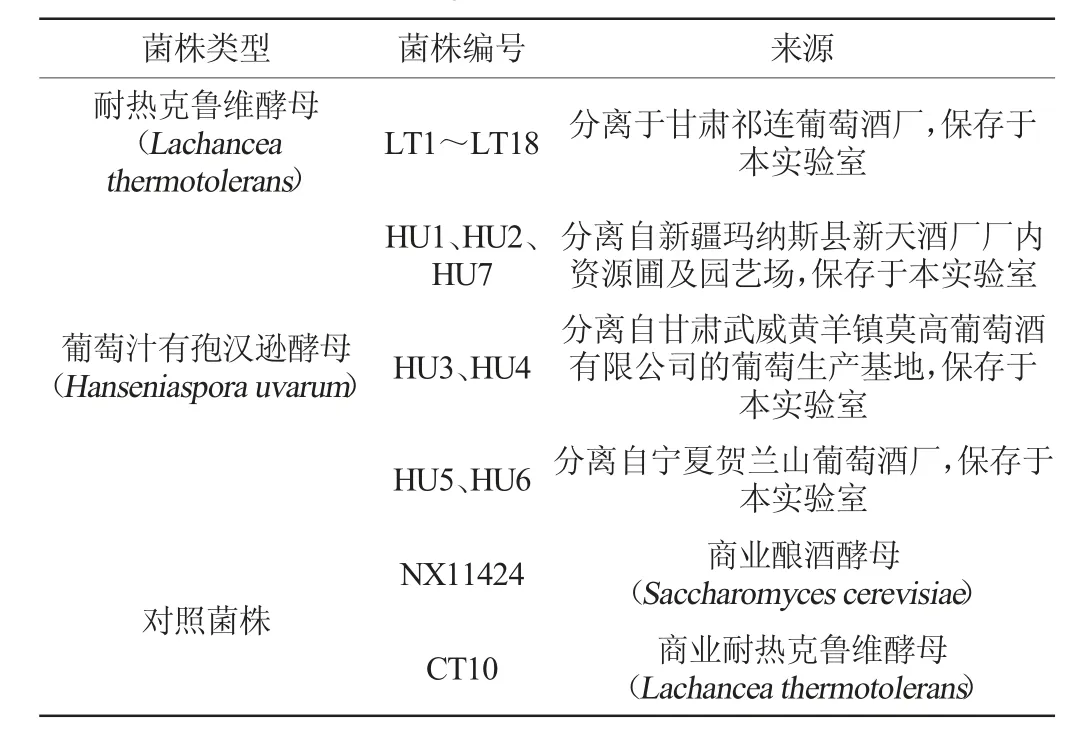
表1 本研究所用实验菌株类型及来源Table1 Types and origins of test strains used in the study
1.1.2 试剂
酒石酸、苹果酸、柠檬酸(均为分析纯):阿拉丁试剂(上海)有限公司;精氨酸、脯氨酸、色氨酸(纯度99.85%):北京索莱宝科技有限公司;L-乳酸试剂盒、D-乳酸试剂盒:爱尔兰Megazyme公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
YPD培养基[19]:葡萄糖10 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,自然pH,121 ℃高压蒸汽灭菌20 min。
YPD10液体培养基[20]:葡萄糖100 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,自然pH,121 ℃高压蒸汽灭菌20 min。
Triple M改良模拟汁[21]:将ergo stock(12.5 mL Tween80,37.5 mL体积分数95%乙醇,0.125 g麦角固醇)、溶液A(375 mL去离子水中加125 g葡萄糖,125 g果糖,4 mL ergo stock,溶解后加入去离子水补充到500 mL)、溶液B(250 mL去离子水中加6 g酒石酸,3 g苹果酸,0.5 g柠檬酸)、溶液C(250 mL去离子水中加入1.7 g无氨基酵母氮源(yeast nitrogen base without amino acids,YNB),2 g水解酪蛋白,6 mg肌醇,0.2 g无水氯化钙,0.8 gL-精氨酸,1 gL-脯氨酸,0.1 g色氨酸,1 g磷酸铵)混合后,用氢氧化钾调pH至3.25,过滤除菌,现配现用。
1.2 仪器与设备
UV-Vis Cary60紫外分光光度计:美国安捷伦公司;ZHWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;TG16-WS台式高速离心机:长沙湘仪离心机仪器有限公司;BK1301生物显微镜:重庆光电仪器有限公司;Agilent 1260 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;87H+液相色谱柱(300 mm×7.8 mm,9 μm):美国Bio Rad公司。
1.3 方法
1.3.1 本土非酿酒酵母菌株在YPD10培养基中的发酵实验
以商业耐热克鲁维酵母CT10及商业酿酒酵母NX11424为对照,取-20 ℃甘油保藏的菌液50 μL于含4 mL YPD培养基的试管中,在28 ℃、150 r/min条件下活化培养24 h。将活化好的菌株以105CFU/mL的接种量接种到20 mL YPD10液体培养基(初始pH值5.8)中,在28 ℃、150 r/min的条件下发酵60 h,取样。将样品以8 000 r/min离心2 min后取上清液,测定乳酸(L-乳酸及D-乳酸)含量及pH值,并计算pH降低值(ΔpH),以进行高产乳酸菌株的初步筛选。
1.3.2 本土非酿酒酵母菌株在Triple M改良模拟汁中的发酵实验
以商业耐热克鲁维酵母CT10为对照,将上一步筛选出的非酿酒酵母进行活化,将活化好的菌株以105CFU/mL的接种量接种到20 mL Triple M改良模拟汁(初始pH为3.25,还原糖含量为250 g/L,可滴定酸含量为8.97 g/L)中,在28 ℃,150 r/min的条件下进行发酵。每24 h称质量以测定其CO2质量损失,当连续3 d CO2质量损失均在0.1 g以下,则发酵结束。对发酵结束的样品进行取样,将样品以8 000 r/min离心2 min后取上清液,测定酒精度、残糖量、pH值、可滴定酸、挥发酸、乳酸及苹果酸含量。
1.3.3 菌株耐受性研究
以YPD培养基为基础培养基,分别添加不同体积分数的乙醇(3%、6%、9%、12%、15%)、不同质量浓度的SO2(以H2SO3形式添加)(60 mg/L、120 mg/L、180 mg/L、240 mg/L、300mg/L、360mg/L)、不同质量浓度的葡萄糖(200g/L、250g/L、300 g/L、350 g/L、400 g/L),调成不同的pH值(pH2.8、pH3.2、pH3.6、pH3.8),将处于对数生长期的所筛选菌株分别以105CFU/mL的接种量接种于不同培养基中进行耐受性试验,在28 ℃条件下静置培养24 h,在波长600 nm处测定吸光度值(OD600nm值),分别绘制菌株乙醇耐受性、SO2耐受性、糖耐受性、pH耐受性曲线。
1.3.4 菌株的葡萄汁发酵实验
将活化好的菌株以105CFU/mL的接种量接种到100 mL经除梗破碎低温浸渍24h后的葡萄汁(初始糖含量为280.45g/L,pH值为3.31,可滴定酸含量为5.08g/L,苹果酸含量为1.35 g/L)中,在28 ℃、150 r/min的条件下进行发酵。每天称质量以测定其CO2质量损失,当连续3 d CO2质量损失均在0.1 g以下,则发酵结束。对发酵结束的样品进行取样,以8 000 r/min离心2 min后取上清液,测定残糖量、pH值、酒精度、可滴定酸、乙酸、乳酸及苹果酸含量。
1.3.5 分析检测
酒精度、可滴定酸含量、pH和挥发酸含量的测定:参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》;残糖量的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[22];CO2质量损失的测定:称重法;根据CO2质量损失计算CO2质量损失速率,其计算公式:(后一天CO2质量损失-前一天CO2质量损失)×50/24;L-乳酸和D-乳酸含量的测定:采用试剂盒法及高效液相色谱法[23]。
1.3.6 数据处理
采用Excel 2019进行数据处理统计;采用SPSS 21.0对数据进行单因素方差分析,利用Duncan's多重比较在置信区间0.05下对数据进行差异显著性分析;采用Origin 2018软件作图。每个实验重复3次,结果用“平均值±标准差”表示。
2 结果与分析
2.1 YPD10液体培养基发酵实验
27株酵母菌在YPD10液体培养基发酵60 h时,发酵液中乳酸含量及ΔpH见表2。
由表2可知,各菌株在YPD10液体培养基中发酵60 h时,其发酵液中均能够检测到乳酸,且在大部分的酵母发酵液中,L-乳酸的生成量大于D-乳酸。其中本土非酿酒酵母菌HU3的乳酸产量最高(7.77 g/L),是商业耐热克鲁维酵母CT10(1.68 g/L)的3.63倍。对总乳酸量及ΔpH进行相关性分析,结果发现总乳酸量与ΔpH显著相关(P<0.05),且相关系数R2为0.894,说明乳酸的增加对pH的降低起到显著作用。最终,在所有菌株中,以总乳酸产量>3 g/L、ΔpH>1为筛选条件,筛选出9株耐热克鲁维酵母(LT1、LT6、LT8、LT10、LT11、LT13、LT15、LT17、LT18)、6株葡萄汁有孢汉逊酵母(HU1、HU2、HU3、HU4、HU6及HU7),共计15株菌。

表2 27株酵母菌株在YPD10液体培养基中发酵60 h时的乳酸产量及ΔpHTable2 Lactic acid content and ΔpH of 27 yeast strains after fermentation 60 h in YPD10 liquid medium
2.2 Triple M模拟葡萄汁发酵实验
15株本土非酿酒酵母及商业耐热克鲁维酵母CT10的Triple M模拟汁发酵液的理化指标检测结果见表3。
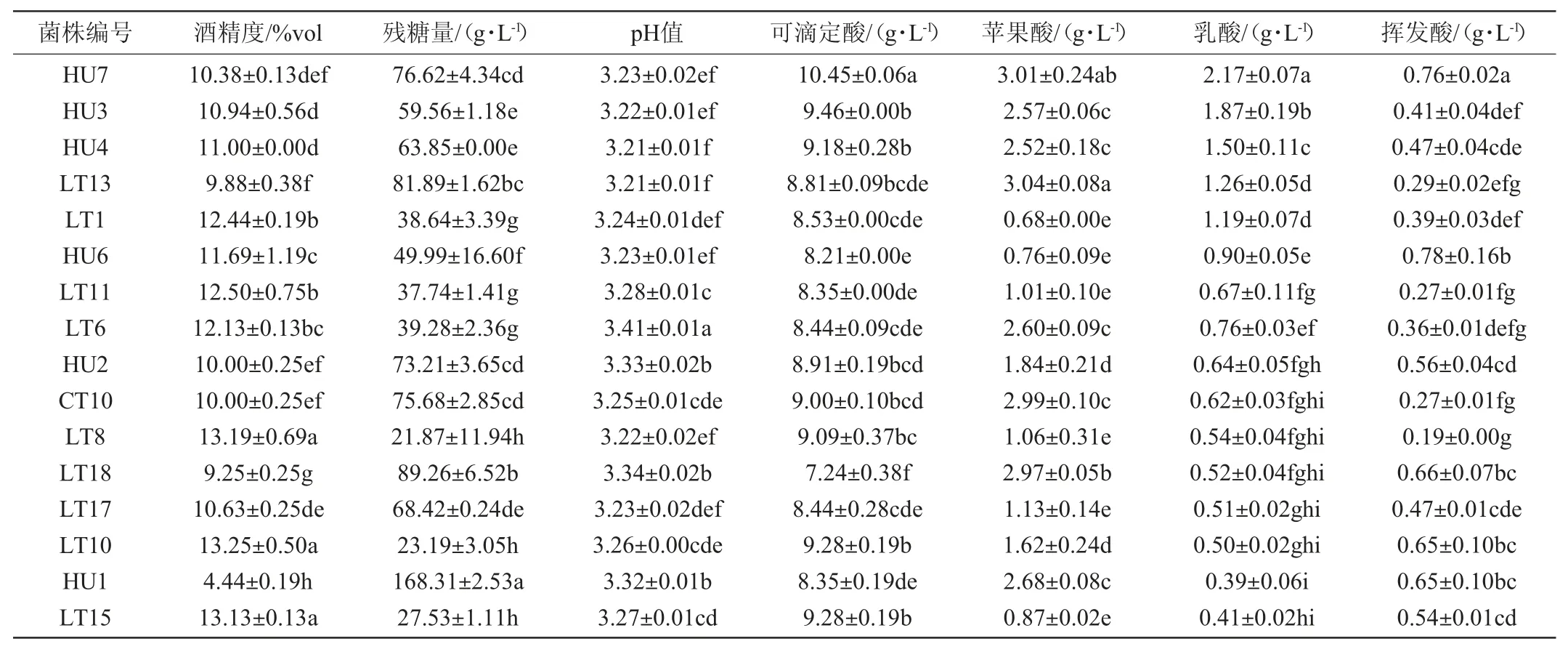
表3 Triple M模拟汁发酵液理化指标的检测结果Table3 Determination results of physical and chemical indexes of Triple M simulated juice fermentation broth
酵母菌在发酵过程中对糖的转化能力可以由发酵液中的残糖量反映,发酵结束后,若残糖量低,则表明酵母发酵彻底,对糖的利用能力高,发酵能力强[24]。由表3可知,15株本土非酿酒酵母的Triple M模拟汁发酵液中残糖量均>20 g/L,其中,菌株HU1的Triple M模拟汁发酵液中残糖量高达168 g/L,表明非酿酒酵母对糖的利用能力较弱,这也是实际生产中通常将酿酒酵母与非酿酒酵母混合发酵的一个重要原因[25]。
Triple M模拟汁中所测得的乳酸含量均为净生成量。各试验菌株的Triple M模拟汁发酵液中乳酸含量>1 g/L的菌株有5株,分别是菌株LT1、LT13、HU3、HU4以及HU7,其中菌株HU7生成的乳酸含量最高,达到2.17 g/L。同时,菌株LT13、HU3、HU4及HU7的Triple M模拟汁发酵液中的苹果酸含量均>2 g/L,说明这4株试验菌株降解苹果酸能力较弱,能够优先将糖转化为乳酸。而菌株LT1的Triple M模拟汁发酵液中苹果酸降解率达到77.33%,说明苹果酸降解也是其乳酸生成的重要原因。对比可滴定酸含量结果可知,在上述4株非酿酒酵母中,除了菌株LT13的Triple M模拟汁发酵液中的可滴定酸含量略有降低外,其他3株非酿酒酵母的Triple M模拟汁发酵液的可滴定酸均呈现上升趋势。所有酵母的Triple M模拟汁发酵液中的挥发酸含量均低于GB 15037—2006《葡萄酒》中所规定的要求。
综合分析,试验菌株HU7、LT1、LT13、HU3以及HU4的产乳酸能力较强,能在一定程度上降低发酵液中的pH,同时具有较好的发酵特性,对其进行耐受性试验测试。
2.3 菌株耐受性研究
2.3.1 乙醇耐受性
以商业耐热克鲁维酵母CT10为对照菌株,5株筛选菌株的乙醇耐受性见图1。

图1 筛选菌株对乙醇的耐受性Fig.1 Tolerance of screening strains to ethanol
由图1可知,5株非酿酒酵母的OD600nm值随着乙醇体积分数的升高而呈现下降趋势。当乙醇体积分数为3%时,5株酵母的OD600nm值均>1.0;当乙醇体积分数升至15%时,它们仍能生长。其中菌株HU7与HU4在体积分数为6%的乙醇条件下,OD600nm值开始有明显降低;随着乙醇体积分数的增加,OD600nm值缓慢降低到0.5以下,这表明过高体积分数的乙醇对菌株生长有明显的抑制作用。菌株LT13在乙醇体积分数升至12%时,OD600nm值才明显下降。菌株HU3的OD600nm值则随着乙醇体积分数的上升呈现持续下降,表明菌株HU3对于乙醇更加敏感。而菌株LT1的OD600nm值在乙醇体积分数为15%时才有明显的下降趋势,表明其对乙醇的耐受能力较强。总体而言,菌株LT1对乙醇的耐受能力最强,而菌株LT13的耐受能力与商业对照菌株CT10相似。
2.3.2 SO2耐受性
葡萄酒生产过程中,加入适量SO2能起到杀菌,抑制葡萄汁中有害微生物,抗氧化及护色等作用[24]。以商业耐热克鲁维酵母CT10为对照菌株,5株筛选菌株的SO2耐受性见图2。由图2可知,在未加入SO2的培养基中,各菌株的OD600nm值均>1.0,加入质量浓度为60 mg/L的SO2后,各菌株的OD600nm值迅速降低至1.0以下,但其在含质量浓度为60~360 mg/L的SO2的YPD培养基中均能生长,且与商业对照菌株CT10对SO2的耐受性相似。其中,菌株LT1的耐受性最好。这说明5株非酿酒酵母能够耐受正常葡萄酒生产过程中的SO2浓度(60 mg/L)。

图2 筛选菌株对SO2的耐受性Fig.2 Tolerance of screening strains to SO2
2.3.3 糖耐受性
在葡萄酒生产过程中,糖是酵母生活的能源物质,但是高浓度的糖会抑制酵母的生长,造成葡萄糖代谢阻遏,并且高渗透压会引起酵母细胞水分的流失,使其活性降低[26]。以商业耐热克鲁维酵母CT10为对照菌株,5株筛选菌株的糖耐受性见图3。由图3可知,5株非酿酒酵母的OD600nm值均随着葡萄糖质量浓度的升高而降低。当葡萄糖质量浓度为400 g/L时,菌株LT1、LT13及CT10的OD600nm值仍维持在1.0以上,这说明菌株对于糖环境的适应性较好,耐受性强。其中菌株LT1的糖耐受性最好,菌株LT13的糖耐受性与商业对照酵母CT10相似。

图3 筛选菌株对糖的耐受性Fig.3 Tolerance of screening strains to sugar
2.3.4 pH值耐受性
高酸可以抑制败坏酵母的生长,防止葡萄酒的污染,但过低的pH同样会影响酵母生长,通常葡萄酒发酵中的pH值在3.2左右[2]。以商业耐热克鲁维酵母CT10为对照菌株,5株筛选菌株的pH耐受性见图4。由图4可知,随着pH值的降低,菌株LT13、HU7、HU4及CT10的OD600nm值缓慢降低,表明其在pH为3.8的环境中生长最好。而菌株HU3和LT1在pH为3.6时OD600nm值达到最高(分别为1.81和1.18),表明其最适pH为3.6。与商业对照酵母CT10相比,菌株HU3和LT1对不同pH环境下的耐受性更好,其中HU3的pH耐受性最好。

图4 筛选菌株的pH耐受性Fig.4 Tolerance of screening strains to pH value
2.4 菌株发酵葡萄汁性能测定结果
以商业耐热克鲁维酵母CT10为对照菌株,5株筛选菌株发酵葡萄汁过程中,CO2质量损失速率见图5。由图5可知,6株试验菌株在葡萄汁的发酵中有一定的延滞期,这可能是由于葡萄汁中的环境因素较为复杂。其中菌株LT1在发酵时间为48 h进入发酵旺盛期;菌株LT13和菌株HU4在发酵时间为72 h进入发酵旺盛期;菌株HU7和菌株CT10在发酵时间为96 h进入发酵旺盛期;菌株HU3在144 h进入发酵旺盛期。其中菌株LT1及HU4的CO2质量损失速率最高,均>0.8 g/(L·h)。

图5 发酵过程中葡萄汁的CO2质量损失速率曲线Fig.5 CO2 weight loss rate curve of grape juice during fermentation
发酵结束后,各酒样的理化指标见表4。由表4可知,发酵后酒样中残糖量范围在55.27~89.55 g/L之间,均未能发酵完全。其酒精度均>11%vol,结合耐受性结果,大约12%vol的酒精度已经对菌株有较为明显的抑制作用,这可能是菌株未能将糖消耗完的一个重要原因。试验菌株HU3、HU4、HU7及LT1发酵葡萄汁酒样中乳酸的产量显著高于对照菌株CT10酒样,说明这4株酵母菌在葡萄汁中依然具有稳定的产乳酸能力,其中菌株HU7酒样的可滴定酸含量高于其他实验组,增酸效果较好。所有酵母菌发酵的酒样中挥发酸含量均低于GB 15037—2006《葡萄酒》中的要求。综上分析,菌株LT1及HU4在葡萄汁中产乳酸能力较好,能耐受较差的胁迫环境,有较强的发酵特性,具备酿造增酸葡萄酒的潜力。
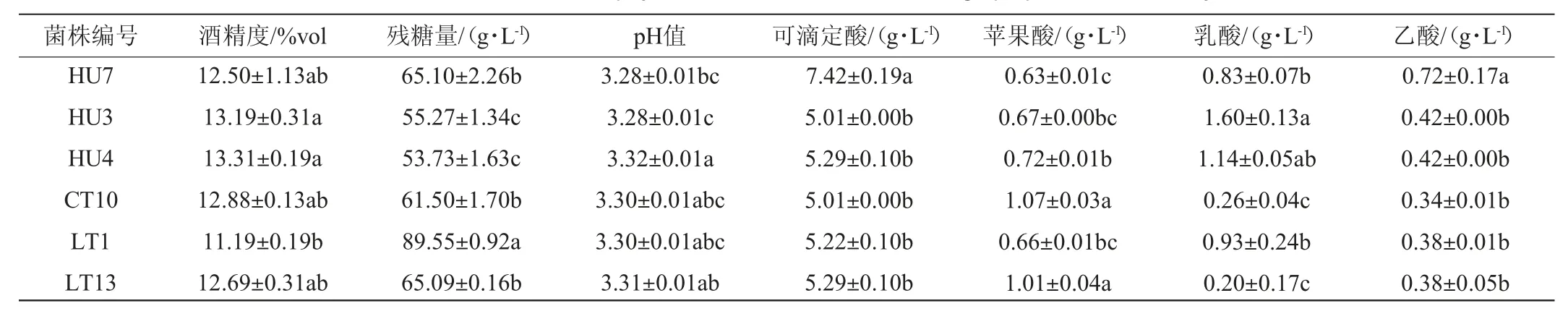
表4 菌株发酵葡萄汁样品理化指标的检测结果Table4 Determination results of physical and chemical indexes of grape juice fermented by strains
3 结论
本实验通过对25株本土非酿酒酵母在YPD10及模拟汁中发酵性能的研究,初步选出产酸量较高的菌株LT1、LT13、HU3、HU4以及HU7,对其进行耐受性测试及葡萄汁发酵实验。结果表明,非酿酒酵母LT1及HU4的产酸性能良好,对乙醇、SO2、糖和pH综合耐受性较好,其中菌株LT1能耐受体积分数12%的乙醇、400 g/L的糖及2.75的低pH胁迫,菌株HU4能耐受体积分数6%的乙醇、250 g/L的糖及2.75的低pH胁迫。菌株LT1和HU4在葡萄汁中启酵时间较短,发酵旺盛期CO2质量损失速率均>0.8 g/(L·h)。菌株LT1和HU4乳酸产量分别为0.93 g/L、1.14 g/L,乙酸产量分别为0.38 g/L、0.42 g/L,具备酿造增酸葡萄酒的潜力。

