长链非编码RNA MALAT1在肿瘤诊治中的研究进展
李悄 李国政 张博 王伟
1首都医科大学附属北京胸科医院,北京市结核病胸部肿瘤研究所耐药结核病研究北京市重点实验室细菌免疫室(北京101149);2安徽医科大学生命科学学院遗传学教研室(合肥230032);3安徽医科大学第二附属医院肿瘤科(合肥230601)
据国际肿瘤研究机构统计,随着人口老龄化、环境恶化等问题日益突出,2020年全球大约有1 930 万新发肿瘤病例和1 000 万死亡病例,肿瘤负担不断加重,如何有效预防和控制肿瘤是世界范围内的一个重要公共卫生问题[1]。研究发现能够编码蛋白质的转录本仅占人类基因组序列的不到2%,非编码RNA(non-coding RNA,ncRNA)占大多数,根据序列的长短,一般将大于200 nt 的ncRNA 命名为长链非编码RNA(long non-coding RNA,lncRNA),因其可参与调控基因表达以及与多种肿瘤的细胞增殖、凋亡、侵袭以及转移等密切相关,成为了近年来研究的热点[2-5]。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是最早发现的lncRNA之一,在多种肿瘤中表达异常,与肿瘤的发生、发展进程密切相关,并且在肿瘤的早期诊断、治疗及预后评估等领域也存在着潜在的应用价值[6]。本文即结合国内外关于MALAT1 的最新研究结果,对MALAT1 在肿瘤研究领域的进展做一综述,为临床及科研工作提供一定的参考。
1 MALAT1 的概述
MALAT1 定位于人类染色体11q13,长度约为8.5 kb,在肺、胰腺等健康器官和非小细胞肺癌(non-small-cell lung cancer,NSCLC)中均有高表达,于2003年由JI 等[7]在早期NSCLC 的研究中首次发现并命名,因其高度富集于核斑点-前体mRNA 储存及剪切的区域,又称为核富集转录本2(nuclearenriched abundant transcript 2,NEAT2)。MALAT1 3′端的腺苷酸聚集区和尿嘧啶聚集片段形成保守的三股螺旋结构,能够降低3′→5′外切酶活性,使其更加稳定地进行翻译[8]。
2 MALAT1 异常表达与肿瘤的发生
MALAT1 虽然先发现于NSCLC,但是近些年来的研究发现MALAT1 在许多肿瘤组织中均呈高表达,如MALAT1 在肝癌中表达上调,通过Wnt/β-连环素通路活化与丝氨酸/精氨酸富集剪接因子1(serine/arginine-rich splicing factor 1,SRSF1)诱发原癌基因的作用,促进肝癌细胞增殖[9];且MALAT1的表达与细胞运动相关基因的表达呈正相关,促进肺癌细胞侵袭与转移[10];而抑制结肠癌中MALAT1 的表达可以通过抑制Wnt/β-连环素信号通路来促进细胞凋亡等[11]。这些研究发现MALAT1作为“分子海绵”竞争结合一些内源性的microRNA并调节下游基因的表达水平,也可以通过MAPK/ERK、PI3K/AKT、Wnt/β-连环素和NF-κB 等多种信号通路调控细胞的增殖、侵袭、转移以及凋亡等过程,在肿瘤的发生发展中起到重要的作用[12-13]。此外,研究还发现MALAT1 3′端的6918-8441nt 片段发生突变时,其促进肿瘤细胞增殖、侵袭、转移的作用会丧失,表明该片段可能是MALAT1 的功能域[14]。同时,越来越多的数据表明,MALAT1 在肿瘤组织中的异常表达可以作为肿瘤诊断和预后的生物标志物以及治疗靶点,具有较好的应用前景。
3 MALAT1 与肿瘤的诊断
早期检测对于肿瘤的治疗至关重要,尽管目前有各种肿瘤诊断方式如实验室检查、影像学检查、病理学检查等,却不能完全满足早期诊断的需求,而近来研究表明MALAT1 有作为诊断性生物标志物的潜力。
研究发现MALAT1 在血清外泌体中可以作为非侵入性生物标记物用于NSCLC 的诊断[15],且外周血中的MALAT1 符合诊断标志物的重要特性如微创、高特异性和稳定性。但是MALAT1 作为单一的生物标记物,灵敏度较低,可能无法用于诊断血液细胞部分中的NSCLC;于是将MALAT1 与RMRP、NEAT1、TUG1 联合使用,能够提高诊断效率,成为早期NSCLC 诊断的便捷工具[16],诊断ROC 曲线下的面积(AUC)见表1。此外,MALAT1还用于如乳腺癌[17]、膀胱癌[18]、鼻咽癌[19]以及上皮性卵巢癌[20]等其他肿瘤的诊断。
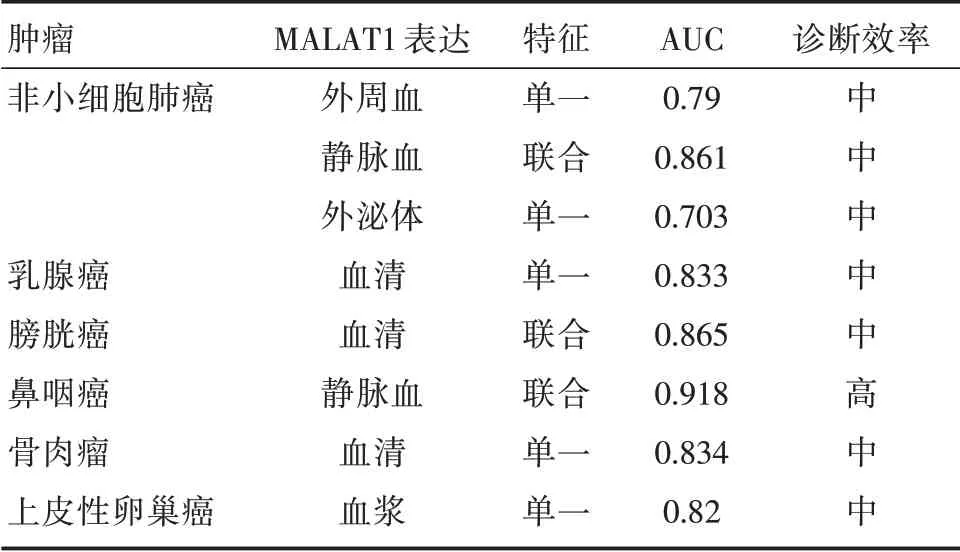
表1 MALAT1 在肿瘤中的诊断应用Tab.1 Diagnostic application of MALAT1 in tumor
这些结果表明,MALAT1 对多种肿瘤具有较高的特异性和灵敏度,单独使用或与其他诊断指标联用可以作为诊断肿瘤的有效生物标志物。
4 MALAT1 与肿瘤的治疗
目前临床上的肿瘤治疗方法有很多,包括手术切除、放疗、化疗、介入治疗以及靶向药物治疗等等,各有优缺点,而靶向肿瘤细胞的方法学进展也为MALAT1提供了作为肿瘤治疗靶标的机会[21]。
在骨肉瘤中,体外敲低MALAT1 能够抑制肿瘤细胞增殖和迁移,并导致细胞周期停滞和凋亡,异种移植模型也验证了沉默MALAT1 可以抑制肿瘤生长,表明MALAT1 在骨肉瘤中起着致癌作用,可能是治疗骨肉瘤患者的潜在靶标[22]。利用锌指核酸酶(ZFN)技术将人肺癌细胞中的MALAT1敲低1 000 倍,结果细胞的迁移能力受损,且在异种移植小鼠模型中形成的肿瘤结节更少,提示MALAT1 作为肺癌转移标记可能是治疗转移性肺癌的潜在策略[23]。MALAT1 在转移性管腔B 型乳腺癌小鼠模型中高表达,当通过皮下注射反义寡核苷酸降低其表达水平后,具有较高肺转移可能性的侵袭性乳腺癌向转移性较弱的囊性肿瘤转变,表明MALAT1 可以作为显著降低肿瘤转移风险的靶标,为乳腺癌的抗MALAT1 疗法提供了有力的根据[24]。在宫颈癌中,高表达MALAT1 可能是通过下调miR-429 促进了宫颈癌进程,HeLa 细胞裸鼠异种移植模型结果显示下调MALAT1 会抑制肿瘤大小和重量[25]。
除了上文提及的反义寡核苷酸、ZFN 技术之外,还有siRNA、miRNA、TALEN 以及CRISPR/Cas9等[26],这些短双链RNA 分子和基因组编辑技术在通过敲低MALAT1 治疗肿瘤的策略上具有重要作用。此外,MALAT1 敲除可以通过诱导固有凋亡相关信号触发5-氟尿嘧啶介导的HepG2 细胞凋亡,即MALAT1 与化疗药物合用也有可能成为一条肿瘤治疗途径[27]。
5 MALAT1 与肿瘤的预后
MALAT1 是从初期NSCLC 患者肿瘤细胞中筛选出来的转录本,不但有助于识别发生转移的高风险初期患者,而且是判断肿瘤预后的重要指标。研究发现MALAT1、NEAT1 以及Oct4 在124 例肺癌患者中的共表达是预测患者预后不良的独立因素[28];而位于MALAT1 上的rs3200401 T 等位基因的遗传变异与晚期肺腺癌患者的良好预后相关,患者的中位生存时间(median survival time,MST)平均延长10.6 个月,可以作为新指标预测肺腺癌患者的临床结局[29]。WANG 等[30-31]在509 例原发性乳腺癌手术切除的患者中验证MALAT1 表达与无复发生存率(relapse-free survival,RFS)的相关性,结果显示,在激素受体阳性或肿瘤分级低的患者中,MALAT1 高表达的患者复发风险比低表达者增加了2 倍,且初次手术至最早出现复发证据的时间间隔更短,即MALAT1 高表达与RFS 较低相关。再者,通过检测146 例接受根治性手术切除的Ⅱ/Ⅲ期结直肠癌患者的肿瘤组织,发现MALAT1 在肿瘤组织中的表达水平是正常组织的2.26倍,且无病生存率(disease free survival,DFS)更低,预后相对较差[32-33]。而骨髓瘤患者的MALAT1表达水平经抗肿瘤治疗后显著下调,患者的无进展生存率(progression-free survival,PFS)比对照组平均延长13 个月;同时,MALAT1 水平变化的临界值可以用于预测出现早期进展的患者(PFS ≤18个月),其阳性预测值为76.5%、准确性为75%[34]。
此外,还有其他肿瘤如膀胱癌[35]、胰腺癌[36]等,MALAT1高表达的患者与预后较差相关(表2)。这些研究结果表明MALAT1 可能是预测各种癌症结果的独立生物标志物,并需要进一步更大样本量的临床验证。
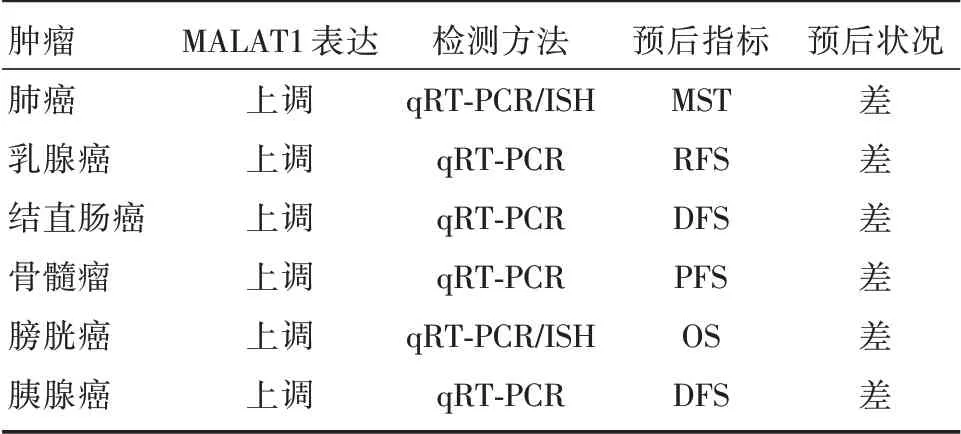
表2 MALAT1 在肿瘤预后中的应用Tab.2 Application of MALAT1 in tumor prognosis
6 总结与展望
本文一方面探讨了MALAT1 在多种肿瘤中的异常表达与肿瘤细胞增殖、转移等过程的密切关系,另一方面着重阐述了MALAT1 在肿瘤早期诊断、治疗及预后评估中的应用价值与前景。另外,通过横向比较MALAT1 在各种肿瘤中的研究策略,可以看出目前针对MALAT1 的研究路线较为成熟,主要是通过体外培养肿瘤细胞系,在细胞水平上探索MALAT1 对肿瘤细胞生物学进程的调控及其调控机制,再建立小鼠模型进一步验证。但是,MALAT1 的具体作用机制、参与的调控网络等方面仍需深入研究,距离它真正应用到实际临床工作中还有很多的工作需要做。
综上所述,MALAT1作为一种重要的lncRNAs,其应用是多样化的[37],未来有可能开发成为肿瘤诊断和预后的生物标志物以及肿瘤治疗新靶点,而且与药物联用也是其临床转化的重要方向。

