水杨梅黄酮类成分初步表征及水杨梅总黄酮抗氧化作用研究*
覃开羽,张 蓓,王 莹,万永艳,梁学政,吴 敏
(广西壮族自治区柳州市中医医院,广西 柳州 545026)
水杨梅为茜草科植物水杨梅Adina rubella Hance的干燥带花果序[1-2],一般分布在广西、湖南、四川、福建、台湾、广东等地,好生于溪边、河边、沙滩等湿润处,有清热利湿、解毒消肿功效,主要用于治疗湿热泄泻、痢疾、湿疹、疮疖肿毒、风火牙痛、跌打损伤、外伤出血等。水杨梅具有抗肿瘤、抗病毒、抗菌、抗氧化等生物活性,其中抗氧化活性尤其显著[3]。水杨梅发挥抗氧化作用的有效成分为酚酸类化合物,此化合物具有酚羟基结构[4]。本课题组扩大思路,拟从水杨梅中发现新的抗氧化活性成分[5-8]。鉴于黄酮类成分同样具有酚羟基结构,故也应具有抗氧化作用。为此,本研究中以水杨梅总黄酮为指标性成分,通过比较大孔吸附树脂法、石灰乳-硫酸法及萃取法考察最佳纯化工艺,通过超高效液相色谱-四极杆飞行时间串联质谱(UPLC-Q-TOF-MS)法表征纯化前后的黄酮类成分,并研究其抗氧化作用,为水杨梅的抗氧化作用研究提供参考[9-12]。现报道如下。
1 仪器与试药
1.1 仪器
L5 型紫外分光光度计(上海仪电分析仪器有限公司);KR 型80-2 离心沉淀器(常州市康仁医疗器械有限公司);PHS-3C 型酸度计(上海光学仪器厂);DKS26 型电热恒温水浴锅(上海精宏实验设备有限公司/太仓精宏仪器设备有限公司);UPLC QTOF MS6545 型色谱仪,超高效液相色谱-四极杆飞行时间串联质谱仪(美国Agilent 公司);GWB-1 超纯水系统;层析柱(2.5 cm×23 cm/3.5 cm×33 cm);RE-5299 型旋转蒸发器(上海亚荣生化仪器厂);AL204 型电子天平(梅特勒-托利多仪器<上海>有限公司)。
1.2 试药
水杨梅,购自广西贵港绿之源中药饮片厂,经我院吴冰副主任药师鉴定为草科水杨梅的茎皮;芦丁对照品(中国食品药品检定研究院,批号为100080-201610,含量≥99%);ABTS(国药集团化学试剂有限公司,批号为20190711);DPPH(国药集团化学试剂有限公司,批号为20190731);维生素C(天津力生制药股份有限公司,批号为2002008);HPD-100 型大孔吸附树脂;水饱和正丁醇、甲醇为色谱纯,其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 溶液制备
取芦丁对照品10 mg,精密称定,加甲醇溶解并定容至50 mL,即得质量浓度为0.2 mg/mL 的芦丁对照品溶液。称取水杨梅药材样品粉末10 g,置锥形瓶中,加入15 倍量的70%乙醇,温度80 ℃,回流提取1 h,滤过,浓缩,即得供试品溶液。
2.2 检测波长确定
取芦丁对照品溶液5 mL,置25 mL 容量瓶中,加水至6 mL,加入1 mL 5% 亚硝酸钠溶液,摇匀,静置6 min;加入1 mL 10%硝酸铝溶液,摇匀,静置6 min;加10 mL 4%氢氧化钠溶液,用水定容,摇匀,放置15 min。在400 ~600 nm 波长范围内扫描,结果芦丁对照品在510 nm 波长处有最大吸收峰,故以510 nm 作为检测波长。
2.3 线性关系考察
精密量取芦丁对照品溶液1,2,3,4,5 mL,按2.2 项下方法操作至“放置15 min”。用紫外分光光度计在510 nm 波长处测定吸光度。以吸光度为纵坐标(Y)、芦丁对照品溶液质量浓度为横坐标(X,μg/mL)进行线性回归,得回归方程Y =0.013 3 X-0.008 5,R2=0.999 6(n =5)。结果表明,芦丁质量浓度在8 ~40 μg/mL 范围为与吸光度线性关系良好。
2.4 大孔树脂预处理和装柱
大孔吸附树脂用去离子水浸泡10 h,使之充分溶胀,滤去水、浮游物和破碎树脂后,水洗至澄清。再用2 mol/L 氢氧化钠浸泡8 ~10 h,并不时搅拌,除去碱液,水洗至中性,再经2 mol/L HCl 浸泡8 ~10 h,并不时搅拌,以除去新树脂中的各种杂质,除去酸液后水洗至中性,然后用95%乙醇浸泡4 ~6 h,并不时搅拌,滤去乙醇,继续用甲醇洗脱至洗出液滴入水中不呈乳白色混浊为止,再用去离子水洗去甲醇,湿法装柱[13-14]。装柱前先在柱中加入一定量的水,将带水的树脂浆液倒入柱中,将过量的水从柱底放出,保持水面高于树脂层面3 cm,并使树脂分布均匀[15]。
2.5 成分分析
色谱条件:色谱柱为Agilent Eclipse Plus C18柱(50 mm×2.1 mm,1.8 μm);流动相为甲醇(A)-水(B),梯度洗脱(0 ~5 min 时15%A,5 ~10 min 时23%A,10 ~20 min 时35%A);流速为0.2 mL / min;柱温为25 ℃;进样量为10 μL。
质谱条件:采用电喷式离子源(ESI)、正离子检测模式,IDA 扫 描,离子喷雾电压分别为(ESI+)55 kV,(ESI-)-4 500 V,去簇电压(DP)分别为100 V/-100 V;碰撞电压(CE)为35 eV;雾化气(gas 1)气压为55 psi;辅助加热器(gas 2)气压为55 psi;气帘气(CUR)气压为35 psi;去溶剂温度(TEM)为500 ℃;扫描范围(TOF MASSES)m/ z 100 ~2 000;碰撞活化扫描(CES)为15 eV。
成分分析:供试品溶液按前述色谱和质谱条件进样分析纯化前后最佳工艺富集部位的主要成分。利用Qualitative Analysis V10.0 分析软件,分别提取正、负离子模式下采集的样品溶液的基峰离子流图,参考文献[16-17],再分别结合数据库匹配和已有文献报道比对,并对其m/ z 及化学式进行分析[18],对其中的黄酮类成分进行归属,定性鉴别纯化前富集部位中的36 个黄酮类成分和纯化后富集部位的28 个黄酮类成分。结果见表1 和表2。
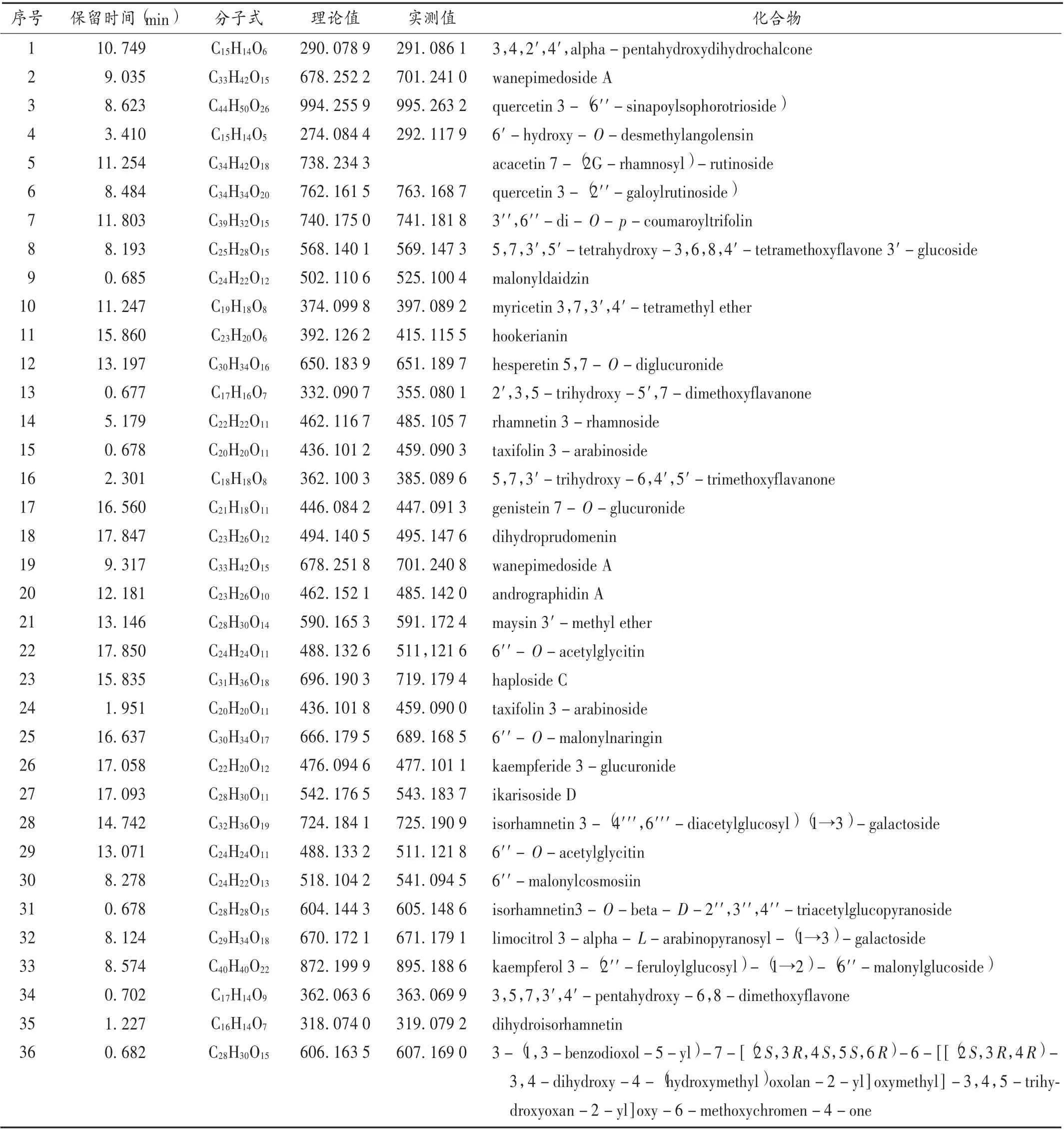
表1 纯化前的水杨梅黄酮类成分分析Tab.1 Analysis of flavonoids of Adina rubella before the purification

表2 纯化后的水杨梅黄酮类成分分析Tab.2 Analysis of flavonoids of Adina rubella after the purification
2.6 3 种纯化方法比较
2.6.1 石灰乳-硫酸法
将水杨梅总黄酮提取液浓缩至30 mL,用石灰乳调pH 至12,充分反应,再用硫酸调pH 至5 ~6,持续搅拌,静置滤过,滤渣水洗3 次,滤液并入洗液,浓缩,再用95%乙醇定容至50 mL,待测。
2.6.2 萃取法
将水杨梅总黄酮浓缩液30 mL 依次用20 mL 石油醚、乙醚、乙酸乙酯、水饱和正丁醇各萃取3 次,回收溶剂,将萃取液浓缩蒸干,用95%乙醇溶解,并定容至50 mL 容量瓶中,待测。
2.6.3 大孔树脂吸附法
树脂静态吸附试验:1)吸附时间考察。取大孔吸附树脂3.0 g,置100 mL 具塞锥形瓶中,精密加入已知水杨梅总黄酮质量浓度(P0)的提取液20 mL,将锥形瓶置35 ℃振荡水槽中振荡(140 次/分),每隔2 h 测定1 次待测液质量浓度(P1),测定时间设定为2,4,6,8,10 h,测定至树脂吸附饱和为止,分别计算每个时间段的吸附率Va[ Va =(P0- P1)/ P0×100% ],绘制静态等温吸附动力曲线。结果见图1 A。可知,吸附率随吸附时间的延长而上升,当吸附时间为8 h 时吸附率达到平衡。2)pH考察。取4 份水杨梅总黄酮提取液待测液,测定P0,将待测液的pH 分别调至5.44,5.47,5.50,5.52,各取20 mL,与1.5 g 树脂装于具塞锥形瓶中,置35 ℃振荡水槽中振荡(140 次/分)10 h 后静置,测定P1,计算吸附率。结果见图1 B。可知,吸附率在pH 达5.47 前有上升趋势,达5.47 时最高,之后呈下降趋势。3)洗脱剂体积分数考察。移取3 份已充分吸附水杨梅总黄酮的树脂,置具塞锥形瓶中,分别加入30 mL 体积分数分别为30% ,40%,50%,60%,70%,80%的乙醇,置35 ℃振荡水槽中振荡(140 次/分)后静置,使黄酮从树脂上解析,分别测定洗脱液浓度(C),计算洗脱率(洗脱率=洗脱液浓度×洗脱液体积/饱和吸附量)。结果见图1 C。可知,乙醇体积分数为50%时的洗脱率最高,故在进行树脂吸附黄酮的动态洗脱时,选用50%乙醇作为洗脱剂。

图1 树脂静态吸附的影响因素Fig.1 Factors affecting static adsorption of resin
树脂动态吸附试验:1)动态吸附泄漏曲线。以提取液-树脂体积比为横坐标、吸附率为纵坐标考察泄漏曲线,当达到平衡时,吸附速率与洗脱速率相等。结果见图2 A。可知,当提取液达到7 倍量的树脂体积时,水杨梅总黄酮开始出现明显泄漏,达到吸附饱和时,可处理12 倍量树脂的提取液,故确定水杨梅总黄酮提取液最大上柱体积为540 mL。2)动态洗脱曲线。以洗脱液体积为横坐标、洗脱液体积分数为纵坐标绘制树脂的动态洗脱曲线,结果见图2 B。可知,当洗脱液体积超过160 mL时,洗脱液体积分数呈逐渐下降趋势,说明水杨梅总黄酮在洗脱液体积为160 mL 时可洗脱完全,而后逐渐减少。

图2 树脂动态吸附试验曲线图Fig.2 Curve of resin dynamic adsorption test
2.6.4 效果比较
大孔树脂法中,提取液体积为315 mL 左右时,水杨梅总黄酮开始出现明显泄漏,洗脱剂体积约为540 mL时,树脂的解析达到平衡。将上述动态吸附和动态洗脱条件下得到的洗脱液进行浓缩、真空干燥、粉碎,得精制后的水杨梅总黄酮提取物,测定其总黄酮的得率为0.643%,纯度为57.33%。
经石灰乳-硫酸法所得产物,经分光光度计测定其吸光度,计算其中所含总黄酮浓度,再将其烘干称定质量,3 次平行试验后,测得水杨梅总黄酮得率为0.873%,纯度为33.17%。
水杨梅总黄酮粗提物依次经石油醚、乙醚、乙酸乙酯、水饱和正丁醇萃取,平行试验3 次,经测定水杨梅总黄酮得率为1.103%,纯度为36.35%。
可见,测定水杨梅总黄酮的纯度大小依次为大孔树脂法>萃取法>石灰乳-硫酸法。
2.7 水杨梅总黄酮抗氧化活性
2.7.1 溶液制备
ABTS 溶液:将7 mmol/L ABTS 无水乙醇溶液与2.45 nmol/L 过硫酸钾溶液等体积混合,室温避光放置16 h,形成ABTS 贮备液。使用时用无水乙醇稀释成734 nm 波长处吸光度为0.7±0.02 的工作液。
DPPH 溶液:取DPPH 适量,精密称定,置容量瓶中,加入无水乙醇溶解并定容,得DPPH 溶液。避光操作。
PBS:分别取Na2HPO4和NaH2PO4粉末适量,精密称定,置容量瓶中,加入去离子水溶解并定容,得相应溶液,混合,得pH 6.60 PBS。
2.7.2 抗氧化活性测定
ABTS 自由基清除率:取ABTS 工作液适量,置试管中,加提取物样品溶液,混匀,室温下反应,以维生素C为参照进行比较,在734 nm 波长处测定其吸光度。以无水乙醇作阴性对照,计算清除率。清除率=(1- A1/ A0)×100%。其中,A1为加入供试品后的吸光度,A0为阴性对照的吸光度。结果清除率为84.89%。
DPPH 自由基清除率:将0.1 mL 提取物样品溶液及维生素C 溶液分别加入一定量的DPPH 溶液,迅速混匀,置37 ℃水箱中30 min 后,在517 nm 波长处进样测定,以等体积水和无水乙醇混合液空白调零,以维生素C作阴性对照。结果清除率为48.69%。
铁还原能力:取提取物样品溶液、PBS 和铁氰化钾溶液置试管中,混匀,50 ℃反应20 min,加入10%三氯乙酸终止反应,3 000 r/min 离心10 min,取上清液,加水和三氯化铁溶液,混匀,10 min 后,于700 nm 波长处进样测定。以维生素C 为阳性对照,吸光度为0.823 3,提取物样品溶液吸光度为0.743 3。
3 讨论
3.1 3 种分离纯化方法比较
黄酮类成分的分离纯化方法较多,如聚酰胺柱层析法、液-液萃取法、大孔树脂吸附法,以及超临界萃取法、超滤法、溶剂气浮等新技术。本研究中从操作性、经济性、有效性3 个方面综合考虑,最终选择了萃取法、石灰乳-硫酸法、大孔吸附树脂法3 种分离纯化方法。
萃取法是运用几种不同极性的有机溶剂将水杨梅粗提物除黄酮外的其他成分提取分离。由于相似相溶的原理,极性相似的成分均可被分离出来,但与黄酮极性相似的成分同样可保留下来。此方法虽然操作简单、耗时短,但重复操作萃取步骤易造成有效成分损耗过多,且使用多种极性溶剂成本过高,易造成环境污染,后期回收难度大,提纯率也欠佳,故不是分离纯化黄酮类成分的最佳方法。
石灰乳-硫酸法是简单的分离方法,利用“碱提酸沉”的方法提取分离黄酮类成分。黄酮类成分含有多个酚羟基,显弱酸性,易溶于碱性溶液而遇酸性溶液则沉淀析出。本操作虽然简单易行,但对于溶液的酸碱度要求较严格,若碱浓度过高易破坏黄酮母核,影响有效成分的提取,酸性也不宜过强,以免生成盐致使析出的沉淀又重新溶解,降低产品得率。结果证实,此方法的总黄酮得率略低,故不作最佳提取方法。
大孔吸附树脂属有机高聚物吸附剂,具有选择性好、吸附量大等特点,且再生处理简便,尤其适用于黄酮类成分的分离纯化,也利于大规模生产[19-22]。大孔吸附树脂法最大的不足在于耗时长,成本花费主要在时间上。从树脂的活化操作开始,直至纯化过程中树脂的吸附、洗脱,均需耗费大量时间。且大孔吸附是由于物理吸附的原理,依靠分子之间的范德华力,通过比表面进行物理吸附而工作,不受化学试剂的影响,损耗较小。此方法最终得到分离纯化的黄酮类成分得率远高于其他2 种方法,故本研究中选择其作为最佳分离纯化工艺。
3.2 化合物表征
本研究中运用UPLC-Q-TOF/MS 技术,通过比对数据库匹配度较高的黄酮类成分进行了初步分析,有效表征了纯化前(36 个)、纯化后(28 个)水杨梅的黄酮类成分[23-27],其中有9 种为相同的黄酮类化合物。可能是由于纯化工艺的影响,导致某些黄酮类化合物不被富集,纯化后检测出新的黄酮类化合物则可能是由于富集后有效提高了该类化合物的含量,故能被仪器所识别。这与纯化后检出的化合物总数多于纯化前的情况相符。本研究中通过初步结构表征结合抗氧化活性的文献报道,对水杨梅有抗氧化活性的黄酮类成分进行初步归属,发现槲皮素类成分发挥了主要作用。
3.3 抗氧化活性测定
本研究中抗氧化能力的3 种方法体外测定机制不完全一致,其中ABTS 法、DPPH 法以清除自由基为基础,铁还原法主要通过测定待测物的还原能力。
ABTS 法、DPPH 法均会生成新的配对化合物,吸光度也随之改变,故可通过比色法进行定量分析,从而判定抗氧化成分的活性。铁还原法是当试剂与抗氧化成分反应后,在酸性条件下与三氯化铁反应生成普鲁士蓝,在700 nm 波长处有吸收,从而判定其抗氧化活性。
3 种方法均利用吸光度原理进行抗氧化活性测定,方法简单易行,且重复性好,3 种反应强度均与抗氧化成分的活性呈量效关系,结果均证实水杨梅总黄酮有一定抗氧化活性。但本研究中仅探讨了水杨梅是否具有抗氧化活性,并未作进一步的活性分析。具体是何种成分发挥了作用,有待运用对照品结合一级质谱相对分子量、二级质谱裂解结构进行分析,从而为下一步抗氧化试验打下基础。

