硝化抑制剂与尿素配施对旱地土壤温室气体排放及硝化微生物的影响①
沈晓忆,夏围围*,张 洁,贾仲君
硝化抑制剂与尿素配施对旱地土壤温室气体排放及硝化微生物的影响①
沈晓忆1,夏围围1*,张 洁1,贾仲君2
(1 南京信息工程大学应用气象学院,南京 210044;2 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
为明确施肥措施对旱地土壤温室气体排放的综合效应及微生物机理,采集典型麦田土壤进行室内微宇宙培养,研究了双氰胺(DCD)和烯丙基硫脲(ATU)分别与尿素配施对旱地土壤氮素转化及N2O、CO2和CH4排放的影响,同时监测了不同类型微生物群落的动态变化。结果表明氨氧化细菌(AOB)主导了施氮麦田土壤硝化过程及N2O排放。单施尿素促进AOB迅速繁殖,使N2O排放总量提高235%,同时促进了细菌生长,CO2排放量增加18.5%。DCD与尿素配施极大程度抑制了AOB的生长,显著降低了N2O排放(59.4%),但促进了细菌的生长并提高了CO2的排放总量(50.6%)。而ATU与尿素配施同时抑制了真菌、细菌和AOB的生长,对反硝化细菌的影响则相反,使CO2和N2O排放分别下降28.4% 和35.2%。与不施肥相比,氮肥及与两种硝化抑制剂配施均显著降低了CH4的排放量。3种温室气体的综合温室效应在处理间差异显著:Urea+DCD>Urea>CK>Urea+ATU。CO2排放对综合温室效应的贡献最大,CO2和N2O的贡献之和大于98.4%。该研究为深刻理解农田土壤中的微生物行为及生态学效应,合理使用硝化抑制剂以及减缓温室气体排放提供科学依据。
温室气体;土壤微生物;氮转化;烯丙基硫脲;双氰胺
氮肥能够满足作物生长对氮(N)元素的需求,是我国农业生产中施用最广的肥料,但利用率平均不足35%[1]。土壤微生物驱动了农田生态系统的氮素转化,加速了氮素损失。由氨氧化细菌(AOB)和氨氧化古菌(AOA)推动的硝化作用[2-3],是旱地土壤中NH4+-N向NO– 3-N转化的主要过程。快速产生的土壤NO– 3-N如不及时被植物吸收,则极易在土壤中淋溶损失,降低氮肥的增产效益,同时导致水体富营养化等环境问题。硝化过程易产生副产物N2O[4],进一步加剧了全球气候变化。研究表明AOB和AOA在不同类型土壤硝化过程和N2O排放过程中的贡献有较大差异[5-6]。除此之外,在土壤的厌氧微域,异养生长的反硝化微生物也可能参与了无机氮的还原,促进了N2O的排放[7]。
施用硝化抑制剂,可以选择性地抑制土壤硝化微生物活性,影响氮素转化,减缓硝酸盐的产生以及降低N2O的排放。硝化抑制剂种类繁多,其中,双氰胺(dicyandiamide, DCD)作为传统硝化抑制剂已被广泛使用。大量田间试验研究表明DCD可显著抑制土壤硝酸盐的积累[8]以及减少N2O的排放[9]。但也有研究结果显示DCD不能抑制土壤硝化作用以及氨氧化微生物的生长[10]。DCD抑制效果的差异,除了受土壤pH、土壤有机质含量和土壤类型等理化因素影响外,还可能与土壤中不同类型氨氧化微生物对DCD的敏感程度有关[11-12]。烯丙基硫脲(allylthiourea, ATU)是一种实验室常用的新型硝化抑制剂。在液体培养基和活性污泥反应器中发现,ATU能显著抑制氨氧化细菌,而对古菌不敏感[13-14],表明在针对性抑制AOB主导的土壤硝化过程中具有应用价值,同时具有减少N2O排放的潜力。但ATU在土壤中的有效施用量及对农田土壤N2O排放的贡献鲜见报道。
农业活动是主要的温室气体(CO2、N2O和CH4)排放源之一,对全球温室气体排放总量的贡献率达14%[15],对全球增温的贡献率达80%[16]。硝化抑制剂与氮肥配施不仅能够抑制N2O的排放,同时还可能改变土壤pH、无机氮含量、有机质含量以及不同微生物类群的活性,从而影响土壤另外两种主要温室气体CO2和CH4的排放。目前,DCD生态效应的研究多集中在参与N素转化的硝化微生物以及对温室气体N2O排放的影响,而其对CO2、N2O和CH43种温室气体排放的综合增温效应及内在微生物机制报道较少。ATU的相关研究则更加缺乏。因此,研究不同硝化抑制剂的综合生态效应,不仅有助于提高氮素利用率,还能为制定有效的综合温室气体减排措施提供理论依据。
综上所述,我们认为DCD和ATU能够通过抑制硝化作用减少N2O排放,并降低综合温室效应。基于以上假设,本研究采集典型麦田土壤,采用室内微宇宙培养法进行培养,并结合分子生物学手段,分析了尿素及与不同类型硝化抑制剂(DCD和ATU)配施对旱地土壤氮素转化及N2O、CO2和CH4排放的影响,同时监测了不同类型微生物群落的动态变化。该研究也为深化碳氮循环过程的微生物机理提供一定的理论依据。
1 材料与方法
1.1 供试土壤
供试土壤取自于南京信息工程大学农业气象试验站(32°07′N,118°50′E)。样品采集时间为2017年3月。采用五点交叉取样法,用土钻采集0 ~ 20 cm的耕层土壤500 g。将供试土壤去除杂物、植物残体,研磨过2 mm筛,并混合均匀,组成混合代表土样,保存于4 ℃待用。该土壤的基本理化性质为:pH 5.86,含水率2.85%,NO– 3-N 10.21 mg/kg,NH4+-N 9.37 mg/kg,有机碳33.8 g/kg。
1.2 土壤室内微宇宙培养
本次培养设置 4 个处理:①CK,以等体积灭菌水代替其他试剂加入土壤;②Urea,尿素按N 100 μg/g加入土壤,其他施氮处理的尿素用量与此相同;③Urea+DCD,DCD用量为15 μg/g(尿素含氮量的15%)[17-18];④Urea+ATU,ATU用量为5 μg/g(尿素含氮量的5%)。具体流程:称取相当于6.0 g干土的新鲜土壤于120 ml 血清瓶中,加入无菌去离子水调节土壤水分至最大持水量40%,用丁基橡胶塞密封,并用铝盖封口,于28 ℃ 黑暗中预培养24 h,以恢复土壤微生物活性。预培养后,将培养瓶取出,打开橡胶塞,用压缩空气冲洗血清瓶上部空间1 min。加入对应底物至每个血清瓶底部土壤中,使土壤水分达最大持水量的 60%,塞紧橡胶塞,并用铝盖封口,于28 ℃ 黑暗条件培养 28 d。每个处理6 个重复。
1.3 CO2、N2O、CH4的排放动态
在 0、7、14、21、28 d分别采集血清瓶上部气体样品,使用气象色谱仪(Agilent 7890)对3种温室气体CO2、N2O和CH4浓度进行检测。每个处理3个重复。采气后,打开铝帽和橡胶塞,用压缩空气冲洗血清瓶,再塞上橡胶塞和铝帽,重新置于28 ℃ 继续培养。以每种气体的周排放量之和,表示每种气体的累积排放量。
综合温室效应(global warming potentials, GWP)表示相同质量的不同温室气体对温室效应增加的相对辐射效应。在100 a时间尺度上,CH4和N2O的增温潜势分别是按照单位质量CO2的25倍和298倍[19]。由CO2、N2O、CH4的累积排放量,根据以下公式进行综合温室效应计算:
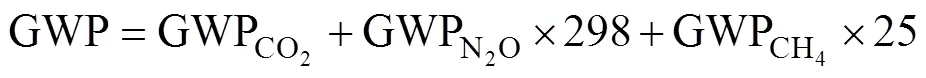
1.4 土壤NH4+-N、NO– 3-N分析
在0、14、28 d进行破坏性采样。每个血清瓶取1.5 g土壤保存于–20 ℃,用于后续分子生物学分析;剩余土壤用于NH4+-N、NO– 3-N分析,每个处理3个重复。分别采用酚二磺酸比色法和靛酚蓝比色法进行土壤NO– 3-N和NH4+-N的测定。以土壤NO– 3-N的增加量表示土壤的硝化强度。
1.5 土壤微生物DNA提取
采用FastDNA®Spin Kit for Soil(MP Biomedicals)试剂盒提取土壤总DNA,溶解于70 μl无菌水。通过微量紫外分光光度计(Nano Drop®ND-1000 UV-Vis)测定DNA浓度和纯度(OD260/OD280和OD260/OD230),确保大部分DNA样品OD260/OD280值介于1.8 ~ 2.0,以保证DNA质量。同时利用1.2% 琼脂糖凝胶电泳分析DNA的完整性和相对浓度。
1.6 土壤微生物的实时荧光定量PCR监测
实时荧光定量PCR在CFX96 Optical Real-Time Detection System(Bio-Rad)定量PCR仪上进行。分别对6个特定基因进行定量,引物和定量PCR条件见表1。PCR扩增反应体系为:10 μl的SYBR®Premix EX TaqTM(Takara),上、下游引物(20 μmol/L)各1.0 μl,加入1.0 μl稀释20倍的DNA模板,加入灭菌双蒸水至20 μl反应体系。每次试验均采用无菌水代替DNA作为严格的阴性对照。获得扩增产物后,进一步通过2.0% 琼脂糖凝胶电泳检测PCR产物的特异性。

表1 荧光实时定量PCR引物和反应条件
1.7 数据处理
采用SPSS 16.0进行统计分析;采用单因素方差分析检验同一处理不同时刻以及不同处理同一时刻样品的差异显著性;采用Pearson双尾检验分析土壤微生物各种特征基因丰度与温室气体CO2、N2O、CH4累计排放量以及土壤NO– 3-N含量的相关性;最后利用Origin 8作图。
2 结果
2.1 N2O、CO2和CH4通量变化及综合温室效应
N2O、CO2和CH4在处理间的排放趋势基本一致,累积排放量与培养时间正相关,但不同气体的排放量在处理间存在差异(图1)。对于N2O排放而言,单施尿素刺激了N2O的排放,28 d培养期内的累积排放量最高,达1 622.0 ng/g,分别是Urea+ATU、Urea+ DCD和CK处理的1.5倍、2.5倍和3.4倍。Urea处理前两周的N2O周排放量高于Urea+ATU处理,后两周无显著差异。Urea+DCD处理的N2O周排放量均显著低于Urea和Urea+ATU处理;前3周的周排放量与CK处理无显著差异,但第4周较CK显著提高。培养28 d,CK处理CO2累积排放量为1 391.3 μg/g。单施尿素显著刺激了土壤CO2的产生,CO2在28 d内的累积排放量增加258.0 μg/g,较CK处理增幅达18.5%;其中,第2周内CO2排放最多,达679.0 μg/g,是CK的3.0倍。与Urea处理相比,Urea+DCD处理显著提高了CO2周排放(第2周除外),CO2在28 d内的累积排放量增加50.6%;尤其第3周内CO2排放最多,达1 351.2 μg/g,为总累积排放量的54.4%。同样地,较Urea处理,Urea+ATU处理在培养期间CO2周排放量显著降低,且CO2在28 d内的累积排放量减少28.4%,约占CK处理的84.8%。CH4在28 d内的累积排放量在CK处理中最高,约为965.3 ng/g;Urea和Urea+DCD处理次之且无显著差异,分别为CK的71.4% 和73.3%;Urea+ATU处理最低,较Urea处理减少27.1%。
根据CO2、N2O和CH4增温潜势可知,处理间产生的综合温室效应存在较大差异(图1D)。总体而言,处理间综合温室效应强度表现为Urea+DCD> Urea>CK>Urea+ATU;单一气体对综合温室效应的贡献为CO2>N2O>CH4。Urea和Urea+DCD处理CO2、N2O和CH4的三者综合温室效应比CK处理分别增加了588.4和1 136.4 μg/g(以CO2当量计),增幅分别达37.7% 和72.8%,说明单施尿素及尿素与DCD配施能够显著增加旱地土壤温室气体排放的综合温室效应。而Urea+ATU处理中的综合温室效应与CK处理无显著变化,较Urea处理降低。CO2排放对Urea和Urea+ATU处理的综合温室效应贡献分别为76.7% 和78.4%,N2O排放的贡献分别为22.5% 和20.8%。在Urea+DCD处理中,CO2排放对综合温室效应的贡献高达92.1%,而N2O仅为7.3%,与CK处理较为相似。CH4排放对综合温室效应的贡献在CK处理最高,约为1.6%,在其余处理中贡献仅为0.7% ~ 0.8%。
2.2 土壤无机氮转化强度
以一定时间内土壤NO– 3-N含量的增加量表示土壤硝化强度。由图2可知,与对照相比,单施尿素显著提高了土壤的硝化强度,DCD极大程度抑制了土壤的硝化作用,而ATU对硝化强度的影响不显著。
Urea处理经过28 d培养,尿素水解产生的NH4+-N经硝化作用完全转化成了NO– 3-N,土壤NO– 3-N含量增加122.51 μg/g,显著高于CK处理(22.06 μg/g);其中,前14 d平均硝化速率为8.14 μg/(g·d),后14 d平均硝化速率仅为0.61 μg/(g·d)(图2C)。CK处理的硝化速率均低于Urea处理,分别为1.38 μg/(g·d)和0.22 μg/(g·d),表明非外源氮而是土壤矿化出的NH4+-N作为底物促进了土壤的硝化作用。Urea+DCD处理较Urea处理28 d内土壤NO– 3-N含量减少95.17 μg/g,降幅达78.7%,较CK处理仅增加5.27 μg/g。Urea+ATU处理与Urea处理相比,无论是14 d还是28 d内的土壤NO– 3-N含量都无显著差异,表明ATU对该土壤的硝化强度无显著影响。除了硝化作用受到强烈抑制的Urea+DCD处理中土壤NH4+-N依然维持在较高水平(122.66 μg/g),其他处理中土壤NH4+-N含量均较低(9.37 ~ 11.37 μg/g),且无显著差异。
Fig. 2 Changes of soil nitrate and ammonia contents and nitrogen turnover rates in different treatments during 28-day incubation
土壤NO– 3-N产生速率和N2O积累速率极显著正相关(=0.86,<0.001)。除了Urea+DCD处理外,其他处理前14 d的土壤NO– 3-N和N2O累积速率显著高于后14 d。而Urea+DCD处理虽然在后14 d NO– 3-N的产生速率和前14 d无显著差异,但N2O累积速率却显著提高。
2.3 土壤细菌、古菌和真菌丰度的变化
荧光定量PCR对土壤细菌16S rRNA基因、古菌16S rRNA基因和真菌18S rRNA基因进行定量,评估CO2排放相关的主要土壤微生物类群对尿素及硝化抑制剂的响应。由图3可知,同一处理的不同类型土壤微生物的响应规律并不一致,同一类型微生物在不同处理间的变化趋势也不尽相同。总体而言,在各处理中规律趋势一致:细菌丰度>古菌丰度>真菌丰度;真菌(=0.751,<0.001)、细菌(=0.691,<0.01)和古菌(=0.491,<0.05)丰度与CO2通量变化均显著正相关(表2)。
单施尿素培养28 d显著刺激了细菌的生长,细菌16S rRNA基因丰度由0 d 时9.25×109copies/g增加到1.22×1010copies/g,增幅达31.6%,但与14 d相比无显著变化。Urea+DCD处理中细菌丰度亦随培养时间显著增加,尤其后14 d增幅最大;与14 d时相比,培养28 d细菌16S rRNA基因丰度增加58.2%,从9.96×109copies/g增加至1.58×1010copies/g;与0 d时相比,增加70.4%。Urea+ATU处理的细菌变化趋势与以上两个处理完全相反,培养28 d时比0 d时减少了4.01×109copies/g,降幅达56.7%。
古菌和真菌在不同处理中变化趋势较为一致,随培养时间而显著增加,但增幅存在差异。培养28 d后,古菌16S rRNA基因和真菌18S rRNA基因丰度在CK处理中增幅最大,分别由0 d时5.53×107copies/g和4.04×106copies/g增加到2.21×108copies/g和1.29×107copies/g;古菌在Urea和Urea+ATU处理中增幅最小;真菌在Urea+ATU处理增幅最小,且在Urea和Urea+DCD处理中无显著差异。
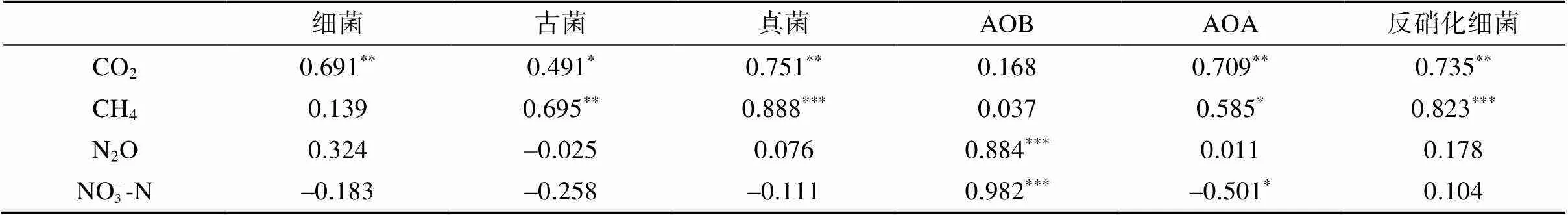
表2 土壤微生物特征基因丰度与温室气体CO2、CH4、N2O累计排放量以及NO– 3-N含量的相关性
注:Pearson双尾显著性检验,= 27;*、**、***分别表示相关性达<0.05、<0.01和<0.001 显著水平。
2.4 土壤硝化和反硝化微生物丰度的变化
通过荧光定量PCR对土壤氨氧化细菌基因、氨氧化古菌基因以及反硝化基因进行定量,评估N2O排放相关的土壤功能微生物类群对尿素及硝化抑制剂的响应。由图4可知,3种类型功能微生物在不同处理中的响应规律有明显差异。总体而言,土壤NO– 3-N含量变化与AOB丰度(=0.982,<0.001)极显著正相关,与AOA丰度显著负相关(=–0.501,<0.05)(表2)。N2O通量变化与AOB丰度具极显著相关(=0.884,<0.001),与AOA和反硝化细菌丰度无明显相关性(表2)。
单施尿素刺激了AOB的生长,细菌基因丰度随培养时间显著增加,由0 d时2.66×107copies/g提高到28 d时2.32×108copies/g,增加了7.69倍;其中,前14 d生长最快,14 d时细菌基因丰度已经达到28 d时的89.4%,与硝化速率的变化较为一致。Urea+ATU处理中同样检测到大量的AOB生长,细菌基因丰度在14 d和28 d分别为同时刻尿素处理的83.2% 和90.1%,与硝化过程未受到明显抑制(图2)较为相符。Urea+DCD处理中细菌基因丰度亦呈增加趋势,28 d时较0 d时增加了1.36倍。CK处理AOB丰度保持稳定。与0 d时相比,培养28 d后,在硝化强度相对较弱的CK和Urea+DCD处理中,AOA和反硝化细菌的丰度均高于硝化强度较高的Urea和Urea+ATU处理,与AOB的变化趋势相反,表明AOB对供试土壤中高强度的无机氮转化起主导作用。同时,N2O与硝化强度极显著相关(=0.87,<0.001),表明AOB亦主导了该土壤施氮条件下的N2O排放。AOB与AOA、反硝化细菌以及总细菌的比值(图4)在Urea和Urea+ATU处理中均高于CK和Urea+DCD处理,与硝化强度以及N2O通量变化趋势较为一致,进一步证明了AOB对该施氮土壤中强烈硝化作用以及N2O排放的重要贡献。
3 讨论
本研究发现该麦田土壤排放的3种温室气体(CO2、N2O和CH4)综合温室效应在处理间由强到弱顺序为Urea+DCD>Urea>CK>Urea+ATU,表明施肥措施及硝化抑制剂类型强烈影响单一以及综合温室气体排放量。较多研究表明在旱地生态系统中土壤温室气体排放以CO2和N2O的净排放为主[26],而在稻田生态系统中温室气体的交换则是以CO2的净吸收以及CH4和N2O净排放为主要特点[27-28]。本研究中尿素氮肥输入旱地土壤,促进了温室气体排放,使综合温室效应提高了37.7%,其中CO2的贡献占76.7%,N2O的贡献占22.5%。相似地,华北平原玉米地土壤CO2对综合温室效应的贡献高于N2O,且N2O的贡献最高可达39%[29]。而在另一种麦田土壤中,虽CO2对综合温室效应的贡献高于N2O,但N2O的贡献仅为CO2的3%[26]。可见,温室气体之间的相对排放量在不同旱地土壤中亦存在较大差异。大量研究发现在旱地土壤中DCD对N2O的减排效果较好,在不同类型(包括小麦、蔬菜、玉米、草地等)旱地土壤中DCD对N2O的减排效率达30% ~ 70%[30-32]。本研究中DCD添加使N2O降低约59%,与以上结果基本符合。但也有报道表明在酸性土壤中DCD对N2O排放无明显作用[33]。在本研究中,ATU添加使N2O排放量降低约35%,而目前未见ATU对其他土壤N2O减排作用的报道。另外,本研究发现DCD刺激了土壤CO2的排放,说明使用硝化抑制剂减排N2O时,不能忽略其对其他温室气体的影响。但一些文献也报道了与本研究不同的结果,它们发现DCD可能对CO2的排放无作用或有抑制作用。这种差异可能与土壤的性质以及土壤微生物对DCD的降解有关[34]。室内微宇宙培养法是揭示生态过程潜在微生物机理的有效方法,在温室气体排放的机理研究中应用广泛[35-37]。本试验采用室内微宇宙培养法进行培养,监测了不同时刻温室气体的排放量,虽然定期更新了瓶内空气,但每周培养瓶内温室气体的累积以及气压变化可能会对不同温室气体的排放产生影响,未来还需要对原位条件下两种硝化抑制剂的生态效应做进一步评估。我们的研究结果反映了硝化抑制剂施用条件下旱地土壤温室气体排放的一种模式,为硝化抑制剂在实际生产中的应用以及温室气体减排提供了参考。
尿素作为一种常用化学氮肥,在农业中的使用量约占化学氮肥总量50%。尿素进入土壤溶液后迅速水解NH4+,为氨氧化细菌和古菌提供了充足的底物。本研究发现单施尿素显著提高麦田土壤的硝化强度,促进了土壤N2O的排放。在培养14 d时已将尿素水解产生NH4+完全氧化,N2O的排放速率与NO– 3-N累积速率极显著正相关(=0.99,<0.001),N2O的排放系数(ΔN2O-N/ΔNO– 3-N)约0.79%,符合我国旱地土壤 N2O的排放系数范围(0.22% ~ 1.13%)[38]。AOB数量的增加与N2O和NO– 3-N积累量极显著正相关(<0.001),与以往研究较为一致,表明AOB而不是AOA是中性–碱性土壤(pH>5.5)外源高浓度NH4+向NO– 3转化及N2O排放的主导驱动者[6, 39-40]。另外,实验室纯培养时发现AOB具有较强的细胞水平产N2O能力,属AOB单位细胞产N2O速率为2.0 ~ 7.6 amol/h,属AOB单位细胞产N2O速率可达15.5 ~ 58.0 amol/h[41]。而本试验条件下,假设单施尿素条件下N2O全由AOB产生,则AOB细胞N2O产生速率平均约为1.04 amol/h,与较为接近,说明属AOB可能是该土壤中主要活性AOB类群。值得注意的是,本试验中土壤AOB产N2O活性明显低于纯培养条件,表明土壤环境中微生物的活性受到更加复杂的因素影响。该土壤在不施氮条件下,AOA的数量随培养时间显著增加,NO– 3-N的积累与AOA呈强烈正相关(=0.97,<0.05),表明AOA可以利用土壤有机质矿化出的低浓度NH4+进行生长[42]。假设不施氮条件下N2O由AOA硝化作用产生,则AOA单位细胞产N2O速率最大可达0.76 amol/h,与AOA纯菌细胞产N2O速率(1.0 amol/h)较为接近[42],直接表明AOA可能在无外源氮肥输入的自然生态系统N2O排放中具有重要作用。
DCD作为氮肥增效剂被广泛用于农业生产,其对土壤氮转化及硝化微生物的抑制作用已有较多报道[34, 43-44],我们的结果与此较为相似。本研究中DCD与尿素配施分别使NO– 3-N和N2O的积累量减少71.7% 和59.3%,AOB的数量减少72.9%,表明DCD与尿素配施是减少旱地土壤N2O排放的一项有效措施[45]。但与14 d相比,28 d时AOB和AOA的丰度有显著增加,可能是土壤中DCD的降解导致其对硝化微生物的抑制效果减弱。O’Callaghan等[34]研究发现土壤中的DCD在28 d内降解量可达20 μg/g,表明DCD在土壤中能够快速降解。同时,细菌和反硝化细菌在28 d时也有显著提高,并促进了CO2排放。相似地,王红霞等[46]研究也发现当土壤中DCD浓度低于5 mg/g时能够促进细菌生长,低于1 mg/g时还同时促进放线菌生长,高于以上浓度则分别对细菌和放线菌生长表现出抑制作用;但对霉菌则具有普遍抑制作用。这种现象可能是由于低浓度DCD降解刺激了部分异养微生物的生长,而高浓度DCD则可能改变土壤环境并且对微生物产生毒害。除此之外,马军伟等[47]还发现DCD能够改变细菌和真菌的群落结构,并提高细菌和真菌的丰富度和多样性。
在液体培养基中ATU浓度小于100 μmol/L即能对AOB生长活性产生强烈或完全抑制[48-49]。本研究ATU的施用量为15 μg/g,在土壤溶液中浓度约为118 μmol/L,未能显著降低土壤NO– 3-N的产生速率,对AOB的抑制作用较为微弱,跟预先假设不一致。类似地,在冰岛草地土壤中100 μmol/L ATU亦未对AOB和AOA生长表现出明显抑制或促进作用[50]。但也有研究发现在其他农田或草地土壤中100 μmol/L ATU可以部分抑制硝化作用,并降低AOB的生长活性[51-53]。这种抑制效果的差异可能与土壤类型、土壤的非匀质结构、土壤氨氧化微生物的组成以及其他微生物对抑制剂的降解等有关。本试验中AOA丰度对ATU未有明显响应,与大多数报道一致。AOA对ATU浓度不敏感,所需有效抑制浓度可能是AOB的1 000倍[49]。甚至有些学者还发现低浓度ATU (100 ~ 1 000 ng/g)对AOA生长具有促进作用[12]。因此,ATU对土壤中AOB和AOA的有效抑制浓度以及对不同土壤类型中氮素转化过程的影响尚需进一步验证。另外,我们还发现ATU降低了细菌和真菌的丰度,表明细菌和真菌的某些类群对ATU较为敏感。一些研究表明硫脲类化合物对多种代表性植物病原菌、病毒等具有强烈的抑制作用[54]。然而目前尚不清楚ATU是否会对土壤中的有益微生物产生影响,以及ATU在生态系统食物链中传递是否会带来生态环境健康风险。因此,虽然ATU施用显著降低了综合温室效应,但目前不推荐ATU在农业生态系统中被广泛应用。未来需要结合“土壤–微生物–植物”系统以对ATU的生态效应和生物机理做更加全面的评估和阐释。
4 结论
AOB主导了施氮麦田土壤NH4+-N向NO– 3-N的转化以及N2O排放。单施尿素以及与硝化抑制剂(DCD和ATU)配施对麦田土壤温室气体排放及微生物群落的影响存在较大差异。单施尿素促进了AOB的迅速繁殖,极大地增加了N2O排放总量,同时促进了细菌生长及CO2排放,提高了综合温室效应。DCD施用极大程度抑制了AOB的生长,显著降低了N2O排放,但促进了细菌群落的生长,从而提高了CO2排放总量,并显著提高了综合温室效应。而ATU施用对AOB的生长有轻微抑制作用,对反硝化细菌的生长有轻微促进作用,但对AOA丰度影响不显著,显著降低了CO2和N2O排放,降低了综合温室效应。与对照相比,尿素及与硝化抑制剂配施均显著降低了CH4的排放量,但CH4对综合温室效应的贡献(<1.65%)远远低于CO2和N2O。
[1] 朱兆良. 氮素管理与粮食生产和环境[J]. 土壤学报, 2002, 39: 1–10.
[2] Shen J P, Zhang L M, Di H J, et al. A review of ammonia- oxidizing bacteria and Archaea in Chinese soils[J]. Frontiers in Microbiology, 2012, 3: 296.
[3] 贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展[J]. 生态学报, 2009, 29(1): 406–415.
[4] Prosser J I, Hink L, Gubry-Rangin C, et al. Nitrous oxide production by ammonia oxidizers: Physiological diversity, niche differentiation and potential mitigation strategies[J]. Global Change Biology, 2020, 26(1): 103–118.
[5] Lu L, Jia Z J. Urease gene-containing Archaea dominate autotrophic ammonia oxidation in two acid soils[J]. Environmental Microbiology, 2013, 15(6): 1795–1809.
[6] Xia W W, Zhang C X, Zeng X W, et al. Autotrophic growth of nitrifying community in an agricultural soil[J]. The ISME Journal, 2011, 5(7): 1226–1236.
[7] Cantarel A A M, Bloor J M G, Pommier T, et al. Four years of experimental climate change modifies the microbial drivers of N2O fluxes in an upland grassland ecosystem[J]. Global Change Biology, 2012, 18(8): 2520–2531.
[8] Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing Archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. The ISME Journal, 2012, 6(5): 1032–1045.
[9] Di H J, Cameron K C. The use of a nitrification inhibitor, dicyandiamide (DCD), to decrease nitrate leaching and nitrous oxide emissions in a simulated grazed and irrigated grassland[J]. Soil Use and Management, 2006, 18(4): 395– 403.
[10] Dai Y, Di H J, Cameron K C, et al. Effects of nitrogen application rate and a nitrification inhibitor dicyandiamide on ammonia oxidizers and N2O emissions in a grazed pasture soil[J]. Science of the Total Environment, 2013, 465: 125–135.
[11] Amberger A. Research on dicyandiamide as a nitrification inhibitor and future outlook[J]. Communications in Soil Science and Plant Analysis, 1989, 20(19/20): 1933–1955.
[12] Lehtovirta-Morley L E, Verhamme D T, Nicol G W, et al. Effect of nitrification inhibitors on the growth and activity of Nitrosotalea devanaterra in culture and soil[J]. Soil Biology and Biochemistry, 2013, 62: 129–133.
[13] He X J, Ji G D. Responses of AOA and AOB activity and DNA/cDNA community structure to allylthiourea exposure in the water level fluctuation zone soil[J]. Environmental Science and Pollution Research, 2020, 27(13): 15233– 15244.
[14] Srithep P, Pornkulwat P, Limpiyakorn T. Contribution of ammonia-oxidizing Archaea and ammonia-oxidizing bacteriato ammonia oxidation in two nitrifying reactors[J]. Environmental Science and Pollution Research, 2018, 25(9): 8676– 8687.
[15] FAOSTAT. Food and agriculture organization of the united nations[OL]. Http://faostat.Fao.Org/site/567/default.Aspx# ancor. 2014.
[16] Forster P, Ramaswamy V, Artaxo P, et al. Changes in atmospheric constituents and in radiative forcing//Solomon S, Qin D, Manning M, et al. Climate change 2007: The physical science basis. Contribution of working group Ⅰ to the fourth assessment report of the Intergovernmental Panel on Climate Change[R]. New York: Cambridge University Press, 2007.
[17] 杨剑波, 李学超, 徐晶晶, 等. 两种硝化抑制剂在不同土壤中的效果比较[J]. 土壤, 2014, 46(2): 319–324.
[18] 张昊青, 赵学强, 张玲玉, 等. 石灰和双氰胺对红壤酸化和硝化作用的影响及其机制[J]. 土壤学报, 2021, 58(1): 169–179.
[19] IPCC. Climate change 2013: The physical science basis. Contribution of working group i to the fifth assessment report of the intergovernmental panel on climate change[R]. New York: Cambridge University Press, 2013.
[20] Lane D J. 16S/23S rRNA sequencing//Stackebrandt E, Goodfellow M. Nucleic acid techniques in bacterial systematics[M]. New York: John Wiley and Sons, 1991: 115–175.
[21] Ochsenreiter T, Selezi D, Quaiser A, et al. Diversity and abundance of Crenarchaeota in terrestrial habitats studied by 16S RNA surveys and real time PCR[J]. Environmental Microbiology, 2003, 5(9): 787–797.
[22] Vainio E J, Hantula J. Direct analysis of wood-inhabiting fungi using denaturing gradient gel electrophoresis of amplified ribosomal DNA[J]. Mycological Research, 2000, 104(8): 927–936.
[23] Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural geneas a functional marker: Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63(12): 4704–4712.
[24] Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing Archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683–14688.
[25] Braker G, Fesefeldt A, Witzel K P. Development of PCR primer systems for amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples[J]. Applied and Environmental Microbiology, 1998, 64(10): 3769–3775.
[26] 郭树芳, 齐玉春, 罗小玲, 等. 滴灌对干旱区春小麦田土壤CO2、N2O排放及综合增温潜势的影响[J]. 农业环境科学学报, 2016, 35(4): 792–800.
[27] 纪洋, 于海洋, 徐华. 控释肥与尿素配合施用对稻季土壤CH4和N2O排放的影响[J]. 生态环境学报, 2017, 26(9): 1494–1500.
[28] 展茗, 曹凑贵, 汪金平, 等. 复合稻田生态系统温室气体交换及其综合增温潜势[J]. 生态学报, 2008, 28(11): 5461–5468.
[29] 夏文斌, 张旭辉, 刘铭龙, 等. 麦秆还田方式对旱地土壤综合温室效应的影响[J]. 土壤, 2014, 46(6): 1010–1016.
[30] Qiu W H, Di H J, Cameron K C, et al. Nitrous oxide emissions from animal urine as affected by season and a nitrification inhibitor dicyandiamide[J]. Journal of Soils and Sediments, 2010, 10(7): 1229–1235.
[31] Ruser R, Schulz R. The effect of nitrification inhibitors on the nitrous oxide (N2O) release from agricultural soils-a review[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(2): 171–188.
[32] 戴宇, 贺纪正, 沈菊培. 双氰胺在农业生态系统中的应用效果及其影响因素[J]. 应用生态学报, 2014, 25(1): 279–286.
[33] 王海飞, 贾兴永, 高兵, 等. 不同土地利用方式土壤温室气体排放对碳氮添加的响应[J]. 土壤学报, 2013, 50(6): 1172–1182.
[34] O’Callaghan M, Gerard E M, Carter P E, et al. Effect of the nitrification inhibitor dicyandiamide (DCD) on microbial communities in a pasture soil amended with bovine urine[J]. Soil Biology and Biochemistry, 2010, 42(9): 1425–1436.
[35] Hink L, Nicol G W, Prosser J I. Archaea produce lower yields of N2O than bacteria during aerobic ammonia oxidation in soil[J]. Environmental Microbiology, 2017, 19(12): 4829– 4837.
[36] Lin Y X, Ding W X, Liu D Y, et al. Wheat straw-derived biochar amendment stimulated N2O emissions from rice paddy soils by regulating thegenes of ammonia- oxidizing bacteria[J]. Soil Biology and Biochemistry, 2017, 113: 89–98.
[37] Zhang X, Duan P P, Wu Z, et al. Aged biochar stimulated ammonia-oxidizing Archaea and bacteria-derived N2O and NO production in an acidic vegetable soil[J]. Science of the Total Environment, 2019, 687: 433–440.
[38] 徐玉秀, 郭李萍, 谢立勇, 等. 中国主要旱地农田N2O背景排放量及排放系数特点[J]. 中国农业科学, 2016, 49(9): 1729–1743.
[39] Meinhardt K A, Stopnisek N, Pannu M W, et al. Ammonia- oxidizing bacteria are the primary N2O producers in an ammonia-oxidizing Archaea dominated alkaline agricultural soil[J]. Environmental Microbiology, 2018, 20(6): 2195–2206.
[40] Zhao J, Wang B Z, Jia Z J. Phylogenetically distinct phylotypes modulate nitrification in a paddy soil[J]. Applied and Environmental Microbiology, 2015, 81(9): 3218–3227.
[41] Shaw L J, Nicol G W, Smith Z, et al.spp. can produce nitrous oxide via a nitrifier denitrification pathway[J]. Environmental Microbiology, 2006, 8(2): 214–222.
[42] Hink L, Gubry-Rangin C, Nicol G W, et al. The consequences of niche and physiological differentiation of archaeal and bacterial ammonia oxidisers for nitrous oxide emissions[J]. The ISME Journal, 2018, 12(4): 1084–1093.
[43] Monaghan R M, Smith L C, de Klein C A M. The effectiveness of the nitrification inhibitor dicyandiamide (DCD) in reducing nitrate leaching and nitrous oxide emissions from a grazed winter forage crop in southern New Zealand[J]. Agriculture, Ecosystems & Environment, 2013, 175: 29–38.
[44] 伍延正, 张苗苗, 秦红灵, 等. 双氰胺对冬闲稻田和油菜地N2O排放的影响[J]. 环境科学, 2017, 38(5): 2084– 2092.
[45] 邱炜红, 刘金山, 胡承孝, 等. 硝化抑制剂双氰胺对菜地土壤N2O排放的影响[J]. 环境科学, 2011, 32(11): 3188–3192.
[46] 王洪霞, 孙庆元. 双氰胺对土壤微生物种群数量的影响[J].安徽农业科学, 2006, 34(1): 113–114.
[47] 马军伟, 孙万春, 胡庆发, 等. 氰胺类肥料对连作土壤微生物种群结构的影响[J]. 浙江大学学报(农业与生命科学版), 2013, 39(3): 281–290.
[48] Ginestet P, Audic J M, Urbain V V, et al. Estimation of nitrifying bacterial activities by measuring oxygen uptake in the presence of the metabolic inhibitors allylthiourea and azide[J]. Applied and Environmental Microbiology, 1998, 64(6): 2266–2268.
[49] Shen T L, Stieglmeier M, Dai J L, et al. Responses of the terrestrial ammonia-oxidizing archaeon Ca.and the ammonia-oxidizing bacteriummultiformis to nitrification inhibitors[J]. FEMS Microbiology Letters, 2013, 344(2): 121–129.
[50] Daebeler A, Bodelier P L E, Hefting M M, et al. Ammonia-limited conditions cause of Thaumarchaeal dominance in volcanic grassland soil[J]. FEMS Microbiology Ecology, 2015, 91(3): fiv014.
[51] Taylor A E, Vajrala N, Giguere A T, et al. Use of aliphaticn-alkynes to discriminate soil nitrification activities of ammonia-oxidizing thaumarchaea and bacteria[J]. Applied and Environmental Microbiology, 2013, 79(21): 6544–6551.
[52] Taylor A E, Zeglin L H, Dooley S, et al. Evidence for different contributions of Archaea and bacteria to the ammonia-oxidizing potential of diverse Oregon soils[J]. Applied and Environmental Microbiology, 2010, 76(23): 7691–7698.
[53] 刘天琳, 任佳琪, 王天佑, 等. 中性紫色水稻土硝化作用中细菌和古菌的相对贡献[J]. 土壤通报, 2018, 49(5): 1091–1096.
[54] 张志国, 唐越, 王敏, 等. 新结构硫脲类化合物的合成、鉴定及抑菌活性评价(英文)[J]. 微生物学通报, 2017, 44(6): 1437–1443.
Effects of Combined Application of Nitrification Inhibitors and Urea on Greenhouse Gas Emission and Ammonia Oxidizers in An Upland Soil
SHEN Xiaoyi1, XIA Weiwei1*, ZHANG Jie1, JIA Zhongjun2
(1 College of Applied Meteorology, Nanjing University of Information Science and Technology, Nanjing 210044, China; 2 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
The emission pattern of greenhouse gas (GHG) has been intensively investigated in different agro-ecosystems, but the underlying microbial mechanism in soil is still poorly understood, especially under many possible measures for improving nitrogen utilization. Thus, a 28-day laboratory microcosm experiment was conducted with an upland soil to investigate the effect of urea and two nitrification inhibitors on nitrogen turnover process and global warming potentials (GWP) of N2O, CO2and CH4, in which four treatments were established: CK (no fertilizer and inhibitor were applied), Urea (N 100 μg/g was applied to soil), Urea+15% Dicyandiamide (DCD, 15% of Urea-N in quantity), Urea+5% Allylthiourea (ATU, 5% of Urea-N in quantity). Meanwhile, the dynamics of different microbial abundances in treatments were also quantified by real-time quantitative PCR (qPCR). The results showed that ammonia-oxidizing bacteria (AOB) predominated intensive nitrification process and N2O emission in soil with urea application. Urea stimulated AOB growth and increased cumulative N2O by 235%, which rapidly occurred during the first 14 days. Bactria abundance raised in response to urea and improved CO2emission by 18.5%. Urea+DCD severely inhibited AOB and decreased N2O emission by 59.4%, but stimulated bacteria and increased CO2by 50.6%. Urea+ATU exhibited a strong toxicity on both bacteria and fungi and led to a decrease of CO2by 28.4%, but unexpectedly didn't show any inhibition on nitrification intensity. A slight but significant inhibition and stimulation were observed on AOB and denitrifiers by ATU, respectively, but total emission of N2O fell by 35.2%. CH4emission was inhibited in all treatments with urea and inhibitors. GWPs of N2O, CO2and CH4displayed significant differences among treatments: Urea+DCD>Urea>CK>Urea+ATU. The contributions of N2O and CO2to GWP exceeded 98.4% in soil. This study implies various mechanisms of nitrification inhibitors on soil microbial guilds and GHG emission, and is essential for the implementation of agricultural management and the evaluation of global climate change.
Greenhouse gas; Soil microorganism; Nitrogen turnover; Allylthiourea; Dicyandiamide
X171; S154.3
A
10.13758/j.cnki.tr.2021.03.010
沈晓忆, 夏围围, 张洁, 等. 硝化抑制剂与尿素配施对旱地土壤温室气体排放及硝化微生物的影响. 土壤, 2021, 53(3): 512–521.
国家自然科学基金项目(41501267)和土壤与农业可持续发展国家重点实验室开放课题项目(Y20160025)资助。
(wwxia@nuist.edu.cn)
沈晓忆(2000—),女,江苏苏州人,本科生,主要研究方向为农田土壤硝化过程的调控机理。E-mail:shen_xiaoyi0721@163.com

