肱骨近端骨量分布特点的研究进展
王烨明,魏万富
(天津市天津医院骨科,天津 300211)
肱骨近端骨折是临床常见的骨折,其发生率约占全身骨折的5%~9%[1]。多属于低能量脆性骨折。随着社会老龄化,肱骨近端骨折的发生率在2002—2017年间增加了46%。常见于60岁以上绝经后女性伴有骨量减少或骨质疏松者[1,2]。目前,移位的肱骨近端骨折常采用切开复位锁定钢板内固定。与传统钢板比较,锁定钢板具有更强的抗扭转性能,其角稳定性可避免螺钉退出、松动及内固定失败[3]。但近年来随着锁定钢板的广泛应用,相关的并发症时有报道,如肱骨头内翻移位、螺钉穿出肱骨头关节面等,发生率可高达48.8%[4]。肱骨头内锁定螺钉的初步稳定性取决于螺钉-骨界面的局部骨质量。已知骨质疏松是肱骨近端骨折术后内固定失败发生的危险因素之一[3,4]。在骨质疏松人群,肱骨近端的骨密度(bone mineral density,BMD)下降,而且在肱骨头、大、小结节和肱骨干骺端的骨量减少程度不同,区域性分布差异明显。目前存在的问题是尚无明确的肱骨近端“骨量区域分布图”来预测内置物设计和手术时螺钉的方向和位置,指导螺钉置入局部骨质量更好的解剖位置,增加螺钉的稳定性,尤其是在合并骨质疏松时。本文拟通过回顾已发表的相关文献,就肱骨近端的骨质量与性别、年龄的关系,分布特点和骨量的测量工具进行综述,以期对肱骨近端骨折的手术治疗提供借鉴和帮助。
1 肱骨近端骨量的测量工具
目前肱骨近端骨量的诊断工具主要是双能X线骨密度吸收仪(dual engery X-ray absorptiometry,DXA)和定量CT(quantitative computed tomography,QCT)。
DXA测定腰椎和髋部骨密度是诊断骨质疏松症的金标准。既往文献证实BMD每下降一个标准差,骨质疏松性骨折的风险增加1.5~3.0倍[5]。老年人群在BMD明显降低前,松质骨骨小梁显微结构已经衰败。骨几何形状、骨微结构、骨基质及骨转换率等对评价骨强度和预测脆性骨折均起着重要的作用,因此DXA测定不能完全有效的进行骨质疏松性骨折的预测[5-7]。DXA主要测定股骨颈和腰椎的面积骨密度,对于肱骨近端的骨质量是间接估计,与肱骨近端骨折Neer分型的相关性低[8]。同时由于DXA是二维的骨密度测量,不能分别对皮质骨和松质骨进行测量并提供力学特性的分析。由于肱骨近端不是常规的测量解剖部位,DXA对于感兴趣区的建立尚无统一的标准,一般包括肱骨头、外科颈、大结节和小结节[9,10]。
定量 CT (quantitative computed tomography,QCT)是在临床CT扫描图像的基础上,采用专用体模和软件对骨密度、体质成分和几何形态参数进行测量的方法。由于QCT采用CT的原始数据进行骨密度测量,测出的数值是真正体积骨密度(volumetric bone mineral density,vBMD)。QCT能将皮质骨和松质骨分开评价,且在CT图像上建立感兴趣区,不受肥胖、骨质增生和血管钙化的影响,是更准确的骨密度测量方法[10]。随着近年来QCT技术快速发展,辐射剂量逐渐降低,在肱骨近端骨折风险评估的价值已被充分肯定[11]。
2 肱骨近端骨质量与性别、年龄的关系
随年龄的增加,肱骨近端出现与中轴骨相似的骨量低下、骨微结构损坏的病理变化。首先在松质骨,肱骨近端冠状面切片的骨计量学结果表明,60岁以上的女性和骨量与年龄呈负相关,骨小梁的数量减少,连接性下降,在大结节最为明显。肱骨头上内侧骨小梁的结构、数目和连接性在各年龄组与性别上差异不明显[12]。肱骨头定量CT分析显示,随着年龄的增加,横截面内CT值低于80HU的松质骨面积逐渐增大,以外侧为主,在老年女性更为显著[13]。其次,皮质骨的厚度、皮质多孔性和皮质骨的横截面积是骨强度的重要影响因素[5,15]。Helfen 等[14]发现,65岁以后外科颈骨皮质厚度下降34%,骨皮质孔隙率增加93%。这种与年龄相关的皮质骨量丢失是由于骨髓腔面和皮质内的骨吸收增加,表现为骨髓腔横截面的扩大和骨皮质厚度减低[14,15]。另外,肱骨近端的松质骨和皮质骨总体骨量随年龄增加显著减少。一项应用DXE和QCT的横截面调查发现,白人男性在30~80岁期间BMD下降29%[15]。高分辨外周定量CT(high-resolution peripheral quantitative computed to⁃mography,HR-pQCT)扫描64例健康人肱骨近端新鲜标本的数据分析发现,BMD下降的主要年龄段为65~79 岁,最高降幅为 27%[14]。
3 肱骨近端骨结构的区域分布特点
肱骨近端骨结构由皮质骨和松质骨组成。松质骨被认为是影响内置物稳定性的主要内在结构,原因是肱骨近端富含松质骨,且老年人的皮质骨菲薄,常呈现为蛋壳样变化[10,12,14]。因此文献更多关注的是肱骨头内含松质骨分布特点。目前认为松质骨分布差异明显。松质骨螺钉的生物力学稳定性与局部骨密度、骨小梁显微结构和分布特点有关。在骨组织计量学上,冠状面上肱骨头中心上内方感兴趣区的骨小梁体积分数(bone volume to total tissue volume ratio,BV/TV)最高,自近端向远端逐渐下降[12]。Tingart等[16]自解剖颈截取肱骨头标本,在截骨面上建立前上、前下、后上、后下和中央5个感兴趣区。应用外周定量CT测定感兴趣区的BMD的同时,体外测定松质骨螺钉的把持力。结果显示,肱骨头内松质骨并非均一分布,以中央区BMD最高;并与螺钉的把持力正相关。Kamer等[17]发现组成肱骨近端的各个解剖部位的松质骨体积骨密度(vBMD)存在显著的可变性。其中松质骨vBMD在关节面下最高,肱骨近端髓腔最低,大结节和小结节没有明显差别(图1)。当骨量丢失时,松质骨的分布模式没有明显变化。
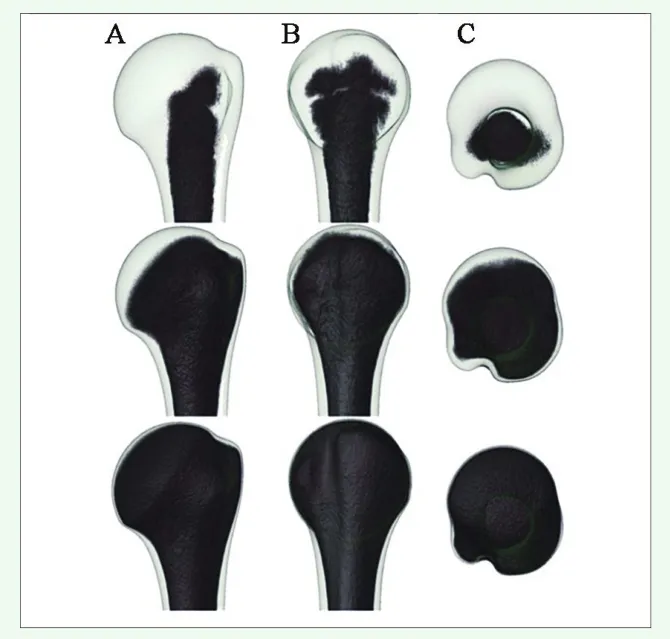
图1 肱骨近端骨量的三维分布(A)前面观(B)侧面观(C)颅侧观。肱骨近端根据体积骨密度(vBMD,mg HA/cm3)阈值设定3个有效区间:0~52(上排),0~250(中排)和0~500(下排)。在高阈值区间,仅软骨下松质骨未染色,提示骨量良好[17]
短柄的肩关节置换时,肱骨头假体的近端固定和骨长入对于维持假体稳定至关重要。松质骨BMD是肩关节假体初期稳定的重要影响因素,与负荷/移位的斜率正相关[18]。Alidousti等[19]应用定量 CT 扫描8例健康人的肱骨标本,自近至远平行于解剖颈将肱骨近端等分为12个截面。在每个截面内等分6个扇形,同时根据直径自中心至外周等分为4个同心圆区域。结果显示,肱骨近端解剖颈以上各截面骨密度较高,自近端向远端逐渐下降。在解剖颈以下骨密度自中心向外周依次增加。内侧柱的骨密度最高,但外侧靠近大、小结节骨密度最低。因此建议短柄肩关节置换时,注意保留解剖颈以上骨量,充分利用皮质下高密度的骨小梁稳定肱骨头假体。Reeves等[20]进一步扩大样本量至98例,利用定量CT测量肱骨近端松质骨-髓腔柱。其结果与Alidousti报道的相似。总之,尽管研究目的和感兴趣区设定不同,多数作者认为肱骨近端的松质骨存在明显区域性分布差异。
肱骨近端包括肱骨头、大结节、小结节和肱骨干骺端4个部分。每个部分内部松质骨都为差异性分布模式[9]。文献多集中在大结节骨质量与肩袖修复锚钉的稳定性相关研究[9,21]。大结节的骨皮质厚度与所在位置密切相关,靠近肱骨头关节面的皮质最厚[21]。从micro-CT分析数据看,大结节近端松质骨的骨小梁微结构指标明显优于远端,后1/3的骨小梁体积较前2/3为高。大结节近解剖颈处松质骨的骨小梁体积比、厚度和数量最高,骨小梁分离度最低,提示松质骨微结构良好,有利于内排锚钉的生物学固定。而大结节最高点以远15~22 mm的骨皮质最厚,尤其是前1/3是外排锚钉的最佳置入点[22]。
值得一提的是,肩袖损伤对大结节松质骨的影响存在争议。Oh等[23]发现,在有症状的肩袖损伤患者,患侧大结节松质骨的vBMD低于健侧。但与肩袖撕裂面积的大小无线性相关。在合并肩袖损伤的肱骨体外标本,大结节的骨小梁较肩袖完整者退变明显,骨计量学上表现为骨小梁体积比、骨小梁的厚度、数量和骨小梁模式因子下降[22]。说明大结节松质骨的骨量不仅受到年龄、性别、骨质疏松症等全身因素的影响,也与肩袖损伤及肩关节功能状态等局部因素有关。但也有结论相反的报道,经年龄校正后肩袖损伤对大结节骨小梁分数没有影响[21]。
肱骨近端的皮质骨也呈现与松质骨相似的差异性分布的特点。大结节后侧的皮质骨厚度最小,在大结节近外科颈水平的外侧皮质骨也存在薄弱点。这些生物力学上的薄弱点在摔伤时可形成应力集中,与肱骨近端骨折的发生密切相关[24]。Majed 等[25]对 37 例冰冻新鲜肱骨标本进行CT扫描,发现肱骨近端皮质骨厚度为0.33~3.5 mm。在30/37例标本中,肱骨干部骨皮质厚度高于干骺端;相对于大结节,小结节或结节间沟皮质骨厚度为高;在肱骨头关节面周围的皮质骨中,后侧的皮质骨最薄[25]。皮质骨的薄弱点、上肢的伤时位置与骨折线形态有关。大结节因其皮质骨厚度值相对小,是复杂肱骨近端骨折发生时骨折线的起点[26,27]。因此,皮质骨的非均一分布或许可解释肱骨近端骨折的受伤机制。同时结节间沟皮质骨厚度值较高的特点,对提高肱骨近端骨折的固定强度有帮助。当内侧柱骨折块粉碎缺乏有效支撑时,在结节间沟可辅助钢板固定,体外生物力学实验证实,其固定的刚度与肱骨距螺钉相似[28]。
综上所述,肱骨近端骨质量与性别、年龄密切相关,也受到肩袖损伤等局部因素的影响。肱骨近端的松质骨和皮质骨的分布存在明显的差异性,是肩关节内置物稳定性的重要影响因素。但由于实验设计、测量工具和方法不同,现有的研究结果相互引用时有一定困难。因此,肱骨近端的骨量分布特点有待进一步深入研究,以获得更加清晰、全面的骨量分布和变化图,以指导内置物的设计和减少手术并发症。

