不同序列间隔高频重复经颅磁刺激对运动区功率谱密度的影响
靳静娜 廖文清 刘文博 王 欣 刘志朋 殷 涛,3#*
1(中国医学科学院·北京协和医学院 生物医学工程研究所,天津 300192)2(华科精准(北京)医疗科技有限公司,北京 102629)3(中国医学科学院神经科学中心,北京 100730)
引言
经颅磁刺激(transcranial magnetic stimulation, TMS),是1985年英国谢菲尔德大学Barker等发明的一种无创、非接触评估神经功能和调控神经活动的物理手段[1]。其根据法拉第电磁感应原理,利用时变磁场穿透头皮和颅骨,在刺激靶区脑组织产生感应电流,引起大脑神经活动的兴奋/抑制变化,产生一系列生理和生化反应。重复经颅磁刺激(repetitive TMS, rTMS)是一种连续、有规律的重复输出电磁脉冲的TMS模式,可调控刺激靶区脑组织及与其有功能连接的远端脑区的神经活动,且该调控作用可以持续到刺激结束后一段时间[2]。因此,rTMS作为一种有效的手段,应用于治疗神经活动异常的神经和精神类疾病,如抑郁症、脑卒中、强迫症及精神分裂症等[3-4]。
在rTMS范式中,刺激强度和刺激频率等参数的设置直接影响其对大脑的调控作用,如不同刺激频率的rTMS对神经的调控作用差异很大,高频(≥5 Hz)rTMS可兴奋皮层兴奋性,而低频(≤1 Hz)可抑制皮层兴奋性。在高频rTMS范式中,序列间隔(inter-train intervals, ITI)是刺激前需要设置的一个重要参数[5]。ITI指在输出数十个或数百个刺激脉冲后的无刺激输出时间,即刺激间歇时间。在高频rTMS应用之初,ITI的设置主要有两个方面的考虑:一是防止重复输出的高电流脉冲导致线圈温度快速升高而热灼伤受试者;二是相比低频rTMS,高频rTMS具有更大的诱发癫痫风险,ITI的设置可降低此副作用的出现。
然而,2010年Rothkegel等[6]研究了有ITI和连续输出的高频 5 Hz rTMS对运动皮层兴奋性的影响,发现有ITI的高频rTMS可以易化皮层兴奋性,而连续输出的高频rTMS却没有改变皮层兴奋性,提示ITI可以改变rTMS调控神经可塑性的方向。同样,间断theta节律TMS可增强皮层兴奋性,而连续theta节律TMS则抑制皮层兴奋性,也表明了ITI对rTMS刺激效果具有重要的影响[7]。2017年,Cash等[8]首次通过记录肌电,研究不同ITI 20 Hz rTMS对运动皮层兴奋性和去抑制性的影响,发现不同ITI rTMS诱发的皮层去抑制效果显著不同。提示不仅有无ITI影响rTMS的作用效果,而且ITI不同,rTMS的作用效果也不同。
在高频rTMS实施中,10 Hz是常使用的刺激频率之一,其安全性好、可接受程度高,可以调控脑卒中和帕金森等患者的皮层兴奋性,有效提高肢体的运动功能[9-12]。然而,在现有的10 Hz rTMS应用研究中,ITI参数的选择仅考虑了应用的安全性[13],并没有结合脑活动特征变化给出参数的选择依据。目前,不同ITI的高频10 Hz rTMS对脑活动影响的对比研究,在国内外尚未有文献报道。
在应用10 Hz rTMS时,25和50 s是较常使用的ITI。本研究另选择了100 s ITI作为不同ITI对脑活动影响效果的补充,旨在研究常用的25和50 s ITI rTMS对脑活动影响的同时,探索性地研究延长ITI产生的影响。本研究采集不同ITI rTMS前后的闭目静息态脑电信号(electroencephalography, EEG),提取双侧运动区各频段功率谱密度及其偏侧性特征,通过直接记录皮层神经活动的方法,探讨不同ITI对脑运动功能区神经活动的调控作用,并对不同ITI的影响进行对比分析。
1 材料和方法
1.1 实验条件的建立
募集了11名健康志愿者(其中女性4名),年龄(25.27±2.28)岁,均为在校大学生。所有受试者均无神经系统疾病病史及家族史,未植入任何金属装置,也未服用任何药物。爱丁堡利手评定,表明受试者均为右利手。所有受试者在实验前48 h内没有服用咖啡、白酒等刺激性的饮品,实验前保证充足的睡眠。所有受试者均签署了知情同意书。
rTMS使用英国生产的Magstim Rapid2磁刺激器及70 mm的8字线圈。rTMS的实施在基于MRI T1影像的BrainSight精密导航下进行,保证了刺激靶点的精确性和一致性。由于不同受试者的静息态运动阈值(resting motor threshold, RMT)差异较大,本研究在rTMS实施前使用意大利Micromed多通道生理信号记录仪,采集右手拇短展肌的肌电信号,测量个体的RMT,用于设置个体化的rTMS刺激强度。EEG通过64通道BrainAmp脑电图系统采集,电极依据国际10/20系统标准位置放置,采集参数设置为DC-200 Hz的滤波、1 kHz采样率,数据采集时确保所有电极与头皮之间的阻抗≤5 kΩ。
1.2 实验流程
所有实验均安排在上午进行,实验前未告知受试者将要被实施的rTMS刺激方式。为了避免不同操作者可能带来的误差,所有受试者的手初级运动皮层hotspot位置点的定位及rTMS的实施均由同一名操作者完成。在整个实验过程中,受试者舒适地坐在实验室内的半靠背扶手椅上,保持放松状态,避免任何运动或肌肉收缩。
试验前,首先确定受试者的个体RMT和手初级运动皮层hotspot位置点。TMS刺激线圈保持与头皮相切,线圈把柄向后,并与大脑纵裂呈45°。根据解剖学上大脑初级运动皮层的位置,以中央前回的“手结”为中心移动线圈,寻找以最小刺激强度输出TMS刺激脉冲时,10次连续单脉冲TMS能产生至少5次肌电MEP幅值大于等于50 μV的皮层位置点,此时的刺激强度为该受试者的RMT,皮层位置点为手初级运动皮层hotspot位置点。
所有受试者均参与4次rTMS,包括ITI分别为25、50、100 s的真rTMS和1次伪rTMS,同一受试者接受相邻两次rTMS的间隔≥5 d。rTMS的刺激强度为80% RMT,刺激频率为10 Hz,每个脉冲序列持续5 s(每个序列50个脉冲),共18个序列、900个脉冲。伪rTMS的脉冲输出范式与25 s ITI的真rTMS脉冲输出范式相同,但在实施时将线圈旋转90°使其竖立,放置在与真rTMS相同的皮层位置。
实验流程如图1所示。在每次rTMS前,首先测量受试者的RMT,采集180 s闭眼静息态EEG。然后,以伪随机的方式实施4种不同范式rTMS中的1种,rTMS结束后立即采集180 s闭眼静息态EEG,再将数据存储用于后期离线分析。

图1 实验流程Fig.1 Experimental flowchart
1.3 脑电数据预处理
使用Matlab及工具包EEGLAB,对采集的闭目静息态EEG进行预处理,包括去除无用电极(TP9、TP10、FT9、FT10),变参考为平均参考,手动去除干扰大的信号段,进行[0.5 Hz,100 Hz]的带通滤波及使用50 Hz陷波器去除工频干扰,对坏导联进行插值,去除伪迹大的数据段。然后,进行独立分量分析,去除眼动和肌电等伪迹分量,对该无伪迹的EEG进行带通滤波,提取delta(0.5~4 Hz)、theta(4~8 Hz)、alpha(8~13 Hz)、beta(13~30 Hz)、gamma1(30~45 Hz)和gamma2(55~100 Hz)信号。选取无伪迹的150 s EEG信号,将其分为30个5 s的数据段,对每段EEG数据进行功率谱密度及其偏侧性的计算,最后进行叠加平均。
1.4 功率谱密度及其偏侧指数分析
分别对30个5 s的数据段用周期图法进行各频段功率谱密度的估计,然后计算双侧半球运动区各频段功率谱密度的偏侧指数,有
(1)
式中,PSDL为功率谱密度偏侧指数,RPSD为右侧半球某电极的功率谱密度值,LPSD为左侧半球某电极(与右半球电极对应的)功率谱密度值。
PSDL取值范围为[-1 1],如果左右侧半球功率谱密度相同,则取值为0;如果左侧半球功率谱密度较大,则为正值,反之则为负值。换言之,PSDL值越大,表示左侧半球的功率谱密度越高;反之,右侧半球的功率谱密度越高。为了评价不同ITI rTMS对双侧运动区功率谱密度偏侧性的影响,对总频段,delta、theta、alpha、beta、gamma1、gamma2频段,计算rTMS前后双侧运动区之间的偏侧指数。
1.5 统计分析
所有数据均使用均值±标准误的方式进行标示。首先,对获得的各频段功率谱密度及其偏侧性指数进行正态性检验及方差齐性检验。如果特征指标满足正态性和方差齐性,则使用配对t检验检测每组rTMS前后功率谱密度变化的统计学意义,然后再以组别(25 s ITI组,50 s ITI组,100 s ITI组,sham组)为因素,对特征指标的变化做单因素方差分析,并使用Bonferroni方法进行两两事后比较,获得不同ITI诱发特征指标变化的组间差异;如果特征指标不满足正态性或方差齐性,则使用Wilcoxon配对符号秩检验和Kolmogorov-Smirnov非参方差检验,P<0.05被认为差异具有显著的统计学意义。
2 结果
对各组rTMS前测量的个体RMTs(带脑电帽)及各组实施的rTMS刺激强度进行统计,如表1所示。可以看出,各组的RMT和rTMS刺激强度近似相同。单因素方差分析表明,25 s ITI、50 s ITI、100 s ITI和sham rTMS组间的RMT值和rTMS刺激强度均无统计学差异。

表1 rTMS前的RMT和刺激强度Tab.1 The RMT before rTMS and stimulation intensity
本研究通过单脉冲TMS测量个体RMT,从而确定初级运动皮层hotspot。测量结果发现,所有受试者的初级运动皮层hotspot位置点均位于FC1、FC3、C1和C3等4个电极构成的区域内。因此,对该4个电极的EEG信号进行功率谱密度及其偏侧指数提取并叠加平均,将其作为刺激侧运动区的特征。相应地,将刺激对侧的FC2、FC4、C2和C4等4个电极的EEG信号进行功率谱密度及其偏侧指数提取并叠加平均,作为刺激对侧运动区的特征变化。
2.1 序列间隔对双侧运动区总频段功率谱密度影响
图2为各组rTMS对双侧运动区总频段功率谱密度(0.5~100 Hz)的影响。由图可见,3个真 rTMS均使双侧运动区总频段功率谱密度增加。配对检验结果表明,100 s ITI rTMS使总频段功率谱密度显著增加(刺激前后(19.87±0.88)dB vs(20.85±0.95)dB),而其他rTMS使总功率谱密度的变化无统计学意义。此后进行的以组别为因素的方差分析表明,ITI对刺激侧运动区的总频段功率谱密度影响显著,而对刺激对侧运动区的影响不显著。进行两两比较后发现,100 s ITI rTMS与伪rTMS诱发的刺激侧总频段功率谱密度变化具有统计学意义。
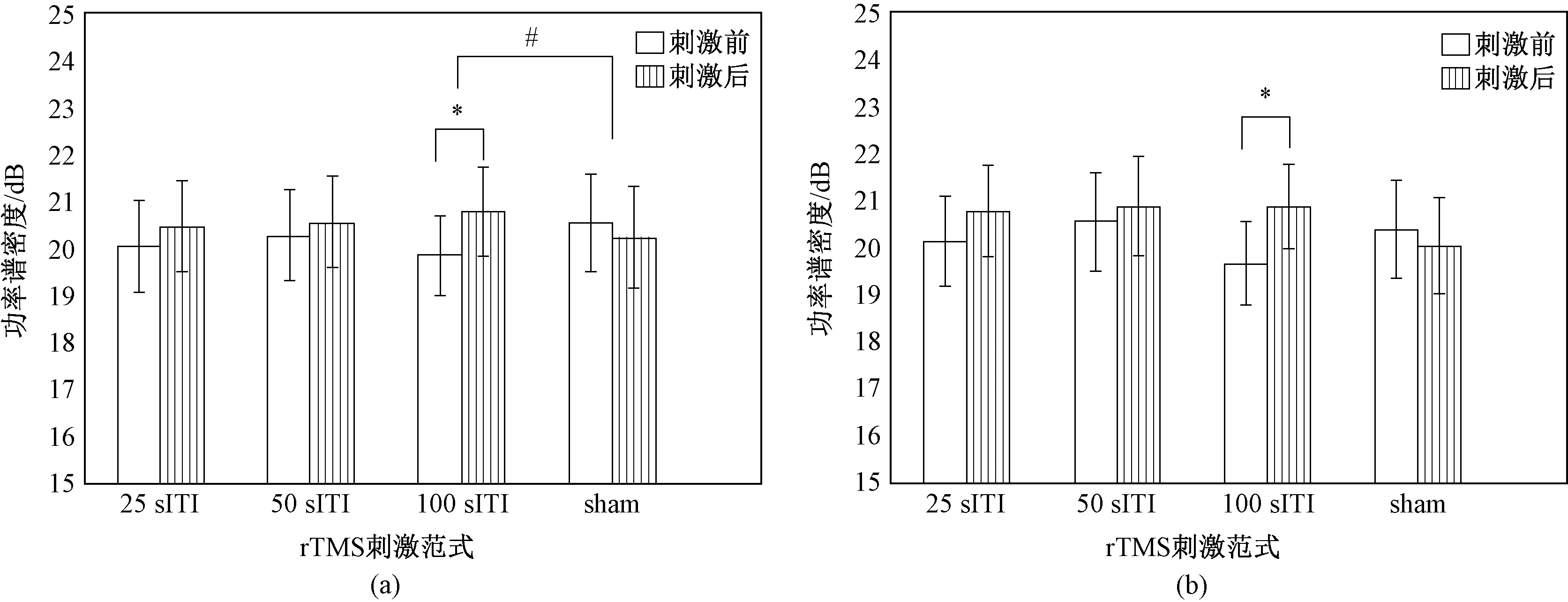
图2 不同ITI rTMS前后双侧运动区总频段功率谱密度的变化(*P<0.05表示前后差异有统计学意义;#P<0.05表示组间差异有统计学意义)。(a)刺激侧;(b)刺激对侧Fig.2 The power spectral density changes of bilateral motor cortices in all frequency band before and after each ITI rTMS(*P<0.05 indicated the changed before and after rTMS was significant,#P<0.05 indicated the changed between groups was significant). (a) Stimulated motor cortex; (b) Non-stimulated motor cortex
2.2 不同序列间隔rTMS对刺激侧运动区各频段功率谱密度的影响
对rTMS前后刺激侧运动区delta、theta、alpha、beta、gamma1和gamma2各频段功率谱密度的变化进行分析,结果如图3所示。由图可见,所有真rTMS均使刺激侧theta、alpha、beta频段能量增加。配对统计分析结果表明,25 s ITI rTMS和sham rTMS对刺激侧运动区各频段功率谱密度均没有显著影响。50 s ITI rTMS使刺激侧运动区theta和beta频段功率谱密度显著增加(P<0.05,theta频段刺激前后(11.42±1.01)dB vs(12.19±1.10)dB),beta频段刺激前后(10.71±0.99)dB vs(11.20±0.88)dB);同时使gamma2频段功率谱密度显著降低(P<0.05,刺激前后(4.94±0.97)dB vs(3.35±0.61)dB);100 s ITI rTMS使刺激侧theta、alpha和beta频段功率谱密度显著增加(P<0.05,theta频段刺激前后(11.29±1.00)dB vs(12.17±1.10)dB,alpha频段刺激前后(16.17±1.20)dB vs(17.74±1.20)dB,beta频段刺激前后(10.55±0.88)dB vs(11.26±0.90)dB)。此后进行的以组别为因素的方差分析结果表明, ITI 对alpha频段功率谱密度的影响显著。进行两两比较后,发现100 s ITI rTMS与伪rTMS诱发的功率谱密度变化具有统计学意义。
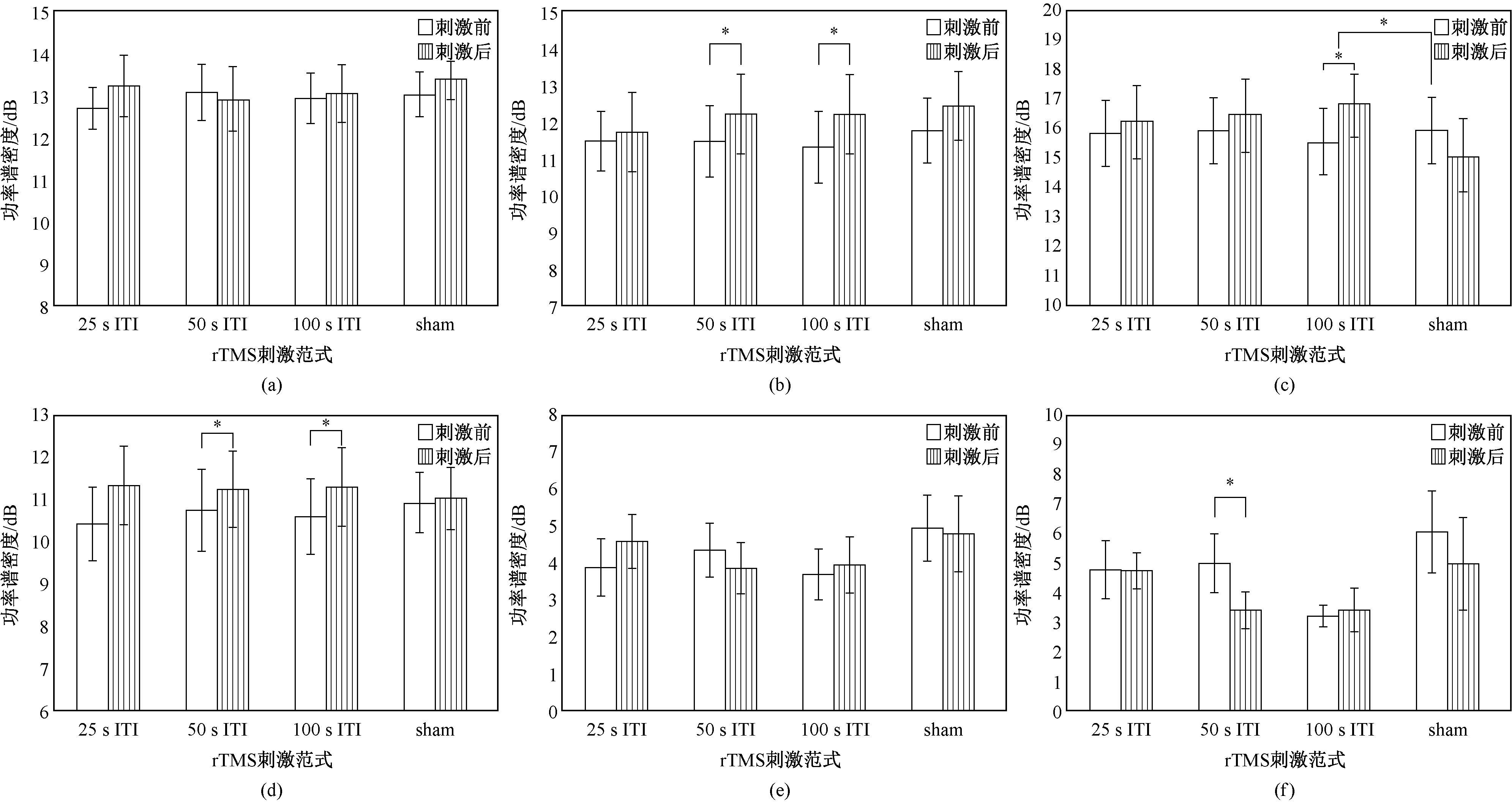
图3 ITI对刺激侧运动区各频段功率谱密度的影响(*P<0.05表示前后差异有统计学意义;#P<0.05表示组间差异有统计学意义)。(a)Delta; (b)Theta; (c)Alpha; (d)Beta; (e)Gamma1; (f)Gamma2Fig.3 The effects of ITI on the power spectral density of motor region over stimulated hemisphere in each frequency band (*P<0.05 indicated the changed before and after rTMS was significant,#P<0.05 indicated the changed between groups was significant). (a)Delta; (b)Theta; (c)Alpha; (d)Beta; (e)Gamma1; (f)Gamma2
2.3 不同序列间隔rTMS对刺激对侧运动区各频段功率谱密度的影响
对rTMS前后刺激对侧运动区delta、theta、alpha、beta、gamma1和gamma2各频段功率谱密度的变化进行分析,结果如图4所示。由图可见,真rTMS诱发刺激对侧运动区各频段功率谱的变化与刺激侧运动区的变化基本相同。仅50 s ITI rTMS的功率谱密度变化有区别,即50 s ITI rTMS使theta(刺激前后(11.15±1.07)dB vs(12.17±1.22)dB)频段功率谱密度显著增加,而没有使beta频段功率谱密度显著增加。在以组别为因素的方差分析中,所有rTMS范式诱发的各频段功率谱密度变化均无统计学意义。
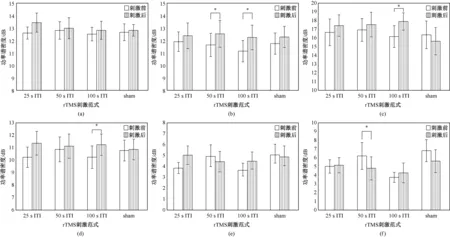
图4 ITI对刺激对侧运动区各频段功率谱密度的影响(*P<0.05表示前后差异有统计学意义;#P<0.05表示组间差异有统计学意义)。(a)Delta; (b)Theta; (c)Alpha; (d)Beta; (e)Gamma1; (f)Gamma2Fig.4 The effects of ITI on the power spectral density of motor region over non-stimulated hemisphere in each frequency band (*P<0.05 indicated the changed before and after rTMS was significant,#P<0.05 indicated the changed between groups was significant). (a)Delta; (b)Theta; (c)Alpha; (d)Beta; (e)Gamma1; (f)Gamma2
2.4 不同序列间隔rTMS对双侧运动区功率谱密度偏侧指数的影响
对总频段,delta、theta、alpha、beta、gamma1、gamma2频段的计算结果显示,两侧运动区功率谱密度偏侧指数变化趋向于零,表明双侧运动区功率谱密度的变化接近相同。
对不同ITI rTMS前后功率谱密度偏侧指数进行统计分析,结果显示,所有ITI rTMS 前后偏侧指数均没有显著性变化,各组之间的功率谱密度偏侧指数变化没有显著性差异。
3 讨论
本研究利用功率谱密度指标,探讨了不同ITI 高频rTMS刺激初级运动皮层对双侧运动区脑活动能量的影响。结果发现,rTMS范式中的ITI设置不同,其诱发的功率谱密度变化不同,表明高频rTMS对大脑的调控作用与ITI的长短有显著关系,提示在高频rTMS应用于疾病治疗的临床研究时,ITI的设置是需要慎重考虑的。
rTMS刺激初级运动皮层对运动区功率谱密度的影响,已有一些研究成果的报道。Strens等[14]和本课题组的研究[15]均发现,1 Hz低频rTMS刺激初级运动皮层没有诱发功率谱密度的变化,而是改变了皮层-皮层间的连接强度。本课题对10 Hz高频rTMS刺激运动区诱发的功率谱密度变化开展了深入的研究,结果发现,高频rTMS对运动区功率谱密度的影响与ITI的设置密切相关。当ITI为25 s时,10 Hz rTMS没有诱发运动区功率谱密度变化。当序列间隔延长到50和100 s时,运动区功率谱密度显著改变,且两者诱发的各频段功率谱密度变化又存在不同,即50 s ITI rTMS使高频段(gamma2)功率谱密度降低,而100 s ITI rTMS则使alpha频段功率谱密度增加。Gamma2频段的脑节律振荡与快速尖峰细胞的抑制性传输正相关[16],是脑活动被抑制的标志[17],提示50 s ITI rTMS可能是通过降低快速尖峰细胞的抑制输出,使皮层的兴奋性增加。而静息态alpha频段能量的增加,预示着神经元处于更加积极的预备运动状态,预示着更强的运动能力[18-21],提示与50 s ITI rTMS对脑活动的调控作用不同,100 s ITI rTMS可能是通过调控alpha频段脑节律而改变皮层的兴奋状态。本研究结果表明,不同ITI rTMS对脑活动调控的神经生理机制可能也存在不同。
已有大量文献报道,高频rTMS刺激初级运动皮层可以提高脑卒中和帕金森等患者患侧肢体的运动功能,而脑卒中后大脑神经活动的功率谱密度发生了显著变化[22-23]。本研究的结果表明,高频rTMS可以调控大脑神经活动的功率谱密度,进一步表明不同ITI rTMS对脑神经活动影响并不相同。而临床报道显示,rTMS的作用效果存在很大的差异性,因此推测已有研究中采用不同的ITI可能是其效果产生差异的重要原因之一,提示在实施rTMS前,不仅需要考虑刺激频率、刺激强度的选择,也应该关注ITI的选择。
高频rTMS刺激初级运动皮层常用于脑卒中后的运动康复,其应用的神经生理基础是rTMS可以纠正两个半球失衡的兴奋性,从而提高肢体运动功能[24-25]。但是本研究发现,所有ITI的10 Hz rTMS范式均没有改变各频段EEG功率谱密度左右半球功率谱密度的偏侧指数,这似乎与文献报道及研究预期不符。由于脑卒中患者运动皮层受损,患侧半球运动皮层兴奋性降低,健侧半球运动皮层兴奋性增加[26]。rTMS刺激脑卒中患者可调控两个脑半球神经活动趋向于正常,使两个半球神经活动向相反方向变化,使偏侧性指数变化[27]。而rTMS在以健康人为研究对象的研究中却发现,rTMS对双侧脑活动的调控作用并不一定向相反方向变化。低强度(<90% RMT)的低频rTMS不仅降低了刺激侧运动皮层兴奋性,而且也降低了刺激对侧运动皮层兴奋性[21];高强度的低频rTMS则使双侧运动区兴奋性向相反方向变化。Gorsler等[28]使用5 Hz rTMS (90% RMT)刺激初级运动皮层,使两个半球运动皮层兴奋性均得到增加。本研究的结果与此一致,即所有ITI 10 Hz rTMS模式均没有改变两半球运动区功率谱密度的偏侧性。这说明,对于健康人和患者,rTMS对大脑的作用方式并不完全相同,rTMS对两个脑半球偏侧性的影响依赖于刺激前大脑的活动状态(患者的脑活动状态与健康人的脑活动状态显著不同)。进一步说明,不同ITI 高频rTMS刺激初级运动皮层对患者两个半球偏侧性的影响,仍需要募集患者做进一步研究。
4 结论
本课题探讨了不同ITI高频rTMS刺激初级运动皮层对功率谱密度及其偏侧性的影响。研究发现,不同ITI 10 Hz rTMS诱发的功率谱密度变化不同;rTMS对健康人和患者脑活动影响不同,提示在应用高频rTMS时,ITI是一个需要考虑的重要参数,且对于不同实施对象,rTMS的作用不相同。本研究加深了对rTMS作用的理解,在其应用于脑科学实验研究及疾病治疗的临床研究时,rTMS参数的设置提供了前期的实验数据。

