静息态脑电在意识诊断中的临床应用
王 勇 梁振虎 夏小雨 白 洋 杨 艺 刘养凤 何江弘 李小俚
1(燕山大学电气工程学院,智能康复及神经调控河北省重点实验室, 河北 秦皇岛 066004)2(中国人民解放军总医院第七医学中心神经外科, 北京 100700)3(杭州师范大学医学院基础医学系, 杭州 311121)4(中国人民解放军空军第九八六医院神经内科, 西安 710000)5(北京师范大学认知神经科学与学习国家重点实验室, 北京 100875)
引言
2005年,美国Science杂志发表文章,将意识研究列为本世纪最具挑战的科学问题之一。意识是什么,如何产生又如何消失,始终是人类探索的难题。科学家将意识定义为个体对自我以及环境的认识和客观评价,并从两个维度表征意识,即觉醒和觉知[1]。意识产生机制理论主要为Tononi和Dehaene提出信息集成理论和全局工作理论。基于以上理论,人们从生理(睡眠)、药理(麻醉)和病理(癫痫和意识障碍)3个角度研究意识问题。意识障碍的研究为人们理解意识降低甚至消失提供了思路,研究皮层电活动、代谢活动和脑血流解释意识丧失和脑活动降低的关系,研究皮层-皮层下脑组织-丘脑回路解释意识丧失机制。根据意识保留程度,意识障碍分为植物状态(vegetable state, VS)和微意识状态(minimally consciousness state, MCS)。其中,VS患者大部分恢复睡眠觉醒周期,但是意识水平几乎为零。MCS患者不仅存在睡眠觉醒周期,而且意识水平高于VS患者[2]。准确区分VS和MCS患者是临床面临的重要问题,不仅影响制定治疗方案,而且影响患者的最终康复结果。临床行为评估是目前临床意识诊断的 “金标准”,昏迷恢复量表修订版(Coma Recovery Scale-Revised,CRS-R)是意识障碍领域常用的行为量表[3-4]。CRS-R从听觉、运动、口部运动、交流和觉醒方面等23项行为评估患者的意识水平行为,其中11项与MCS有关,若患者具备其中一项行为则可判定为MCS。通常,VS患者的CRS-R评分在0~7之间,MCS的评分至少为8分。CRS-R量表是一种刺激-反馈式的评估方法,常受限于测试人员的临床经验和患者的主观配合程度,鉴于患者状态的波动性,多次行为评估保证得到客观准确的结果。近些年,脑成像技术可以直接评估脑功能,从而准确诊断意识水平,为意识研究和临床实践提供了强有力的支持,比如脑电(electroencephalogram, EEG)、功能核磁共振(functional magnetic resonance imaging, fMRI)、近红外光谱(near infrared spectroscopy, NIRS)[5-7]。EEG得益于其便携性、高时间分辨率、高兼容性以及易操作性,在意识研究和临床实践中受到青睐。基于时频域提取EEG特征,已经用于表征大脑的不同意识状态。脑电双频指数监控(bispectral index, BIS) 能够量化麻醉中的意识水平,然而其相关的算法细节并没有公开[8],影响了该项技术在临床的改进与使用。探索其他EEG特征,不仅可从不同角度解读意识障碍的脑状态,而且有利于拓展EEG在临床意识诊断的应用。已有研究比较了排序熵和BIS检测麻醉深度的能力,认为排序熵能够稳定量化麻醉中的意识水平,并建议基于排序熵开发麻醉监控仪器[9]。Denis 等报道了基于EEG特征的意识分类模型,其中选取了功率谱、信息熵、脑连接和诱发电位作为训练特征。研究证实了EEG可以作为可靠、经济的意识辅助诊断工具[10],讨论了EEG设备通道数对意识诊断精度的影响,没有报道特定脑区单通道EEG的相关结果。单通道EEG不仅极大提高了临床应用的便携性,而且有利于验证意识产生紧密相关的局部脑区。
因此,本研究利用BIS获取静息态EEG数据,通过提取EEG复杂度特征和不同频段脑节律特征,描述意识障碍的脑活动,比较MCS和VS组间EEG特征的统计学差异;利用皮尔斯相关系数,建立临床评分和EEG特征的量化关系,选取意识显著相关的EEG特征,并构建基于决策树的意识分类模型,验证模型的意识诊断能力。本研究旨在探索稳定表征意识水平的EEG指标,并发掘在临床意识障碍辅助诊断的潜力。
1 数据采集
本研究入组50名患者(25名VS,25名MCS;男34名,女16名;年龄20~60岁),具体患者信息如表1所示。

表1 患者信息Tab.1 Patient information
患者均病情稳定,前额叶保存完好,无金属植入物,无癫痫史,近期没有使用镇静药类药物。一名经验丰富的临床医生根据CRS-R表征通过多次评估得出患者意识状态,本研究数据采集的相关事宜均告知患者家属并签署知情同意书,本研究得到中国人民解放军第七医学中心伦理委员会的支持。
本研究使用美国Covidien公司的VISTA型号BIS仪器,由BIS检测器、BISX放大器和BIS传感器组成。BIS传感器为一次性材料,包括4个银-氯化银电极,周围附着凝胶能够粘连在被试皮肤上。采集前用酒精擦洗患者额叶,待皮肤干燥后贴上BIS电极片,其中1号和3号电极分别贴于前额中线和太阳穴位置,按压电极保证接触良好,整个采集过程阻抗低于5 kΩ。采集开始后,BIS仪器获取前额叶的脑电数据并处理,采样率为128 Hz,每5 s的EEG数据得到一个BIS值(范围0~100)。在采集过程中,信号质量指数(signal quality index, SQI)高于50%才能得到BIS值。本研究收集患者30 min的BIS数据,且保证信号质量指数高于80%。
2 计算方法
提取原始EEG数据进行预处理:首先,目视去除存在大伪迹的数据段,带通滤波设置为1~45 Hz,两通道EEG数据平均;其次,数据分段处理,每段10 s,50%的交叠率,再次,计算每个数据段相对功率、排序熵、近似熵和排序Lempel-Ziv 复杂度;最后,计算平均值作为患者EEG特征值。
2.1 相对功率
将脑电信号数据段进行Welch功率谱估计,然后叠加平均所有数据段的功率谱,计算5个频段delta (1~4 Hz)、theta (4~8 Hz)、alpha (8~13 Hz)、beta (13~30 Hz)、gamma (30~45 Hz)的总功率,最后将各个频段与总频段的比值作为该频段的相对功率,计算公式如下:
(1)
式中,power(f1,f2)表示频率f1和f2间的总能量,power(1,45)表示1~45 Hz的总能量。
2.2 排序熵
排序熵(permutation entropy, PE)用于描述时间序列的规律性,从而表征其复杂度[11]。排序熵描述的脑电复杂度与意识水平高度相关,即清醒状态下脑活动的排序熵较高,而意识水平降低会引起脑活动排序熵值减小。排序熵算法结合符号动力学和信息熵,首先对时间序列信号进行符号化处理得到符号序列,每个符号表示时间序列的排序关系,然后根据符号概率计算信息熵。其中,信号符号化需要进行相空间重构,嵌入维度m和时间延迟t是相空间重构的重要参数。根据Bandt提供的参考公式,m!≪Tf,T为数据短长度,f为采样频率[11]。同时,参考现有的研究结果,本研究m取6,t取1[12]。计算公式如下:
(2)
式中,pj表示排列方式j的概率。
2.3 近似熵
Pincus基于Kolmogorov熵理论提出近似熵(approximate entropy, ApEn),用于分析有限时间序列的规律性和不可预测性。首先,将时间序列通过相空间重构生成时间向量;然后,计算向量间距离为r的概率;其后,基于概率值计算信息熵。最后,将近似熵定义为两个不同相空间信息熵的差值,反映时间序列中新信息出现的概率,越复杂的时间序列对应的近似熵越大[13]。近似熵的计算公式如下:
ApEn(M,R)=Øm(r)-Øm+1(r)
(3)
式中,Øm(r)表示EEG数据相空间长度为m的信息熵,r表示两个时间向量的参考距离。
根据文献结果[12],m取3,r取0.2SD。
2.4 排序Lempel-Ziv 复杂度
Lempel-Ziv 复杂度是由Lempel和Ziv两位学者最先提出,该算法不仅考虑时间序列出现的新模式,而且计算了其出现的速率。排序Lempel-Ziv 复杂度(permutation Lempel-Ziv complexity, PLZC)是一种结合排序熵和Lempel-Ziv 复杂度的改进算法,已经用于麻醉数据分析[13],计算公式如下:
(4)
2.5 统计分析
采用studentt检验,比较两个平均数的差异是否显著,用于小样本数据比较(n<30)。本研究使用双样本的t检验,比较两组患者EEG特征差异性。采用皮尔森相关性分析,计算EEG特征均值和临床评分的相关程度,研究EEG特征量化意识水平的能力。
2.6 模型构建
决策树是一种常用的监管学习分类方法,特点是符合人的思维习惯,模型更容易理解[14]。决策树的构建通常包括:首先,构建根节点,递归地选择最优特征;然后,根据最优特征对训练数据进行分割,得到各个子数据集的最好分类;最后,将这些子集分配到页节点,形成决策树。为了防止过度复杂的决策树使结果过拟合,对决策树进行剪枝,近年决策树已经成功应用于临床医学和生物信息学研究[15]。
拟选取单个和多个脑电特征作为样本输入参数,选取临床CRS-R诊断作为样本实际分类结果,通过学习脑电特征和临床分类结果训练决策树模型,最终验证模型性能。决策树节点分裂标准通过基尼指数确定,最大分裂数为100。利用5折交叉验证法计算模型的预测能力,即样本分为5份,选取其中1份作为验证集,另外4份作为训练集。采用混淆矩阵中的3个指标来表示模型性能,分别是:真正性率(true positive rate,TPR),代表正确识别的正例数据在实际正例数据中的百分比;准确性(accuracy,ACC),表示正确分类的比例;假正性率(false positive rate,FPR),表示错误识别的正例数据在实际负例数据中的百分比。3个指标的计算公式如下:
(5)
(6)
(7)
式中:真阳性(true positive, TP)指分类模型正确分类的正例数据,如VS准确的预测为VS;真阴性(true negative, TN)指正确分类的负例数据,如MCS正确的识别为MCS;假阳性(false positive, FP)为被错误地识别为正例数据的负例数据,如MCS错误地被预测成VS;假阴性(false negative, FN)为被错误地识别为负例数据的正例数据,如VS错误地被预测成MCS。
然后,根据TPR和FPR绘制接受者操作曲线(receiver operating characteristic,ROC),用于表示分类模型的性能,计算曲线下面积(the area under the curve, AUC)。
3 结果
图1展示两名患者的EEG数据。VS患者的EEG幅值几乎都低于30 μV,BIS值为60左右;时频分析发现,该患者的脑电能量主要集中在1~10 Hz。MCS患者EEG活动比较复杂,EEG幅值为100 μV左右,且出现较多的波动;BIS值在80左右,时频结果表现出丰富的高频信息(15~45 Hz)。

图1 意识障碍患者脑电特征(每列上中下分别为原始EEG、BIS值和时频谱)。(a)VS患者;(b) MCS患者Fig.1 EEG characteristics of patients with DOC (The upper, middle and lower rows of each column are original EEG, BIS value and time-frequency spectrum,respectively). (a) VS patient; (b) MCS patient
图2展示MCS和VS组EEG特征。(a)为所有患者BIS值,VS患者BIS值均低于80,MCS患者大多数高于80;(b)为MCS组和VS组PE平均值和整体范围,MCS组的平均值明显高于VS组的值;(c)为两组患者的PLZC, MCS组的平均值比VS组的值高;(d)表示两组患者的ApEn平均值差异很小;(e) 两组患者的功率谱显示,MCS患者的16~45 Hz能量平均值高于VS组的值。
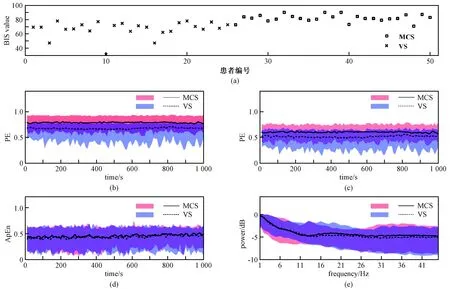
图2 意识患者组脑电特征。(a) BIS;(b) PE; (c) PLZC; (d) ApEn; (e) 功率谱Fig.2 EEG characteristics of patients with disorder of consciousness in group. (a) BIS; (b) PE;(c) PLZC;(d) ApEn;(e) Power spectrum
图3展示两组患者不同EEG特征组间差异的比较结果,包括不同EEG特征,不同组的平均值和标准差线。t检验结果显示,两组患者的BIS、PE、PLZC 和delta、gamma频段的相对能量差异显著,其中BIS、PE、PLZC和gamma相对能量差异统计结果为P<0.001, delta 相对能量差异性为P<0.05。

图3 脑电特征组间差异比较(*表示P<0.05,**表示P<0.01)Fig.3 Comparison of EEG characteristics between groups(*presents P<0.05,**presents P<0.01)
图4展示脑电特征和临床评分CRS-R的皮尔森相关性结果,其中PE与意识水平的相关性最高(r=0.81),PLZC(r=0.76), BIS(r=0.63) 和gamma相对能量(r=0.72)与临床评分的相关程度依次降低。ApEn和alpha、beta相对能量与临床评分没有显著相关性。
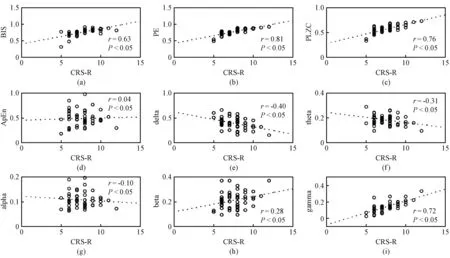
图4 脑电特征与CRS-R的相关性。(a) BIS;(b) PE; (c) PLZC; (d) ApEn; (e) Delta; (f) Theta; (g) Alpha; (h) Beta; (i) GammaFig.4 The relationship between EEG characteristics and CRS-R. (a) BIS;(b) PE; (c) PLZC; (d) ApEn; (e) Delta; (f) Theta; (g) Alpha; (h) Beta; (i) Gamma
基于以上结果,选取组间显著差异(P<0.01)的EEG特征(即BIS、PE、PLZC和gamma相对能量的平均值)构建机器学习模型。如图5所示,PE分类性能最高(AUC=0.931),PE & gamma和PE & PLZC & gamma与BIS的模型性能接近(AUC=0.905)。表2展示不同EEG特征模型的分类准确度,结果显示PE训练得到意识分类模型的准确度最高(ACC=0.92), PE & PLZC & gamma与BIS相等(ACC=0.90)。
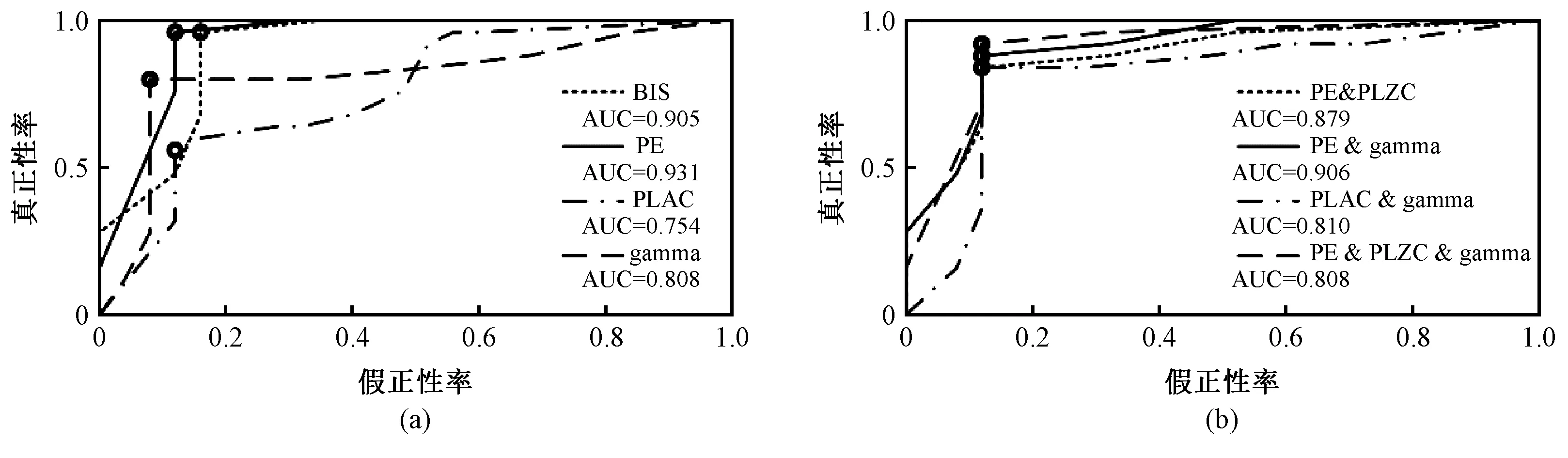
图5 基于EEG特征的决策树ROC曲线。(a)单一EEG特征;(b)多EEG特征Fig.5 ROC curve of decision tree based on EEG characteristics. (a)Single EEG characteristic; (b) Several EEG characteristics

表2 不同特征模型的分类准确度Tab.2 The classification accuracy of different models
4 讨论
本研究通过探索能够稳定表征意识水平的静息态脑电特征,发掘其辅助意识障碍临床诊断的潜力,结果显示PE、PLZC、delta和gamma相对能量在 MCS 和VS存在明显的组间差异。皮尔森相关性分析发现,量化脑电与意识水平存在很高的相关性,其中PE 与意识水平的相关性最高(r=0.81)。基于静息态EEG特征构建的机器学习模型能够区分MCS和VS患者,PE构建的意识分类模型的性能和准确度(AUC=0.931, ACC=0.92)要优于BIS构建的分类模型的相应系数(AUC=0.905, ACC=0.90)。
脑电是神经科学研究和临床工作的重要工具,主要包括两种形式——静息态和诱发态[7]。诱发态脑电常用于评估特定的神经传导通路以及相关的神经认知功能[16-17]。这种方式需要患者保存相关的神经传导通路,所以对存在一定程度功能丧失的意识障碍患者可能不适用[18]。静息态脑电操作简单,分析方法丰富,更适合用于意识障碍的诊断评估,因此选取准确稳定描述大脑状态的EEG特征是意识科学研究的重点。
频段能量研究的结果发现,VS组的delta频段能量较高,而MCS组的beta、gamma频段能量较高。该结果验证了已有的研究发现,即MCS具有复杂的高频脑节律活动,而VS的脑活动以delta频段为主[19]。研究发现,个体意识水平降低后,大脑表现出更多的低频振荡,比如深度睡眠和深度麻醉[20-21]。类似地,严重脑损伤后VS的脑代谢活动降低,同时出现低频震荡为主的背景活动[22],甚至出现脑电“静默”。MCS患者不仅脑代谢活动比VS患者的旺盛,而且皮层活动更丰富,比如gamma震荡电活动。中央丘脑作为意识枢纽,通过丘脑-皮层回路驱动皮层高频活动[23],额叶是意识活动的关键皮层[24]。额叶的gamma频段震荡与大脑认知功能相关,比如工作记忆、注意力等。MCS组比VS组高频能量高,暗示MCS保留皮层及皮层下组织结构的功能,而皮层-皮层下结构-丘脑回路是意识的重要神经回路,故MCS具有较高的意识水平[25]。相关性结果验证了gamma频段相对能量与意识水平的关系。
本研究EEG复杂度的结果发现,MCS的PE和PLZC明显高于VS组的参数值。已有研究也报道了类似的结果,认为随着意识水平降低,脑电活动会趋向更规律和更易预测(即复杂度降低),因此说明MCS的EEG复杂度较高[26-27]。麻醉研究发现,PE、PLZC和ApEn随意识水平的变化而变化[13,28-29]。然而,本研究发现,PE和PLZC更适合不同意识状态的判定。此外,PE和PLZC均应用符号动力学思想,PLZC根据新模式的个数和速度描述数据的复杂度,而PE根据分析符号模式的预测性描述数据的复杂度。个体意识的降低表现为大脑活动变慢、趋向规律化,故测量大脑活动的规律性和复杂性更适合描述大脑意识状态的变化,而符号化处理降低了数据噪声的影响。ApEn 通过信号振幅的变化描述信号复杂度,该方法依赖于数据的振幅信息和数据长度,更容易受到噪声伪迹的影响,结果稳定性差。因此,数据模式化的PLZC和PE在实际数据处理的应用性更强。
构建意识分类模型自动诊断意识状态,是近些年意识障碍研究的热点。Sitt团队利用SVM训练不同EEG特征,用于区分VS和MCS;基于功率谱能量、EEG复杂度(PE)和脑连接性的分类模型,能够稳定区分不同意识状态[26]。Chennu改进SVM算法并训练意识分类模型,通过交叉验证计算模型的分类性能,表明交叉验证适用于小样本数据的模型训练[30]。Denis基于28种EEG特征构建极端树分类模型,能够稳定地区分VS和MCS患者,研究利用不同脑电设备采集的数据验证模型的稳定性[10]。本研究借鉴已有的研究结果,并进一步探索额叶EEG特征的意识分类效果,相对功率(gamma)和EEG复杂度(PE, PLZC)均具有较高的区分能力。本研究结果与已有结果相比,多种EEG特征融合的机器学习模型分类性能低于单特征的相应性能。一方面,由于本研究只考虑额叶的脑活动,单特征更适合表征局部脑区的意识相关活动;另一方面,受限于样本小,且没有利用其他EEG设备数据进行验证。
本研究PE、PLZC和gamma谱能量均能显著区分MCS和VS,而且以上EEG特征与意识水平的相关性高于BIS的相关性。基于PE和PE & PLZC & gamma的分类模型性能高于或者等于BIS的相关性能。BIS监测仪常用于麻醉中意识水平监测,提取EEG信号在时间、频率维度的相关信息并整合时频域信息,从而监测麻醉中意识水平变化,被认为是麻醉深度监测的金标准。研究发现,BIS值也可用于意识障碍患者的诊断[31]。但是,BIS监测仪作为商业系统,并不开源其算法。 此外,BIS提供的EEG指标存在一定的缺陷。一方面,BIS的时域特征包括爆发抑制率和QUAZI,用于描述脑活动的抑制程度,但是单纯的幅值信息不能解释脑活动的动力学特质;另一方面,BIS通过β比率描述高低频段脑活动频域能量的变化,对高频频段的划分过于宽泛(30~40 Hz),可能忽略了α频段信息与意识活动的关系,而研究证实意识障碍的恢复跟α节律活动有关。此外,BIS没有公开其非线性计算方法,而非线性方法的选择会影响脑状态的分析结果;已有学者讨论了意识研究的非线性方法选择和参数配置,证实不同方法在研究意识活动中的优劣势,为今后EEG分析方法的研究提供了参考[12]。综上所述,探索合适稳定的EEG指标量化意识水平,有助于解释意识产生的潜在机制,而且有利于现有意识检测设备升级和算法优化。
5 结论
本研究探索描述意识水平的脑电特征,发现PE、PLZC、gamma相对能量能够区分不同意识状态的患者,而基于静息态EEG特征构建的机器学习模型能够用于意识障碍患者的意识诊断。
(致谢:感谢中国人民解放军总医院第七医学中心昏迷与脑病调控中心对本研究的支持,感谢陈雪玲帮助招募患者、收集临床资料)

