米糠蛋白糖基化与非酶褐变机理的研究
陶 醉 徐 丽 谢 岚 全 珂 易翠平
(长沙理工大学化学与食品工程学院,长沙 410114)
米糠蛋白(Rice bran protein,RBP)作为一种优质植物蛋白,其开发利用对于我国农产品的增值与转型具有重大价值[1-3],但褐变一直是影响RBP大规模生产利用的技术瓶颈[4,5]。褐变产生的原因有酶促褐变和非酶促褐变,其中糖基化反应是一种氨基化合物与羰基化合物之间发生的非酶褐变反应[6],也称为美拉德反应[7],可作为鉴定蛋白褐变的特征反应。王慧等[4]系统地研究了RBP的酶促褐变及非酶褐变现象,并筛选出还原糖引起非酶褐变的抑制剂,而关于还原糖导致RBP非酶促褐变原因尚不明确。王艳玲[8]对RBP 4种分级蛋白的物化和功能特性进行比较,发现分级蛋白之间的亚基分布情况存在差异,对4种分级蛋白的功能特性如溶解性等具有一定的影响,说明分级蛋白的结构与组成决定RBP的基本性质。近年来,关于分级蛋白的研究主要集中于提取与分析其组成上[8,9]以及功能特性和应用情况[10],而对于分级蛋白的颜色变化、基本信息及糖类的结合情况鲜有报道。
本研究拟通过观察RBP及其分级蛋白的颜色变化情况,深入研究其糖基化现象的存在及结构基础,以明确其与RBP非酶褐变的关系以及非酶褐变的产生机理,对于将来抑制RBP褐变的产生、扩大其应用范围提供参考。
1 材料与方法
1.1 主要材料与试剂
脱脂米糠:蛋白质14.68%、脂肪0.61%、灰分9.51%、水分13.57%,甘氨酸、N,N-亚甲基丙烯酰胺、十二烷基磺酸钠、丙三醇、2-巯基乙醇、考马斯亮蓝G250、甲基红、碳酸钠等试剂均为分析纯。
1.2 主要仪器与设备
超声波微波组合反应系统,DYCZ电泳仪,D25LT色彩色差仪,UV-2800分光光度计,5418R高速冷冻离心机,Savant DNA120离心浓缩仪,Triple TOF 5600 LC-MS质谱仪,FT-IR傅里叶红外光谱仪。
1.3 实验方法
1.3.1 RBP及其分级蛋白的样品制备
采用超声辅助碱法[11-17]提取RBP。取脱脂米糠,加入蒸馏水使其分散均匀,调节固液比为1∶10。用少量NaOH调节pH并保持为9,超声功率设置为120 W,料液比1∶9,超声作用30 min,50 ℃水浴加热2 h,4 000 r/min离心,收集上清液并调节pH至4,再次离心,沉淀经去离子水反复洗涤,干燥后得到RBP。将RBP分别在冷冻干燥机与鼓风干燥箱中干燥,选择在50、60、70、80、90 ℃温度梯度下烘干,粉碎后4 ℃冷藏备用。
根据Osborne连续提取法[18]提取RBP分级蛋白。取10 g脱脂米糠,加入100 mL水,常温下搅拌提取后3 500 r/min离心收集上清液,重复以上步骤3次,汇集上清液置于去离子水中透析后冷冻干燥获得水溶性蛋白;残渣加入100 mL 5% NaCl溶液,搅拌后离心,重复处理3次后汇集上清液经透析后冷冻干燥得到盐溶性蛋白组分;沉淀采用70%乙醇溶液溶解提取3次,汇集上清液置于去离子水中透析后冷冻干燥获得醇溶蛋白组分;残渣以0.1 mol/L NaOH溶解搅拌,依次经离心、透析、冷冻干燥处理即得碱溶性蛋白。提取后于4 ℃下冷冻干燥贮存待用。
1.3.2 RBP及其分级蛋白的色度测定
将RBP样品放置于研钵中仔细研磨至均匀粉末。
为排除米糠本身所带的色泽对分级蛋白色泽的影响,另取10 g脱脂米糠分级提取时经活性炭脱色,取滤液透析干燥处理后得到蛋白粉末。将分级提取中加入活性炭脱色后的蛋白与直接进行分级提取的蛋白对照。
色度均采用D25LT测色色差仪进行测定,待L*、a*、b*值稳定后,记录数据,重复5次。
1.3.3 RBP分级蛋白的糖基化分析1.3.3.1 傅里叶红外光谱分析
参考吴伟等[19]的方法,分别称取2 mg RBP及分级蛋白样品,与200 mg KBr混合,研磨均匀后制作透明薄片。在傅里叶红外光谱仪上记录样品在400~4 000 cm-1范围内的傅里叶光谱。室温干燥环境下进行扫描,每个样品扫描32次[19,20]。
1.3.3.2 分级蛋白糖基化电泳分析[21]
分级蛋白样品经前处理后,参照Laemmli等[22,23]的方法,在不连续缓冲体系中,选择12%的分离胶,4%的浓缩胶,胶版厚度为1 mm,进样量为15 μL,过程中保持电流强度为20 mA,电泳至样品条带距胶版底部1 cm左右时停止,时间约2~4 h。G250染色约2 h后,反复脱色至条带清晰,得到聚丙烯酰胺电泳后的胶条。而后参照Cerri等[24]的方法进行糖蛋白的染色。胶条的氧化在过碘酸溶液中进行,室温浸泡过夜。移取10 mL冰醋酸溶液溶解称取的1 g三氯醋酸,双蒸水定容至100 mL,漂洗上述氧化的胶条。漂洗过后采用Shiff试剂置于暗处染色,定容至500 mL的棕色容量瓶中4 ℃储存16 h,加入10 g活性炭后置于振荡器上脱色、过滤至无色溶液。将溶液储存于棕色试剂瓶中4 ℃保藏待用。染色后在5%醋酸溶液中脱色至无背景色仅残余红色区域时,扫描留存。
1.3.3.3 分级蛋白的LC-MS/MS鉴定
切下经聚丙烯酰胺电泳后得到的蛋白亚基条带,蒸馏水多次冲洗除去胶上杂物。胶条加入150 μL脱色液脱色,水洗4次,依次采用300 μL 25 mmol/L碳酸、50%乙腈及100%乙腈2次洗涤,至胶块变白。胶块中加入10 μL DTT(10 mmol/L)后水浴还原,冷却至室温后等体积加入IAA(50 mmol/L)避光烷基化,按照上述洗涤过程洗至胶块变白。然后采用15 μL蛋白质组学级胰蛋白酶(0.01 μg/μL)酶解处理,于冰上吸涨至透明,并覆盖上30~40 μL溶液(溶液为含10% CAN的50 mmol/L NH4CO3)。处理后在37 ℃水浴条件下消化过夜。充分酶解后取上清液并对剩下的胶块重新萃取(萃取液为含2%甲酸的67%乙腈溶液),萃取后依次进行30 min 37 ℃保温处理、15 min超声处理后取其上清与酶解后的上清液合并。上清液浓缩干燥后待用[25]。
将上述处理后的样品在Nano-LC流动相A(0.1%甲酸,2%乙腈/水)中溶解,以4 μL/min的流速上样至ChromXP C18预柱上,并在此流速下冲洗脱盐,在线LC-MS/MS分析。LC-MS/MS过程参数设置为:
液相:Ekspert nanoLC 415纳升液相系统(SCIEX, Concord, ON);样品在预柱脱盐保留后经分析柱分离,分析柱的选择为C18反相色谱柱,实验过程中的参数设定参考陈兰煊等[23]的方法进行操作。
LC-MS/MS鉴定结果采用Maxquant软件处理,数据库为Uniprot下的oryza sativa japonica物种蛋白数据库。
1.4 数据处理
采用Excel 2007分析并绘图,运用SPSS进行数据差异显著性分析。最终呈现的结果为其平均值±标准偏差。
2 结果分析
2.1 不同温度处理对RBP及其分级蛋白颜色的影响
图1是不同温度下RBP的颜色变化。L*表示所测物体表面的明亮度,值大小与明亮度正相关;a*表示所测物体表面的红绿值,+方向红色增加,-方向表示绿色增加;b*表示所测物体表面的蓝黄值,+方向黄色增加,-方向表示蓝色增加。结果表明,相比冷冻干燥下得到的蛋白颜色,烘干条件下得到的蛋白颜色更深:随着温度的上升,蛋白的明亮度下降,红褐度和黄褐度上升,褐变程度加深。

图1 不同干燥温度下的蛋白色度分析图
RBP分级蛋白的色度测定结果见图2。清蛋白与谷蛋白明亮度较低,显著比球蛋白与醇溶蛋白的颜色深(P<0.05)。为避免色素对蛋白颜色的影响,采用活性炭对分级蛋白进行了脱色处理,脱色后4种分级蛋白红褐色与黄色程度均有显著下降,但清蛋白与谷蛋白的色泽仍显著深于球蛋白与醇溶蛋白(P<0.05),说明色素以外分级蛋白自身可能产生了颜色变化。
蛋白质的颜色变化可能由多酚氧化酶导致酶促褐变,美拉德反应、焦糖化作用、抗坏血酸氧化、多元酚氧化缩合导致非酶促褐变等原因产生。在室温或室温以下,酶促反应速率比非酶反应快[26],但在室温以上,随着温度的升高,酶逐渐失活使得酶促褐变失去作用,且此时的干燥温度未达到焦糖化反应的反应温度(135 ℃以上),抗坏血酸氧化往往在人体内和果蔬发酵的过程中存在。蛋白在冷冻干燥条件下美拉德反应受到抑制颜色较浅,随着温度的升高反应剧烈褐变程度随之变深。因此促进褐变程度的加深的重要原因极可能是蛋白质和还原糖产生非酶促褐变的美拉德反应[27]。结合蛋白色泽随温度的变化趋势,可通过进一步分析分级蛋白结构与组成探究糖基化引发非酶褐变的可能机理。
2.2 RBP分级蛋白的糖基化分析
2.2.1 RBP及其分级蛋白糖基化存在性分析
图3是RBP及其分级蛋白样品在400~4 000 cm-1范围内的FT-IR光谱图。结果表明,RBP及其分级蛋白在1 600~1 700 cm-1和1 500~1 600 cm-1之间存在蛋白质的特征峰;在3 000~2 800 cm-1及1 400 cm-1存在糖类的特征吸收峰;在3 100~3 300 cm-1及1 156 cm-1附近存在糖基化反应发生的特征峰。可以推断分级蛋白中存在糖基化反应。
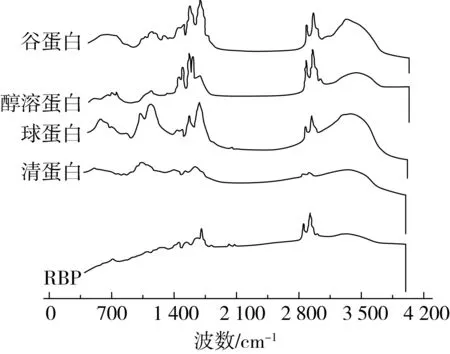
图3 RBP及其分级蛋白的FT-IR光谱
2.2.2 RBP分级蛋白糖基化结构的确定与信息分析
2.2.2.1 PAS分级蛋白糖基化结构位置的确定
PAS染色的原理为糖蛋白糖链上2个相邻的羟基被氧化剂氧化为醛基,醛基可与被处理后的碱性品红生成不溶性的紫红色物质,可通过紫红色物质是否生成判断样品中糖蛋白的存在。图4是RBP分级蛋白的考马斯亮蓝电泳图谱。通过将PAS染色结果与考马斯亮蓝电泳图谱对比发现,分级蛋白的小分子区域处出现低分子质量的红色条带,4种分级蛋白均在10.77 ku附近出现红色条带,即为分级蛋白中的糖蛋白。
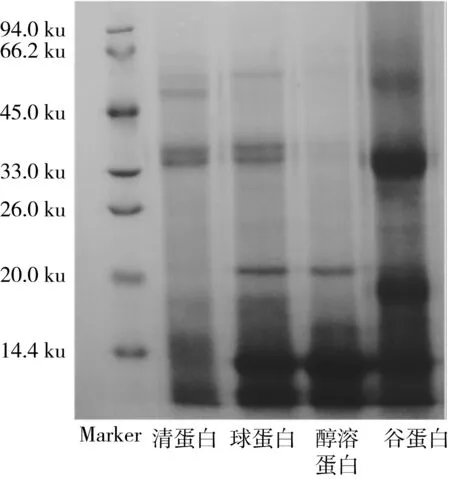
图4 RBP分级蛋白的考马斯亮蓝电泳图谱
2.2.2.2 RBP分级蛋白组成的LC-MS/MS鉴定
对电泳分离以及具有糖基化修饰的4种分级蛋白的10.77 ku条带通过LC-MS/MS法鉴定,主要结果见表1。4种分级蛋白均含有与蛋白生理活动相关的酶类,组成存在一定差异,且均具有糖基化修饰的蛋白。其中球蛋白中具有糖类修饰的蛋白片段为63 ku球蛋白,醇溶蛋白则为Os05g0331800蛋白、Os05g0328800蛋白及Os05g0328632蛋白。这些蛋白的修饰糖类包括岩藻糖、己糖和庚糖。RBP分级蛋白的色度测定结果显示,与球蛋白及醇溶蛋白相比,清蛋白和谷蛋白的颜色较深。进一步对蛋白褐变产生的原因进行推断,得到:清蛋白由于新型蛋白酶中糖类的存在使其颜色较深。谷蛋白含有的A2型谷蛋白、17D醇溶蛋白、Os05g0328632蛋白及Os05g0331800蛋白片段中糖类物质的修饰以及修饰糖类种类较多,且因为谷蛋白为经碱液提取所得,已知RBP在碱性条件下,易发生水解变性,增加美拉德反应,产生深棕色物质[28],这些原因都可能导致其颜色较深。

表1 分级蛋白电泳条带和糖基化修饰的LC-MS/MS鉴定的主要结果
3 结论
在50、60、70、80、90 ℃温度条件下烘干的RBP相对于冷冻干燥获取的蛋白褐变程度更深。电泳分析证实RBP分级蛋白中且PAS染色图谱中4种分级蛋白均在10.77 ku附近出现红色条带确定了糖基化修饰的存在。RBP及其分级蛋白样品在400~4 000 cm-1范围内的红外图谱中可见3 100~3 300 cm-1与115 6 cm-1存在糖基化反应特征峰。对4种分级蛋白的10.77 ku条带进行LC-MS/MS分析,4种分级蛋白均具有糖基化修饰的蛋白得出4种分级蛋白均存在糖基化现象,且与球蛋白、醇溶蛋白相比,清蛋白和谷蛋白中糖基化修饰的糖类较多,可见己糖、庚糖、岩藻糖等糖基化修饰的发生。结果表明RBP的非酶褐变与其分级蛋白中的糖基化现象相关,且根据分级蛋白之间的颜色差异推测清蛋白与谷蛋白中某些蛋白片段的糖基化现象对蛋白褐变起重要作用。未来可通过对冷冻样品进行电泳等分析并与烘干样品对比,验证RBP非酶褐变机理与糖基化现象之间更深层次的联系。

