房水IL-17、IL-23、TNF-α水平在糖尿病性视网膜病变诊断中的价值
何东林,贾明珍,谭越月,彭 洁
糖尿病性视网膜病变(diabetic retinopathy, DR)属于糖尿病常见并发症,可引起患者视力障碍,严重时可致盲。既往流行病学研究显示,全球DR患者高达9300万,且增殖期病变者约占18.28%[1-2]。DR的主要病理改变包括视网膜组织出血、渗出、新生血管形成与产生微血管瘤等,通常和氧化应激反应、晚期糖基化产物及蛋白激酶C激活等存在密切联系,但临床尚未明确其详细发病机制[3]。文献报道,糖尿病患者体内炎症反应可能参与了微血管病变过程[4]。白细胞介素-17(IL-17)属于前炎性因子,一般通过结合特异性受体,有效激活p38丝裂原活化蛋白激酶等相关炎症信号通路,促进炎症级联反应[5]。白细胞介素-23(IL-23)能够激活Th17细胞中JAK/STAT通路,从而提高IL-17表达水平,在IL-17介导的各类病理生理过程中起着重要作用[6]。肿瘤坏死因子-α(TNF-α)主要来自单核巨噬细胞,为人体炎性介质。当前,关于DR患者房水IL-17、IL-23、TNF-α水平检测的报道较少。本研究主要探讨了房水IL-17、IL-23、TNF-α表达水平对DR的诊断价值。现报告如下。
1 资料与方法
1.1临床资料 选取2019年2月—2020年10月本院收治的2型糖尿病82例(82眼)为研究对象,按早期糖尿病视网膜病变治疗研究提出的DR诊断与分级标准[7],将其分为DR组50例和非DR组(合并其他眼科疾病)32例,其中DR组按照病变程度分为增殖期DR组22例与非增殖期DR组28例。纳入标准:符合2型糖尿病与DR诊断标准[8];具有清晰意识与正常认知能力;对本研究知情并签署研究知情同意书。排除标准:由于屈光介质混浊不能完成DR评估;血压控制不佳或高血脂者;合并肝肾功能障碍、心脑血管疾病或其他眼底病变者;合并全身炎症性疾病(包括系统性红斑狼疮及风湿性关节炎等)者;合并精神类疾病者。取同期拟行白内障手术的年龄相关白内障50例(50眼)为对照组,均为单纯白内障,无其他并发症。研究符合医院伦理委员会审批要求。4组性别、年龄、患眼部位及糖尿病病程比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 4组纳入者一般资料比较
1.2方法
1.2.1房水采集:2型糖尿病患者在入院后、对照组在白内障手术前,安排同一技术人员,严格按照无菌操作规范,采用无菌注射器(配25号针头),于患眼角膜缘内1 mm部位进行前房穿刺,注意勿触及眼内组织,然后抽取房水样本0.2 ml,并放入无菌离心管,将其置于-20℃冰箱之中保存待测。
1.2.2检测方法:首先取出房水样本,溶解后将其轻弹混匀,进行离心处理(速率为5000 r/min)后取上清;采取酶联免疫吸附试验进行IL-17、IL-23及TNF-α水平测定,相关试剂盒均由美国BD公司提供,由专人严格依据试剂盒说明书完成操作过程。

2 结果
2.1DR组、非DR组与对照组房水IL-17、IL-23、TNF-α水平比较 DR组房水IL-17、IL-23、TNF-α水平明显高于非DR组与对照组,且非DR组明显高于对照组(P<0.01)。见表2。

表2 DR组、非DR组与对照组房水IL-17、IL-23、TNF-α水平比较
2.2不同分期DR患者房水IL-17、IL-23、TNF-α水平比较 增殖期DR组房水IL-17、IL-23、TNF-α水平明显高于非增殖期DR组(P<0.01)。见表3。

表3 不同分期DR患者房水IL-17、IL-23、TNF-α水平比较
2.3房水IL-17、IL-23、TNF-α对DR的诊断价值 ROC曲线分析结果显示:房水IL-17、IL-23、TNF-α及三者联合诊断DR的曲线下面积(AUC)为0.885、0.902、0.782、0.965。见表4、图1。
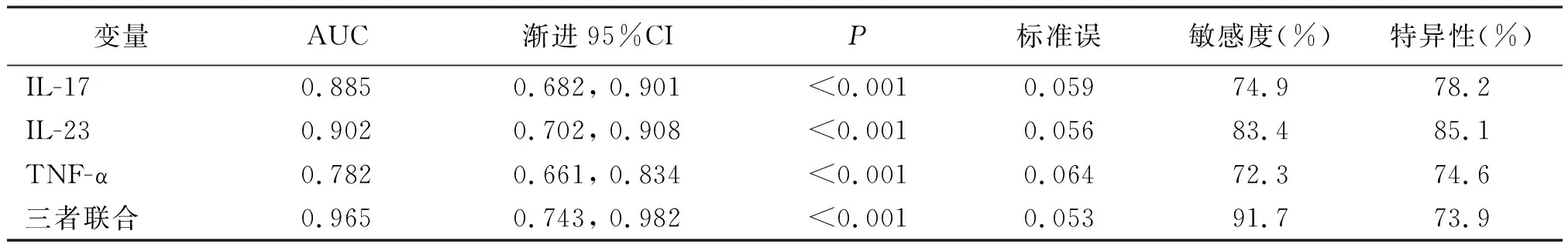
表4 IL-17、IL-23、TNF-α及三者联合诊断DR的价值比较

图1 房水IL-17、IL-23、TNF-α及三者联合诊断DR的ROC曲线
3 讨论
当前普遍认为,视网膜组织血管内皮损伤和机体慢性持续炎症紧密相关,白细胞参与DR发生与病情进展过程,因此提出DR属于炎症性疾病[9]。以往研究表明,糖尿病患者血清样本、玻璃体与房水趋化因子、相关炎性因子等表达明显上调,在DR发生、进展中起着重要作用[10-11]。
IL-17可以招募中性粒细胞,同时促进多种细胞分泌炎性因子。有报道称,IL-17能够促进趋化因子、IL-6、IL-8、TNF-α等表达,并对中性粒细胞以及其他炎性细胞大量聚集、贴壁起到刺激作用,最终引发病理损伤[12-13]。临床认为,IL-23通过结合IL-23受体,能够加快Th细胞分化为Th17,同时维持Th17细胞增殖及存活,对IL-17合成与分泌产生诱导作用,引发炎症级联反应。多项研究指出,IL-23/IL-17通路与葡萄膜炎、老年性黄斑变性以及缺血性视网膜病变患者视网膜组织病理损伤有关[14-15]。本研究结果显示,DR组房水IL-17、IL-23水平较对照组及非DR组明显升高,且非DR组明显高于对照组,与张海江等[16]研究结论一致。说明DR患者房水IL-17、IL-23呈异常升高改变,参与DR产生过程。机制可能为:体内IL-17介导视网膜组织炎症反应,使得胰岛素抵抗水平提高或胰岛细胞凋亡增加,以此直接或间接促进视网膜血管病变产生。本研究结果同时显示,增殖期DR组房水IL-17、IL-23水平较非增殖期DR组明显增高,表明DR患者房水IL-17、IL-23表达水平与其病情有关。分析原因,IL-23/IL-17通路通过提高炎性因子水平,使得视网膜组织炎症加重,导致血管内皮细胞及周细胞凋亡,减少紧密连接蛋白合成,损伤血-视网膜屏障,促使视网膜产生出血或者渗漏等现象,最终形成增殖期DR。
TNF-α属于机体炎症反应中最早产生的因子,可通过外分泌、自分泌及旁分泌方式对相应靶细胞与靶器官产生作用,其和特异性受体有效结合后,能够介导神经内分泌、生长调节、免疫调节及炎症反应等过程[17]。既往研究指出,TNF-α能促使视网膜组织血管内皮细胞产生功能紊乱现象,并且诱导其凋亡[18-19]。本研究结果显示,DR组房水TNF-α水平明显高于其余2组,且增殖期DR组房水TNF-α水平明显高于非增殖期DR组,表明房水TNF-α表达水平与DR的发生及发展具有紧密联系。分析原因,TNF-α大量分布于血管内皮细胞上,使得视网膜组织血管通透性提高,促进血管外基质形成与血管细胞增殖,从而为新生血管形成提供条件;TNF-α可以激活人体中性粒细胞及淋巴细胞,通过结合血管内皮细胞表面受体,提高细胞通透性及缩血管物质活性,同时降低扩血管物质活性,损伤内皮细胞,造成血管功能紊乱。本研究结果显示,房水IL-17、IL-23、TNF-α联合诊断DR的AUC大于各指标单独诊断AUC,联合诊断敏感度与特异度分别为91.7%、73.9%,表明房水IL-17、IL-23联合TNF-α对DR具有较高诊断价值。本研究具有样本量较少的不足,且为单中心研究,具有一定局限性,有待后续大样本、多中心研究进一步补充与完善。
综上所述,相较于2型糖尿病,DR患者房水IL-17、IL-23、TNF-α水平明显升高,且与其病情发展存在密切联系,上述指标检测可为DR临床诊断提供可靠依据,三者联合诊断效能更高。

