正北芪多糖对结肠炎小鼠的抗炎作用研究
钟 敏,李昕宇,郝佳美,任建武
(北京林业大学生物科学与技术学院,北京 100083)
炎症性肠病(Inflammatory Bowel Disease,IBD)危害性强,治疗周期长,近年来欧美国家的IBD发病率相对稳定,而我国呈快速增长趋势,预计2025年患病人数超过150万人[1]。IBD包括克罗恩病(Crohn’s Disease,CD)和溃疡性结肠炎(Ulcerative Colitis,UC),发病原因多为持续性肠道感染、肠粘膜屏障缺陷、免疫失调,也与遗传因素及环境因素有关[2−3],UC是炎症性肠病的主要亚型之一,临床症状主要表现为:腹痛、腹泻、体重减轻、黏液血便等[4]。
多糖是黄芪的主要活性成分之一,在黄芪的不同药材基源中,尤以产于我国山西省北部至内蒙古自治区中南部的正北芪多糖含量最高,疗效最佳[5],具有免疫调节、抗肿瘤、抗疲劳、抗氧化、抗病毒、保护心血管、降血糖等多种药理功效[6−8]。研究表明,黄芪多糖或者黄芪多糖与其他药物组成的复方对UC均有治疗作用。钱江等[9]研究发现黄芪与麦冬复合多糖可抑制促炎因子和刺激抗炎因子的释放,对结肠炎有一定的改善作用。Yang等[10]采用TNBS诱导大鼠溃疡性结肠炎模型,发现黄芪多糖可以通过调节TNF-α,IL-1β和NFATc4的表达,显著改善实验性大鼠结肠炎。但是黄芪多糖对UC的具体作用机制尚不明确,本研究用5%葡聚糖硫酸钠(DSS)溶液建立小鼠溃疡性结肠炎模型[11−12],分析APS对结肠炎小鼠的治疗效果,从而探究其对UC小鼠的可能作用机制,为进一步深入研究结肠炎的治疗方法提供理论参考依据。
1 材料与方法
1.1 材料与仪器
小鼠 5~6周龄SPF级雄性C57BL/6Cnc小鼠,体重(20±1.5)g,北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006;正北芪多糖(96.82%) 产自山西恒广北芪生物科技股份有限公司的正北芪,前期实验采用超声辅助-水提法提取并经除杂分离纯化后得到的纯正北芪多糖;地塞米松(98%) 上海沃凯化学试剂有限公司;葡聚糖硫酸钠(DSS,M.W.=50000) 上海源叶生物科技有限公司;SOD、MPO、NOS、MDA、NO测定试剂盒 南京建成科技有限公司;IL-6、IL-1β、D-LA、DAO、TNF-α血清细胞因子测定试剂盒 上海江莱生物科技有限公司。
新世纪T6紫外-可见分光光度计 北京普析通用仪器有限公司;XMTD-6000恒温水浴锅 金坛市荣华仪器制造有限公司;TD5A台式低速离心机 湖南赫西仪器装备有限公司;G50电动组织研磨器南京沃拓仪器设备有限公司。
1.2 实验方法
1.2.1 动物分组与干预 将50只5~6周龄,体重20.0±1.5 g的C57BL/6Cnc清洁级雄性小鼠适应性饲养1周后,随机分为5组,即空白组、模型组(DSS组)、高浓度APS组、低浓度APS组、阳性对照组,小鼠的饲养、实验和处死过程均遵照实验动物管理条例和福利伦理指南执行。根据文献[10,13]资料及预实验效果,除空白组外,其他组别自由饮用5%DSS水溶液连续7 d,建立小鼠急性溃疡性结肠炎模型,造模成功之后进行给药治疗一周,如表1。第14 d小鼠禁食16 h,但不禁水不禁药,第15 d摘采集小鼠外周血,结肠标本备检。

表1 试验小鼠分组和给药方案Table 1 Animal grouping and drug administration of experimental mice
1.2.2 指标检测
1.2.2.1 小鼠疾病活动指数(DAI)评分 实验过程中,每天观察记录小鼠的精神、体重、粪便、活动、饮食、存活等情况,并根据表2进行DAI评分[14]。

表2 DAI评分标准Table 2 DAI scoring criteria
1.2.2.2 小鼠结肠长度及病理组织学观察 取肛门至回盲部的结肠,观察记录炎症及溃疡情况,并测量长度;取部分结肠组织用10%福尔马林固定、常规石蜡包埋、连续4μm病理切片(HE染色),显微镜下观察结肠黏膜损伤情况。
1.2.2.3 小鼠血清中D-LA、DAO、IL-6、IL-1β、TNF-α含量测定 第15 d摘小鼠眼球取血置于1.5 mL离心管中,3000 r/min离心15 min后取血清于−80℃冻存备用。血清中D-LA、DAO、IL-6、IL-1β、TNFα含量测定严格按照ELISA检测试剂盒的说明操作进行。
1.2.2.4 小鼠结肠中MPO、SOD、NOS活性,以及MDA含量和NO水平检测 取小鼠结肠组织称重并剪碎,以冰生理盐水作匀浆介质,利用匀浆器冰上匀浆成10%匀浆液,根据试剂盒的要求对MPO、SOD、NOS活性,以及MDA含量和NO水平进行检测。
1.3 数据处理
采用SPSS23.0软件进行统计学分析,数据以均数±标准差(±s)表示,用Excel作相关数据处理和图表绘制。
2 结果与分析
2.1 正北芪多糖对溃疡性结肠炎小鼠DAI的影响
与空白组小鼠相比,经DSS诱导结肠炎的小鼠体重显著降低,排便频率增加,且粪便性状松散或者含水,并粘有粘液和/或血液。由图1可知,DSS组的DAI评分极显著高于空白组(P<0.01),APS组、阳性对照组的DAI评分极显著低于DSS组(P<0.01),所以APS可减轻DSS造成的溃疡性结肠炎症状,具有改善作用。
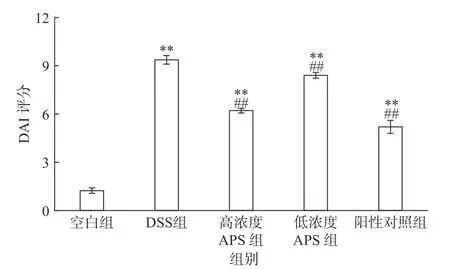
图1 溃疡性结肠炎小鼠DAI评分Fig.1 Scoreof diseaseactivity index in micewith ulcerative colitis
2.2 正北芪多糖对溃疡性结肠炎小鼠结肠长度的影响
结肠长度是评价溃疡性结肠炎的重要指标之一,本研究中空白组小鼠结肠长度最长(表3),与空白组相比,DSS组小鼠的结肠长度极显著缩短(P<0.01);与DSS组相比,高浓度APS组和阳性对照组小鼠的结肠均极显著恢复(P<0.01),而低浓度APS组无显著差异(P>0.05)。由此说明,高浓度正北芪多糖水溶液可显著恢复溃疡性结肠炎导致的小鼠结肠缩短。

表3 各组小鼠结肠长度及分析Table 3 Colon length and analysis of each group of mice
2.3 正北芪多糖对溃疡性结肠炎小鼠结肠组织病理学的影响
HE染色小鼠结肠组织病理切片,光镜下观察,如图2,空白组:结肠黏膜上皮完整,腺体连续,结构清晰,无炎症和溃疡,未见明显病理改变。DSS组:结肠有大面积的溃疡,黏膜水肿,上皮脱落,炎细胞浸润明显增多。高浓度APS组和阳性对照组:结肠恢复情况较好,溃疡面积明显缩小,组织水肿和充血显著减轻,炎细胞浸润明显减少。低浓度APS组:结肠恢复效果不明显。

图2 各组小鼠结肠组织病理切片Fig.2 Pathological section of colon tissue of each group mice
2.4 正北芪多糖对溃疡性结肠炎小鼠血清中D-LA、DAO水平的影响
D-LA和DAO水平分别是间接反应肠道黏膜通透性和上皮细胞是否完整的一项指标[15],如图3,DSS组小鼠血清中D-LA、DAO水平极显著高于空白组(P<0.01),说明小鼠溃疡性结肠炎造模成功。与DSS组相比,高浓度APS组和阳性对照组小鼠D-LA、DAO水平均显著降低(P<0.05),低浓度APS组无显著差异,藏凯宏等[16]发现黄芪多糖可剂量依赖性地降低溃疡性结肠炎模型小鼠血清中D-LA和DAO水平,本研究中高浓度APS组治疗效果明显好于低浓度APS组,与前人研究一致,即APS能修复结肠炎大鼠肠道黏膜屏障及改善肠道上皮细胞的损伤。

图3 各组小鼠血清中D-LA、DAO水平Fig.3 D-LA,DAOlevels in serum of each group mice
2.5 正北芪多糖对结肠炎小鼠血清中IL-6、IL-1β、TNF-α浓度和结肠组织中MPO的影响
当炎症性肠病发生时,结肠组织中出现大量的炎症细胞浸润[17],促炎因子的表达升高,如IL-6、TNF-α和IL-1β会大量释放[18],还有炎症因子的介质MPO,它是炎症反应的关键酶[19],可诱导中性粒细胞及巨噬细胞产生自身炎症反应,间接或直接促进炎症因子的释放,从而引起炎症细胞向炎症部位聚集,从而加重炎症病情[20−21]。由图4可以看出,DSS组小鼠的IL-6、IL-1β、TNF-α的浓度和MPO活力极显著高于空白组(P<0.01),表明炎症反应已发生。经APS和药物干预后,高浓度APS组和阳性对照组的小鼠IL-6、IL-1β、TNF-α的浓度和MPO活力显著低于DSS组(P<0.05),低浓度APS组小鼠的小鼠血清中IL-1β、TNF-α的浓度无显著差异,但IL-6极显著降低(P<0.01)。并且上述病理切片显示炎症细胞浸润明显减少,肠道黏膜有一定程度的修复,由此说明高浓度APS可以降低细胞因子IL-6、IL-1β、TNF-α的浓度和MPO活力,降低溃疡性结肠炎的炎症反应,从而达到预防溃疡性结肠炎的作用。
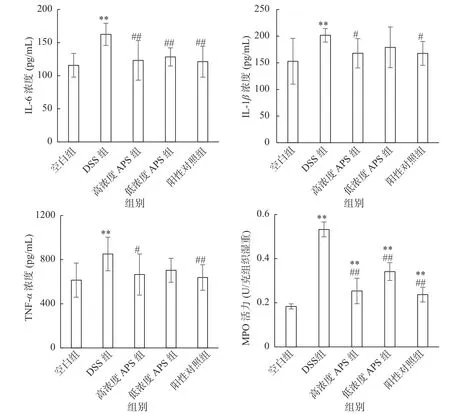
图4 各组小鼠IL-6、IL-1β、TNF-α的浓度及MPO活力Fig.4 Concentrations of IL-6,IL-1β,TNF-α and MPO activity each group mice
2.6 正北芪多糖对溃疡性结肠炎小鼠SOD、NOS活力及MDA、NO水平的影响
炎症性肠病发生时,NOS的表达增高,催化产生NO,导致NO含量增多[22]。体内过量的NO可以诱导某些炎症细胞因子如IL-8,TNF-α和IL-1β的释放[17],NO还可与SOD的底物超氧阴离子迅速结合,产生具有强氧化作用的过氧亚硝酸盐,参与炎症性肠病的发病机制[23]。由图5可以看出,DSS组小鼠结肠组织中的NOS活性、MDA含量和NO水平6极显著高于空白组(P<0.01),但SOD活性极显著降低(P<0.01);各个给药组的小鼠结肠组织中的NOS活性及MDA含量和NO水平显著低于DSS组(P<0.05),高浓度APS组和阳性对照组的SOD活性显著升高(P<0.05),低浓度APS组的SOD无显著差异,表明高浓度APS对溃疡性结肠炎有所改善,显著提高患病小鼠抗氧化能力,从而直接或间接地减轻UC的炎症反应。

图5 各组小鼠结肠组织中SOD、NOS活力及MDA、NO水平Fig.5 Activity of SOD, NOS,MDA and NOin colon tissueof each group mice
3 讨论与结论
近年来,炎症性肠病的患病率逐渐上升,UC是较为常见的炎症性肠病。临床上治疗以控制炎症,抑制自身免疫反应,改善肠道黏膜屏障功能等措施为主[24]。本研究中APS组和阳性对照组的DAI评分极显著低于模型组(P<0.01),高浓度APS组有效恢复了UC小鼠结肠长度和修复结肠组织,且从组织学的结果来看,高浓度APS水溶液与1μg·mL−1地塞米松水溶液疗效相当,对UC小鼠具有一定的治疗作用。
细胞因子在免疫调节和炎症反应中起重要作用,UC小鼠血清中的促炎细胞因子水平较高,如IL-6、IL-1β、TNF-α等[25],本研究发现经高浓度APS治疗后,IL-6、IL-1β、TNF-α含量明显减少,由此推测APS对UC的治疗作用可能是通过减少Th1细胞的细胞因子数来实现的。APS具有明显抗氧化作用,其对UC的修复作用主要通过降低组织MDA水平,提高SOD水平实现[26]。本研究进一步考察了NOS活性和NO含量,APS能极显著降低NOS活性和NO含量(P<0.01),即APS能显著提高患病小鼠结肠组织中的抗氧化能力,还有可能是通过降低NOS活性和NO含量,进而阻止过氧亚硝酸盐的形成和细胞因子的释放,从而减轻UC的炎症反应,所以抑制NOS产生NO可能是治疗UC的主要靶点之一[27]。
综上所述,日常饮用0.7 mg·mL−1APS水溶液对UC小鼠具有显著疗效,其作用效果与抗氧化、改善肠道黏膜屏障功能、减少炎症因子的释放有关,但是APS对UC的作用机制具有多途径、多靶点的特点[28],后续有待进一步深入分析结肠组织内的蛋白质、mRNA以及其他脏器的指标,探究APS对UC的其明确的靶向作用机制。

