蒲公英多糖酶解辅助提取工艺优化及其单糖组成分析
赵 阳,刘 娜,王 园,宋 敏,王瑞芳,杨艳平,齐景伟, ,安晓萍,
(1.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018;2.内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
蒲公英(Dandelion)是一种常见的野生植物,分布广泛、品种繁多。其具有非常丰富的活性成分,如多糖、多酚、黄酮、三萜等[1],其丰富的活性成分给蒲公英带来了广泛的生物活性,包括抗氧化[2]、降血糖[3]、抗炎[4]、抑菌[5]、保肝利胆[6]、抗肿瘤[7]、免疫调节[8]、调节胃肠道微生态[9]等。近几年来,从蒲公英中分离各种活性成分并对其结构、生物作用和生产应用的研究引起了广大科研工作者的关注。蒲公英多糖含有葡萄糖及多种D型糖,例如甘露糖、半乳糖、木糖、鼠李糖等单糖[10],在生物体的生长发育中起着重要作用[11]。蒲公英多糖具有很好的抗氧化活性,可以保护扑热息痛诱导的小鼠肝脏氧化损伤[12],对DPPH自由基、羟基自由基、超氧阴离子自由基也具有很好的清除作用[13];其在抗炎、抑菌方面也有很显著的效果,可以抑制大鼠MAPK/ERK通路以减轻幽门螺杆菌相关性胃炎,保护胃黏膜[14];且对大肠杆菌、金黄色葡萄球菌的生长具有一定的抑制作用[15]。体外试验证明,蒲公英多糖还具有一定的免疫调节作用,可以抑制小鼠单核巨噬细胞NO的分泌,抑制炎症因子IL-1β、IL-6、TNF-α、COX-2 mRNA的表达[16−17];改善小鼠脾脏指数、脾脏生发中心反应和体内T细胞的活化,增强小鼠免疫能力[18]。
生物酶解技术的优势在于通过酶的催化作用让物质自体分解,与发酵相比,酶解时间比较短,作用比较直接。而固态酶解相比于液态具有废水排放少、处理费用低、清洁环保和低能耗等特点[19]。韦婷等[20]在红阳猕猴桃果浆中添加果胶酶,发现出汁率、感官得分率、自然澄清度都有所提高,同时总酸含量得到降低;杜静[21]使用固态酶解处理马铃薯,发现添加果胶酶和纤维素酶可以显著降低马铃薯渣持水力,破坏马铃薯渣紧密的微观结构。现阶段,大多数研究者只是通过物理压缩与化学处理的手段破坏植物细胞壁,促进活性成分释放,而将固态酶解技术作用于蒲公英上并探究其活性成分的研究未见报道。基于此,本试验采用固态酶解技术处理蒲公英,通过单因素结合Box-Behnken响应面法分析了酶解工艺对蒲公英多糖含量的影响,对比研究了酶解前后蒲公英粗多糖的单糖组成和扫描电镜,并初步解析了影响机制,为深度开发利用蒲公英资源提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蒲公英、小麦麸皮 原料市场;纤维素酶、β-甘露聚糖酶、β-葡聚糖酶、木聚糖酶、果胶酶 夏盛实业集团有限公司;Bradford试剂 索莱宝试剂公司;苯酚、浓硫酸 天津市汇杭化工科技有限公司,均为分析纯。
TG16-WS台式高速离心机 湖南湘仪仪器开发有限公司;Epoch2酶标仪(微孔板分光光度计)美国伯腾仪器有限公司;CP224C电子天平 上海奥豪斯仪器有限公司;数显电子恒温水浴锅 上海医疗器械有限公司;JSM-6390LV 扫描电镜JEOL公司;IB3型离子镀金仪 喷金镀膜Eiko公司。
1.2 实验方法
1.2.1 单因素实验设计
1.2.1.1 麸皮对酶解蒲公英产物多糖含量的影响将蒲公英粉碎过20目筛,麸皮粉碎过60目筛,之后称取20 g蒲公英以及20 g混有10%麸皮的蒲公英,分别加入1000 U/g果胶酶,按含水量50%、酶解温度50℃、酶解时间4 h条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.1.2 不同酶种类对酶解蒲公英产物多糖含量的影响 取20 g混有10%麸皮的蒲公英,分别加入1000 U/gβ-甘露聚糖酶、β-葡聚糖酶、木聚糖酶、果胶酶、纤维素酶,按含水量50%、酶解温度50℃、酶解时间4 h条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.1.3 含水量对酶解蒲公英产物多糖含量的影响 称取20 g混有10%麸皮的蒲公英,加入1000 U/g果胶酶,酶解底物中的含水量分别为总体系的40%、45%、50%、55%,按酶解温度50℃、酶解时间4 h条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.1.4 酶添加量对酶解蒲公英产物多糖含量的影响 称取20 g混有10%麸皮的蒲公英,分别加入500、1000、1500、2000 U/g果胶酶,按含水量50%、酶解温度50℃、酶解时间4 h条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.1.5 酶解温度对酶解蒲公英产物多糖含量的影响 称取20 g混有10%麸皮的蒲公英,加入1500 U/g果胶酶,按照酶解温度45、50、55、60、65、70℃,含水量50%,酶解时间4 h条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.1.6 酶解时间对酶解蒲公英产物多糖含量的影响 称取20 g混有10%麸皮的蒲公英,加入1500 U/g果胶酶,按照酶解时间0、4、8、12、16、20、24 h,含水量50%、酶解温度60℃条件进行酶解,酶解产物烘干并粉碎,测定多糖含量。
1.2.2 Box-Behnken响应面法优化设计 通过单因素实验结果,以多糖含量(Y)为响应值,选取A:酶解时间(h);B:酶解温度(℃);C:酶添加量(U/g);D:含水量(%)为考察的自变量,通过Design-Expert8.0.6中的Box-Behnken方法设计优化实验。以-1、0、1分别代表自变量的低、中、高水平,因子编码及水平见表1。
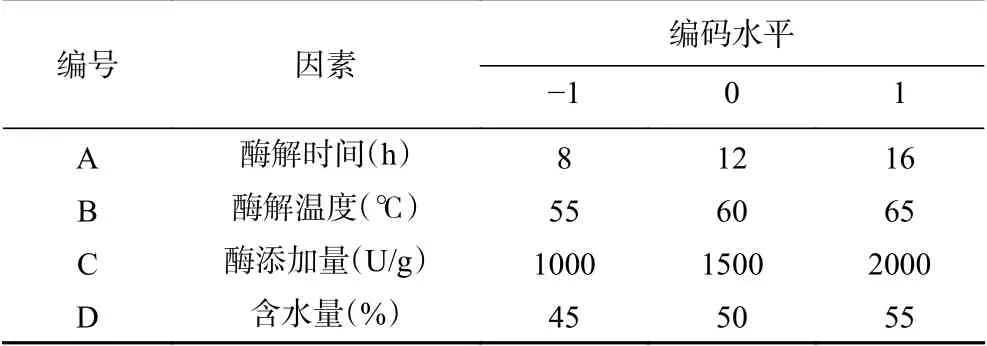
表1 响应面分析试验因素与水平Table1 Factorsand levelsused in response surfaceanalysis
1.2.3 多糖的提取方法 本试验采用热水浸提法提取蒲公英多糖,准确称取1 g粉碎后的蒲公英样品,加入16 mL蒸馏水,于80℃水浴锅中浸提35 min,取出后流水冷却,5000 r/min离心10 min,弃沉淀,留上清液待测。
1.2.4 多糖含量的测定 采用张倩茹[22]的方法并稍作改进,以葡萄糖为标准品,采用苯酚硫酸法测定多糖含量,具体测定步骤如下:
取1 mL稀释适宜倍数后的蒲公英水提上清液,加入1 mL蒸馏水,再加入1 mL 6%苯酚溶液和5 mL浓硫酸混匀,室温冷却20 min,490 nm下测定吸光度值。根据标准曲线计算多糖含量,标准曲线回归方程为y=0.2549x−0.0341,y代表糖的浓度(mg/mL),x代表吸光度值,R2=0.9985。
蒲公英多糖含量计算公式:
蒲公英多糖含量(mg/g)=稀释液多糖浓度(mg/mL)×稀释倍数×上清液体积(mL)÷称取的蒲公英质量(g)
1.2.5 蒲公英粗多糖的制备 称取未酶解(不添加果胶酶,其余处理与酶解样品一致)以及酶解的样品,以1:16的料水比在80℃水浴锅中浸提35 min,5000 r/min离心10 min,取上清液通过旋转蒸发仪进行浓缩,60℃烘干。加入蒸馏水配制成40 g/L浓度的溶液,加入总体积0.2%的中性蛋白酶,置于40℃水浴锅中1.5 h,之后沸水浴10 min使酶失活。冷却后5000 r/min离心10 min。取上清液与配好的Sevage试剂(三氯甲烷:正丁醇=4:1)按照3:1的比例避光混合,之后使用磁力搅拌器充分搅拌30 min,5000 r/min离心15 min,取上清液与配好的Sevage试剂再按照3:1的比例避光混合,重复上述操作两次,以去除溶液中残留的蛋白质。随后将三次去蛋白后的溶液放入旋转蒸发仪中浓缩,加入4倍体积的乙醇4℃沉淀12 h,5000 r/min离心10 min,弃上清,留沉淀,冷冻干燥48 h后得到蒲公英粗多糖。
1.2.6 单糖组成分析 采用刘玉辉的方法[23],使用高效液相色谱(HPLC)对未酶解和酶解蒲公英粗多糖进行分析。HPLC条件:SHISEIDO C18色谱柱(250 mm×4.6 mm,5μm),流动相A为0.1 mol/L磷酸盐缓冲液(pH7.0);流动相B为乙腈水溶液(82:18,v/v);流速为1.0 mL/min;柱温25℃;进样量10μL;采用VWD检测器在245 nm处检测。
1.2.7 扫描电镜分析 将未酶解和酶解蒲公英粗多糖用IB-3型离子镀金仪喷金镀膜,使用JSM-6390LV扫描电镜直接进行观察[24]。
1.3 数据统计与分析
所有试验数据使用SAS 9.2软件进行处理,结果均用平均值±标准差表示,P<0.05为差异显著。
2 结果与分析
2.1 单因素实验结果
2.1.1 添加麸皮对蒲公英多糖含量的影响 由图1可知,蒲公英的多糖含量为102.14 mg/g,添加10%麸皮的蒲公英多糖含量为122.53 mg/g。蒲公英、含10%麸皮的蒲公英经过果胶酶酶解4 h后,其多糖含量均显著提高(P<0.05),分别达到137.51和170.77 mg/g,较酶解前提高了32.67%和39.37%,在底物中添加麸皮可以显著提高酶解蒲公英多糖含量(P<0.05)。对于小麦麸皮酶解起作用更多的是纤维素酶、α-淀粉酶和木聚糖酶[25−27],而果胶酶更多是协同分解果胶为半乳糖醛酸等小分子,破坏中草药植物细胞壁,分解细胞壁上的多糖基质,释放活性成分[28],对小麦麸皮很难达到细胞壁降解的作用。麸皮的纤维结构较蒲公英更疏松多孔[29],而纤维素类物质不同的多尺度多孔结构会影响水分在其内部分布及流动性,进而影响酶解效率;麸皮作为辅料可以起到支撑底物、提供空间和透气性的作用,提升酶解效率,促进多糖物质释放。因此,本研究采用90%蒲公英+10%麸皮作为酶解底物进行后续试验。
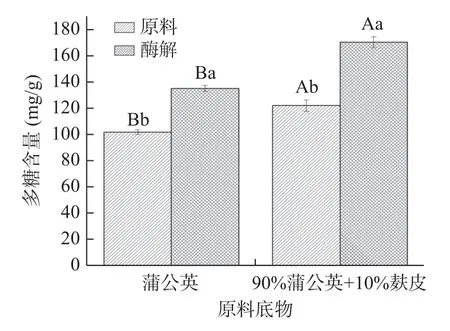
图1 添加麸皮对蒲公英中多糖含量的影响Fig.1 Effect of adding bran on the content of polysaccharide in dandelion
2.1.2 酶种类对蒲公英多糖含量的影响 不同种类的酶对含10%麸皮蒲公英酶解产物中多糖含量影响的结果见图2。由图可知,果胶酶酶解蒲公英产物中多糖含量最高,达到174.59 mg/g,显著高于β-甘露聚糖酶、β-葡聚糖酶、木聚糖酶和纤维素酶(P<0.05)。蒲公英中的活性成分大部分都在细胞壁中,而果胶酶能分解植物细胞壁上的多糖基质以及果胶等大分子物质,增加有效物质的溶解,促进活性成分的释放[28,30],故选用果胶酶进行后续试验。
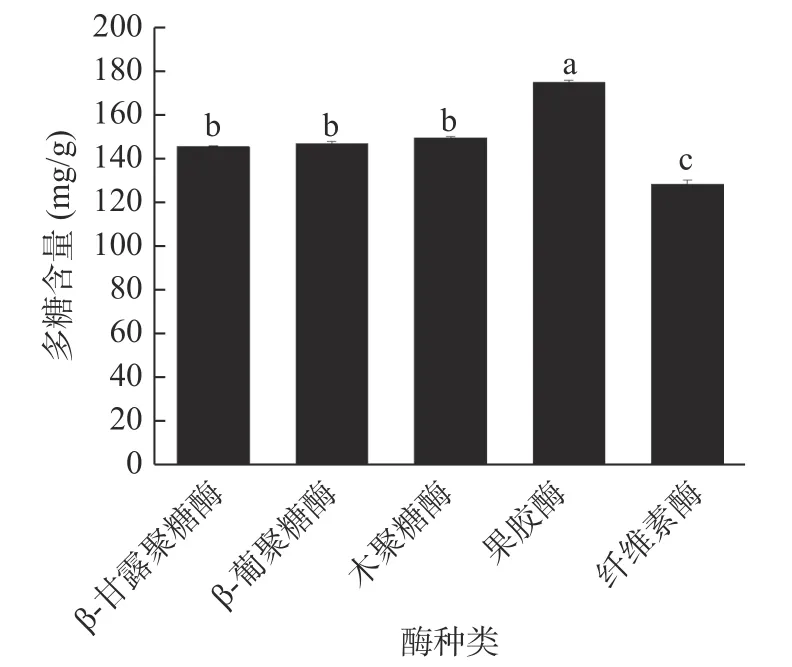
图2 酶种类对蒲公英中多糖含量的影响Fig.2 Effect of enzyme specieson polysaccharide content of dandelion
2.1.3 含水量对蒲公英多糖含量的影响 由图3可知,当含水量为50%时得到的多糖含量最高,达到183.49 mg/g,且显著高于其他组(P<0.05)。含水量体现了酶解总体系中液体量与总体系的比值,水分的流动性能够更好的传递酶的作用[31],促进酶解效率。因此,本试验选择含水量为50%进行后续试验。
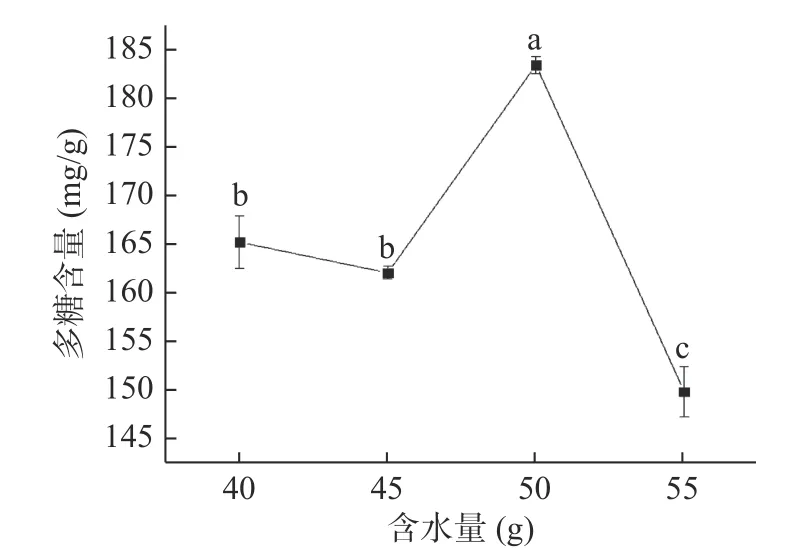
图3 含水量对蒲公英中多糖含量的影响Fig.3 Effect of water content on polysaccharide content of dandelion
2.1.4 酶添加量对蒲公英多糖含量的影响 由图4可知,在添加1500 U/g果胶酶时,其多糖含量显著高于500、1000 U/g组(P<0.05),但与2000 U/g组差异不显著(P>0.05)。这可能是因为酶添加量过低时,酶对底物的作用效果不足,不能完全酶解底物[31];但添加过多时,体系中的底物已被完全酶解,部分酶没有发挥酶解作用,造成资源浪费。为了节约生产成本,故选择添加1500 U/g果胶酶进行后续试验。
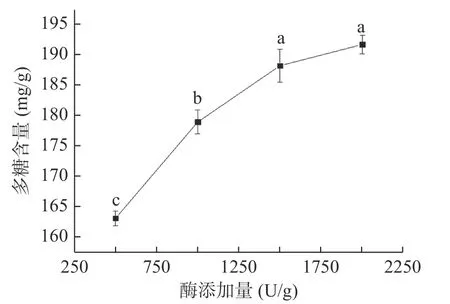
图4 酶添加量对蒲公英中多糖含量的影响Fig.4 Effect of enzyme addition on polysaccharide content of dandelion
2.1.5 酶解温度对蒲公英多糖含量的影响 由图5可知,随着温度的升高,酶解蒲公英多糖含量呈现先升高后下降的趋势,60℃时达到202.54 mg/g,显著高于除55℃以外的其它温度组(P<0.05)。这可能是因为温度会影响果胶酶的活性,温度过高或过低都不利于果胶酶发挥作用[32]。因此,本试验选择酶解温度为60℃进行后续试验。
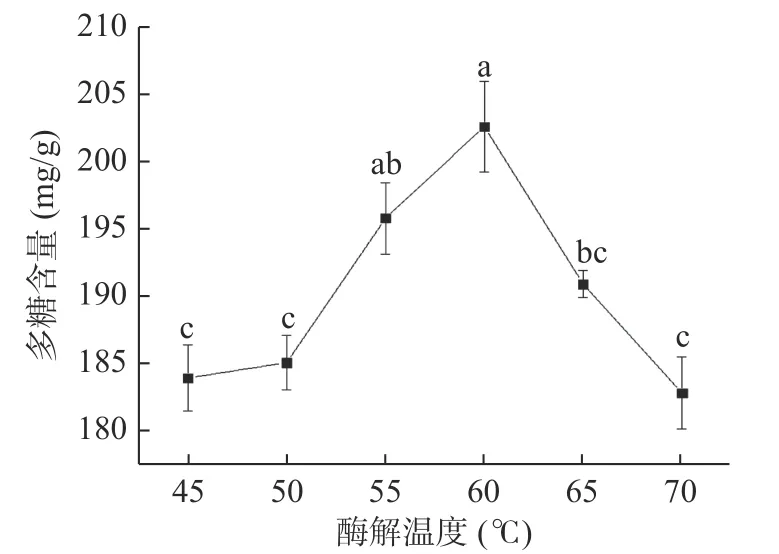
图5 酶解温度对蒲公英中多糖含量的影响Fig.5 Effect of enzymolysis temperature on polysaccharide content of dandelion
2.1.6 酶解时间对蒲公英多糖含量的影响 由图6可知,随着时间的增加,酶解蒲公英多糖含量呈现先升高后下降的趋势,在12 h时多糖含量达到201.16 mg/g,显著高于除16 h以外的其它组(P<0.05)。这可能是因为在酶解刚开始时,果胶酶吸附在底物表面,发挥催化作用;随着时间增加,酶与底物已完全反应,多糖含量会逐渐趋于稳定;但时间过长,酶活力发生下降,且部分多糖发生水解,故多糖含量会呈下降趋势[33−34]。因此,本试验选择酶解时间为12 h进行后续试验。
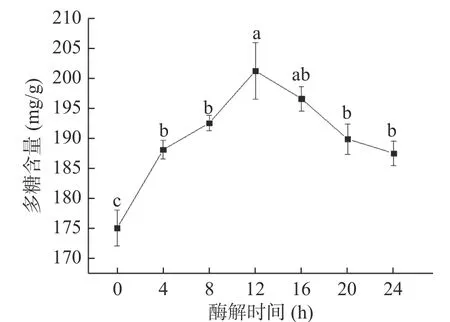
图6 酶解时间对蒲公英中多糖含量的影响Fig.6 Effect of enzymolysis time on polysaccharide content of dandelion
2.2 响应面试验结果
2.2.1 响应面结果 响应面优化试验设计及结果见表2,对表2的数据进行拟合分析,通过模型分析得到回归方程:Y=216.66+3.89A−6.11B+1.81C+6.57D+2.57AB−2.77AC+0.68AD−3.76BC−12.29BD−0.99CD−18.48A2−18.26B2−16.62C2−2.26D2,对模型进行方差分析,所得结果见表3。
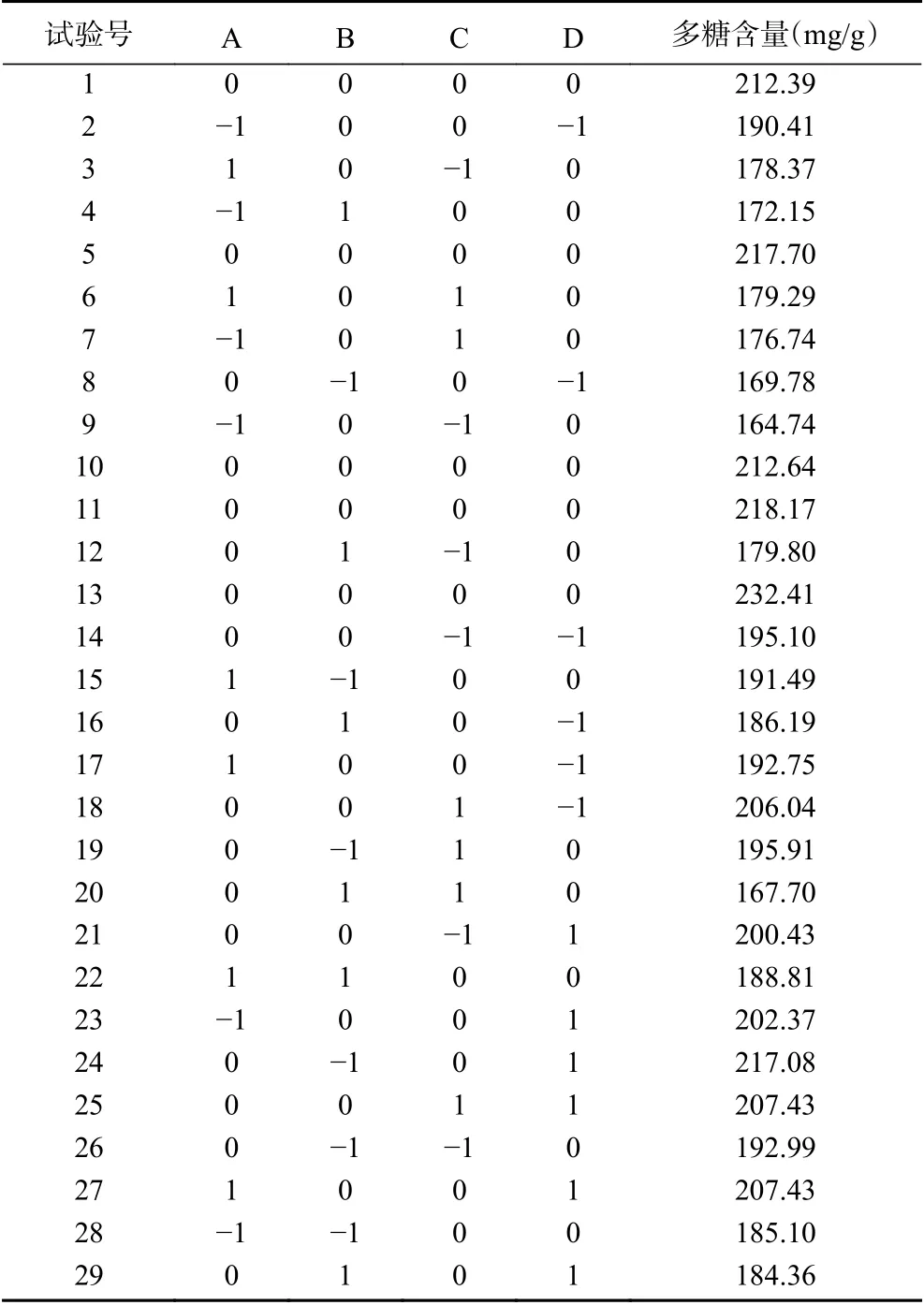
表2 Box-Behnken响应面优化试验设计及结果Table 2 Experimental design and results for Box-Behnken
从回归模型方差分析结果(表3)可知,P=0.0041<0.01,F=4.48,表示该模型差异极显著,即回归方程描述各因子与响应值之间的关系时,其应变量与全体自变量之间的线性关系是显著的,即这种试验方法是可靠的;失拟项用来表示所用模型与试验拟合的程度,P=0.6175>0.05,表明失拟项差异不显著[35]。一次项D、交互项BD对响应值多糖含量影响达到显著水平(P<0.05);二次项A2、B2、C2对响应值多糖含量影响达到极显著水平(P<0.01)。根据F值A=1.73、B=4.28、C=0.37、D=4.94可知,影响多糖含量的主效应关系为:含水量>酶解温度>酶解时间>酶添加量。
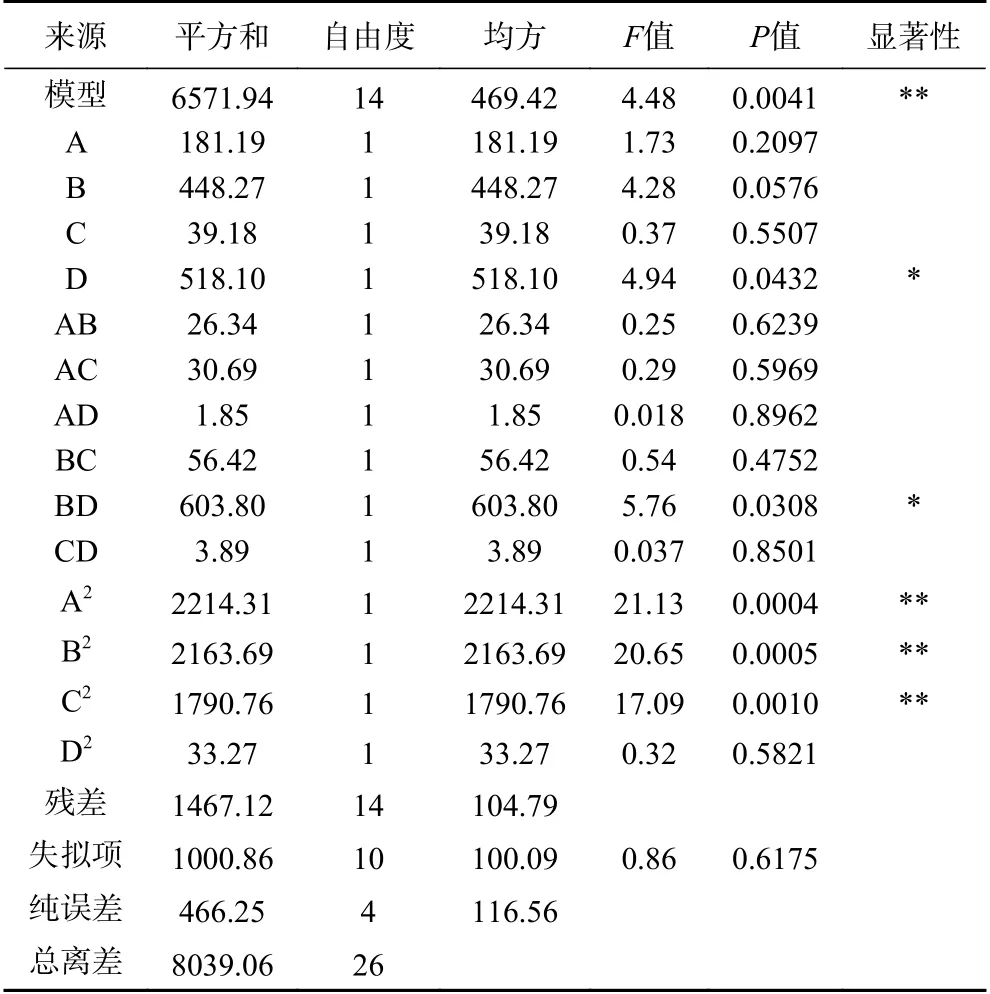
表3 回归模型方差分析结果Table 3 Analysisof variance for the fitted regression model
2.2.2 响应面分析 酶解时间、酶解温度、酶添加量、含水量的两两交互作用图如下:由图7分析可知,在试验范围内,蒲公英多糖含量随着酶解时间的增加呈现先上升后下降的趋势,酶解温度对多糖含量的变化也有相似趋势。从图7的等高线可看出酶解时间和酶解温度对蒲公英多糖含量交互作用不显著(P>0.05)。图8分析可知,在试验范围内,蒲公英多糖含量随着酶解时间的增加呈现先上升后下降的趋势,酶添加量对多糖含量的变化也有相似趋势。从图8的等高线可看出酶解时间和酶添加量对蒲公英多糖含量交互作用不显著(P>0.05)。图9分析可知,在试验范围内,蒲公英多糖含量随着酶解时间的增加呈现先上升后下降的趋势,含水量对多糖含量的变化呈上升趋势。从图9的等高线可看出酶解时间和含水量对蒲公英多糖含量交互作用不显著(P>0.05)。图10分析可知,在试验范围内,蒲公英多糖含量随着酶解温度的增加呈现先上升后下降的趋势,酶添加量对多糖含量的变化也有相似趋势。从图10的高等线可看出酶解温度和酶添加量对蒲公英多糖含量交互作用不显著(P>0.05)。图11分析可知,在试验范围内,蒲公英多糖含量随着酶解温度的增加呈现先上升后下降的趋势,含水量对多糖含量的变化呈上升趋势。从图11的等高线可看出酶解温度和含水量对蒲公英多糖含量交互作用显著(P<0.05)。图12分析可知,在试验范围内,蒲公英多糖含量随着酶添加量的增加呈现先上升后下降的趋势,含水量对多糖含量的变化呈上升趋势。从图12的等高线可看出酶解温度和含水量对蒲公英多糖含量交互作用不显著(P>0.05)。
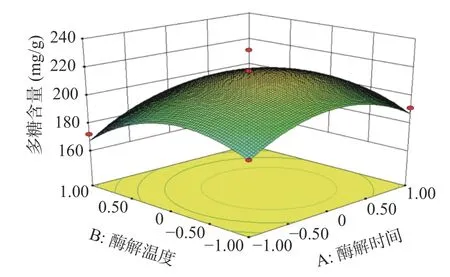
图7 酶解时间和酶解温度对蒲公英多糖含量影响的交互作用Fig.7 Interaction of enzymolysis time and enzymolysis temperature on polysaccharidecontent of dandelion
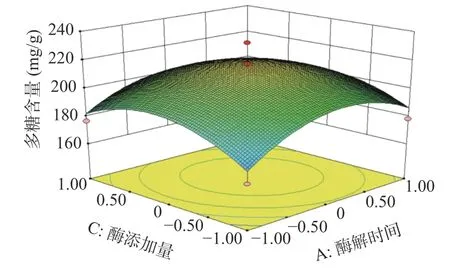
图8 酶解时间和酶添加量对蒲公英多糖含量影响的交互作用Fig.8 Interaction of enzymolysis time and enzyme addition amount on polysaccharide content of dandelion
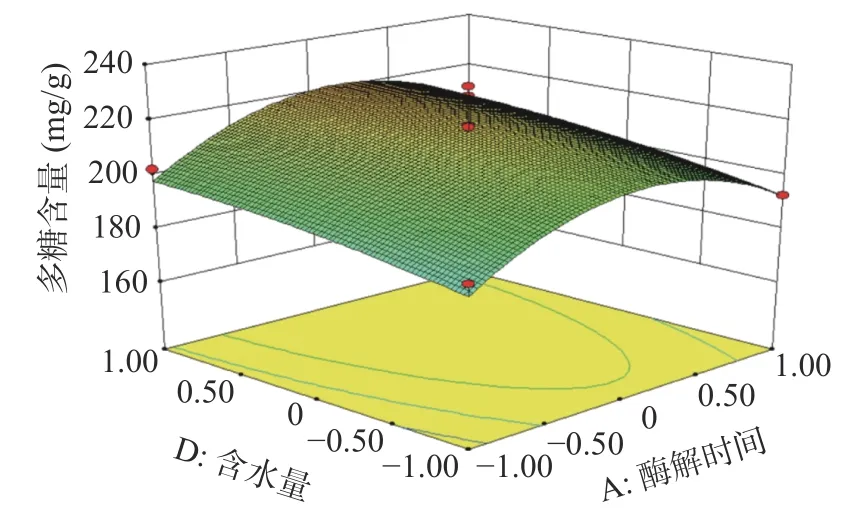
图9 酶解时间和含水量对蒲公英多糖含量影响的交互作用Fig.9 Interaction of enzymolysis time and water content on polysaccharide content of dandelion
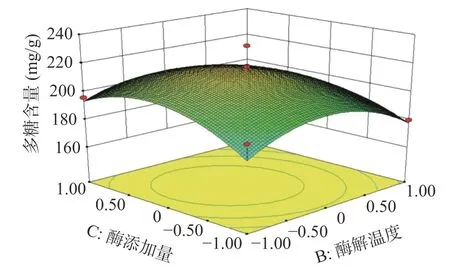
图10 酶解温度和酶添加量对蒲公英多糖含量影响的交互作用Fig.10 Interaction effectsof enzymolysis temperatureand enzymeaddition amount on polysaccharidecontent of dandelion
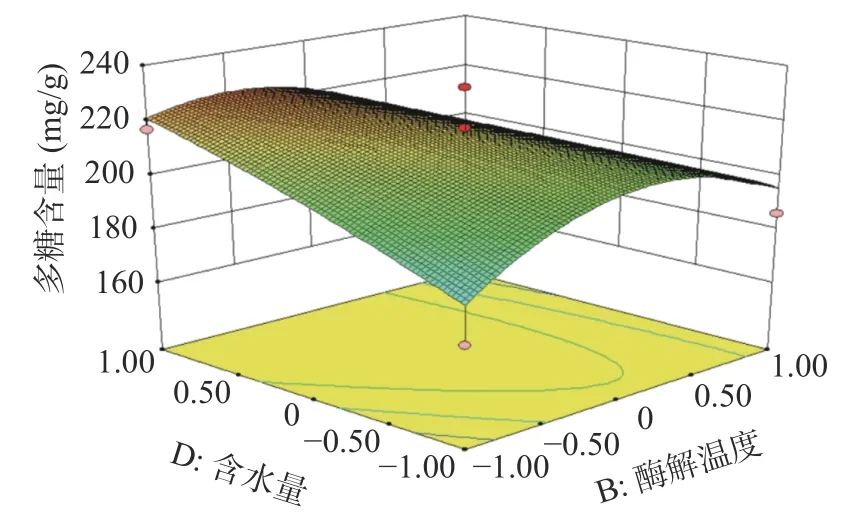
图11 酶解温度和含水量对蒲公英多糖含量影响的交互作用Fig.11 Interaction of enzymolysistemperature and water content on polysaccharide content of dandelion
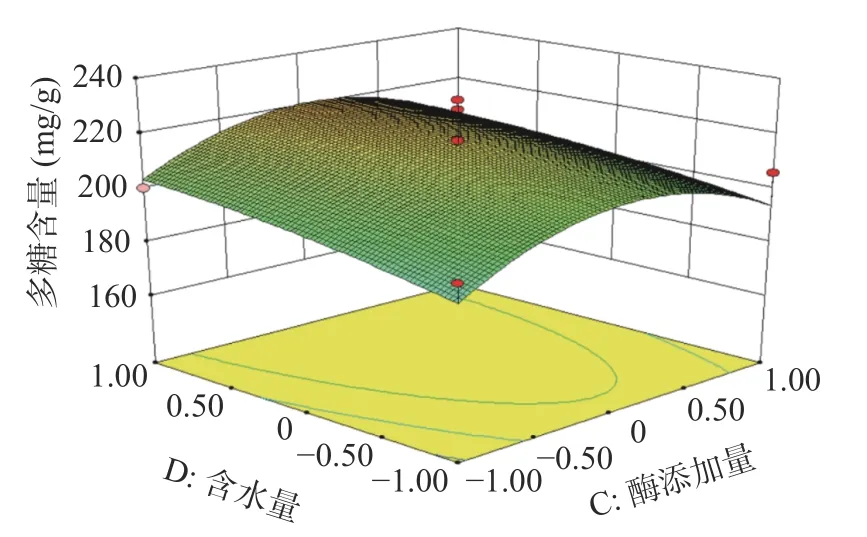
图12 酶添加量和含水量对蒲公英多糖含量影响的交互作用Fig.12 Interaction of enzyme addition and water content on polysaccharidecontent of dandelion
2.2.3 最佳工艺的验证试验 通过Design-Expert 8.0.6,经过模型预测,得到最佳工艺参数为:酶解时间12.3 h、酶解温度57.6℃、酶添加量 1532 U/g、含水量55%,该条件下多糖含量理论值为225.84 mg/g。为验证模型准确性,用最佳工艺参数进行验证试验,该条件下的多糖含量实际值为218.21 mg/g,与理论值仅差0.76%,且差异不显著(P=0.5383),表明该模型优化工艺参数可靠。
2.3 单糖组成分析
由表4可知,酶解前蒲公英多糖主要由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖组成,其摩尔比为1.72:1.80:20.24:14.59:4.58:10.07;酶解后蒲公英多糖主要由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖组成,其摩尔比为2.99:10.65:18:14.82:8.61:9.20:0.83。与酶解前相比,甘露糖、鼠李糖、半乳糖、木糖含量分别增加了0.74%、490.54%、1.56%、87.79%,同时产生了岩藻糖,但葡萄糖、阿拉伯糖分别下降了11.05%、8.66%。郭慧静[13]研究发现纯化后的蒲公英多糖主要由葡萄糖和甘露糖组成,其摩尔百分比为甘露糖:葡萄糖=45.41:52.39;肖潮勇[36]分离纯化出两种蒲公英多糖,摩尔比分别为甘露糖:鼠李糖:葡萄糖醛酸:半乳糖醛酸:葡萄糖=6.52:3.26:3.75:1.00:6.38以及7.90:5.10:1.00:11.55:6.61;高金波等[37]使用水提法、超声提取法、酶提取法、超声波协同酶法提取蒲公英粗多糖,发现其中都含有D-鼠李糖、葡萄糖、D-半乳糖、D-木糖、D-阿拉伯糖五种中性单糖,其中水提法单糖摩尔比为鼠李糖:葡萄糖:半乳糖:阿拉伯糖=0.088:0.500:0.190:0.340。酶解后单糖组成发生变化的原因可能是果胶酶催化降解了多糖,酶修饰因其特异性高、效率高、副作用少的优点可以使多糖得到生物改性的效果,通常改性后的多糖由于理化性质的改变,可以表现出更好的生物学特性[38]。
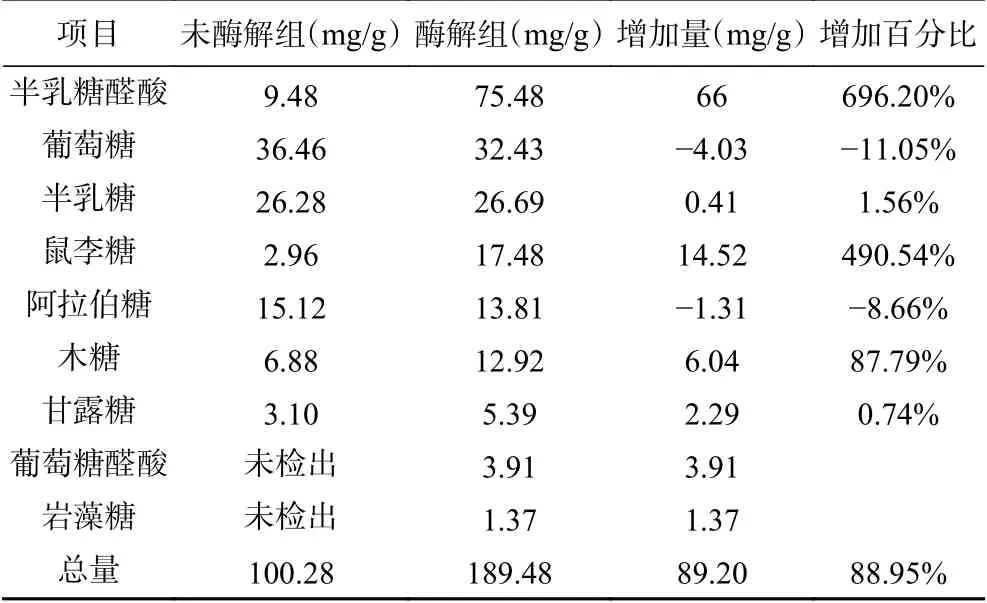
表4 未酶解和酶解蒲公英粗多糖的单糖组成Table 4 Monosaccharide composition of unenzymolysis and enzymolysisdandelion crude polysaccharides
2.4 扫描电镜结果
本研究利用扫描电镜观察经过酶解处理后的蒲公英微观结构变化。如图13所示,蒲公英(图A)表面光滑,结构紧密,没有孔洞损伤;而经过酶解处理后的蒲公英(图B),表面粗糙并出现较多孔洞,结构变得疏松,表面积变大。结果表明,酶解可以改变蒲公英多糖的形貌结构,其影响原因还有待深一步探讨。
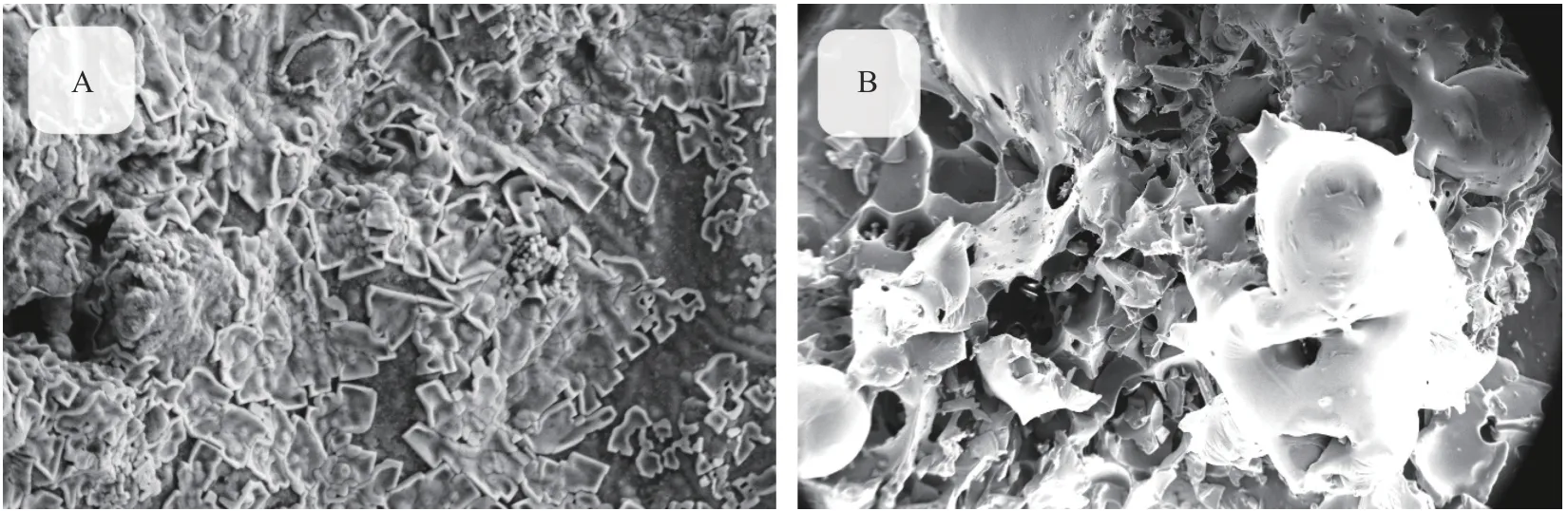
图13 未酶解和酶解蒲公英粗多糖的扫描电镜图Fig.13 Scanning electron micrographsof unenzymolysisand enzymolysisdandelion crude polysaccharides
3 结论
以酶解蒲公英多糖含量为评价指标,通过单因素试验及Box-Behnken响应面法优化酶解条件,最终确定蒲公英最佳的酶解工艺为:果胶酶酶解蒲公英,辅料麸皮添加量为10%,酶解时间为12.3 h,酶解温度为57.6℃,酶添加量为1532 U/g,含水量为55%,该条件下的蒲公英多糖产量最高,为218.21 mg/g,较酶解前122.53 mg/g提高了78.09%。酶解改变了蒲公英多糖的单糖组成,提高了甘露糖、鼠李糖、半乳糖、木糖的含量,产生了岩藻糖,但降低了葡萄糖和阿拉伯糖的含量;且酶解后蒲公英变得表面粗糙,孔洞增多,结构疏松,但其原因还有待进一步探讨。本试验研究结果将为深度开发利用蒲公英资源提供一定的理论依据。

