北京棒杆菌天冬氨酸激酶五突变体的构建及酶学性质表征
王哲人,刘晓婷,樊占青,王亚南,魏 贞,高 欣,方 丽,闵伟红
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林长春 130118)
天冬氨酸族氨基酸包括苏氨酸(Thr)、赖氨酸(Lys)、甲硫氨酸(Met)及异亮氨酸(Ile)[1],是人体必需氨基酸,其生物合成途径中首个关键别构酶是天冬氨酸激酶(aspartake kinase,AK)[2],受Thr和Lys的反馈或协同反馈抑制作用[3−4]。不同生物体中,AK的存在形式和抑制机制不同[5],大肠杆菌中有三种形式AK酶,分别为两种双功能天冬氨酸激酶-高丝氨酸脱氢酶(AKI-HSDHI、AKII-HSDHII)和一种单功能AK(AKIII)[6],其中AKI-HSDHI活性受Thr反馈抑制[7],AKII-HSDHII活性不受任何天冬氨酸族氨基酸抑制[8],AKIII活性受Lys的反馈抑制[9]。拟南芥中含有5种形式的AK,包括3种单功能酶AKI、AKII、AKIII和2种双功能酶AKI-HSDHI、AKII-HSDHII[4]。其中AKI受Lys和S-腺苷甲硫氨酸(SAM)协同反馈抑制[10],AKII和AKIII仅受Lys抑制[11],AKI-HSDHI和AKII-HSDHII受Thr抑制,且AKII-HSDHII还受到亮氨酸(Leu)的抑制作用[12]。据文献报道,北京棒杆菌天冬氨酸激酶(CorynebacteriumpekinenseAK,CpAK)是一种单体变构酶,受Thr和Lys协同反馈抑制[13−14],限制天冬氨酸家族氨基酸的积累。因此,本实验选择只含有一种单体AK的北京棒杆菌中CpAK为研究对象,试图削弱或解除Thr和Lys的反馈抑制作用,为提高酶活力和增加天冬氨酸族氨基酸产量提供理论依据。
赵智等[15]构建含AK的重组质粒,提高AK酶活力和Lys产量。秦天宇[16]通过表达高丝氨酸脱氢酶的hom基因和AK的lysC基因并敲除McbR,提高Met产量。Shaul等[17]发现在大肠杆菌突变株中,AK基因表达时,Thr大量积累,因此突变能解除反馈抑制作用,提高下游产物产量,此研究为如何提高Thr产量和通过突变对AK进行改造提供理论基础。Ohnishi等[18]将谷氨酸棒杆菌AK Thr311突变成T311I后,Lys产量有所提高。Chen等和Curien等[19−20]对谷氨酸棒杆菌和大肠杆菌中AK别构抑制剂结合位点进行突变,获得削弱Thr和Lys协同反馈抑制的突变体。Ayako等[21]在对谷氨酸棒杆菌天冬氨酸激酶(Corynebacterium glutamicumAK,CgAK)结构研究的基础上,提出Thr/Lys结合诱导了ACT结构域从而关闭催化结构域中的活性位点,此研究为抑制剂Thr/Lys结合的多突变株构建奠定基础。
目前主要通过对抑制剂结合位点[22−24]、底物结合位点[25]和ATP结合位点[26]对北京棒杆菌天冬氨酸激酶(CpAK)进行改造。对于结合位点的改造主要是构建单、双[27]、三[28]、四[29]突变体,五突变体的构建和改造鲜有报道。本研究在实验室前期构建的四突变体T379N/A380C/G171I/Y 198NAK(NCIN AK)基础上,提取其重组质粒,进行定点饱和突变,转入宿主BL21大肠杆菌感受态中,通过高通量筛选出酶活力显著提高的突变株,进行基因测序,测序成功后即构建五突变体成功。前期实验室四突变体NCIN AK是对与抑制剂Lys结合位点[13,22]、与底物结合位点、与ATP结合位点[30]的叠加饱和突变,所以本实验在四突变体NCIN AK基础上,对与抑制剂Thr结合的关键残基位点进行叠加饱和突变,构建五突变体,以期获得酶活力提高更多,酶学性质更好的突变体。通过同源序列比对并分析单体Cp AK,发现位点Gly295位于Thr周围,且该位点高度保守,对位点Gly295进行定点饱和突变,构建五突变体T379N/A380C/G171I/Y 198N/G295L(用突变后氨基酸的字母缩写命名,简称NCINL AK),旨在提高AK酶活力并解除反馈抑制作用,增加天冬氨酸族氨基酸产量。
1 材料与方法
1.1 材料与仪器
重组四突变体质粒p ET-28a-NCIN-AK、E.coliBL21(DE3) 均由吉林农业大学发酵工程实验室提供;Taq酶、DpnI酶、质粒提取试剂盒 大连TaKaRa公司;50×TAE Buffer 大连美仑生物技术有限公司;HRPMouse Anti-6x His BD公司;IPTG、卡那霉素、SDS-PAGE试剂盒 北京鼎国生物公司;Ni SeharoseTM6 Fast Flow 美国GE公司;LB液体培养基(100mL) 实验室自制。
梯度PCR仪 德国Eppendorf AG公司;Spectra Max 190酶标仪 美国Molecular Devices公司;Thermo Fisher高速冷冻离心机 德国奥斯特罗德公司;SE260蛋白电泳仪 美国GE公司;琼脂糖凝胶成像仪 美国GE公司。
1.2 实验方法
1.2.1 设计引物和定点突变 利用Primer Premier 5.0软件为四突变体AK的295位点进行引物设计,五突变体NCINLAK上游引物及下游引物如表1。引物合成由库美生物有限公司完成。利用试剂盒提取质粒pET-28a-NCIN-AK,以其为模板进行突变PCR扩增,反应体系及条件见张芷睿等的方法[24],将PCR产物进行1%琼脂糖核酸电泳验证,并于4℃保存。

表1 G295位点的突变引物Table 1 Mutation primer of G295
1.2.2 构建突变体重组质粒 将1.2.1中验证成功的PCR产物用DpnI酶消化2 h,将5μL消化产物导入120μLE.coliBL21感受态细胞中,反应条件为:将二者混合物预冷10 min,42℃金属浴90 s,再冰浴0.5 h,吸取900μL LB液体培养基加到处理之后的混合物中,在37℃,180 r/min条件下培养1.5~2 h,7000 r/min离心3 min,去掉800μL上清液,混匀剩余培养基和菌体后,将其涂布于有卡那抗性的LB固体培养基上,37℃培养箱过夜培养。
1.2.3 高通量筛选及AK基因验证 将平板上全部单菌落转接到含卡那霉素的LB液体培养基中,在96孔板中培养8~10 h后加入1 mmol/L的IPTG过夜诱导表达9 h。高通量筛选的方法及条件参考张芷睿等[24]。扩大培养筛选后酶活性有较大提高的突变株,培养条件为37℃、180 r/min,9~13 h。对培养后的菌体进行菌液PCR扩增,反应体系及条件参考Han等[13],对菌液PCR产物进行核酸电泳验证,将验证成功的菌株送至生工生物工程(上海)股份有限公司测序,确定基因是否突变成功。
1.2.4 AK蛋白诱导表达及纯化 将活化后的野生型和突变体菌株,以1:50的比例转入100 mL LB液体培养基中,37℃、210 r/min培养1~1.5 h,加100 μL的IPTG,130 r/min过夜诱导9 h。4℃、8000 r/min离心10 min,倒掉上清液,加入10 mL PBS缓冲液,将其与菌体反复吹打混匀。制备粗酶液和纯化液的方法见任军等[3],对野生型菌株和五突变株进行诱导表达,经离心、超声破碎、过膜得到WTAK和NCINL AK的粗酶样,将粗酶样经过镍柱(含有His标签)处理得到纯化样。参考文献Han等[13]方法步骤,进行SDS-PAGE和Western Blot验证,分析所得的粗酶液和纯化液中AK蛋白是否表达成功。
1.2.5 AK酶活力测定 以L-天冬氨酸为底物,参考文献陈志杰等[23]的酶活测定方法及反应体系,对野生型AK和突变体AK的纯化液进行酶活力测定,控制反应体系的其他条件不变,加入50μL纯化液,在不同底物浓度(0.5、1、3、5、7、9、10、12、14、16 mmol/L)下25℃、130 r/min反应30 min后,在波长540 nm处测其吸光值,并计算AK的酶活力,利用OriginPro 8.5软件对计算出的AK酶活力进行非线性拟合。
1.2.6 AK酶学性质的分析
1.2.6.1 酶的最适温度反应体系 其他条件不变,在不同温度(15、20、25、26、28、30、35、40、45、50℃)下130 r/min反应30 min,每个样品3次平行,最高酶活为100%,此时对应的温度为酶的最适温度。
1.2.6.2 酶的最适p H反应体系 其他条件不变,用浓盐酸调节Tris-HCl溶液p H(6.0~10.0,设置10个间隔,每两个值相差0.5),25℃反应30 min,在波长540 nm处测其吸光值,计算AK相对酶活力(某个pH时所测吸光值与同时期另一个pH所测出最大吸光值之比,用以确定最适pH),每个p H 3个平行,最高酶活为100%。
1.2.6.3 酶的稳定性 在最适温度和最适pH条件下,将50μLAK纯化液加入反应体系[23]中,每隔1 h测定1次酶活力,连续10 h,每个样品3个平行,0 h相对酶活力为100%。
1.2.6.4 底物抑制剂 将不同浓度(0.2、1.0、5.0、10.0 mmol/L)的底物抑制剂Lys、Thr、Met、Lys+Thr、Lys+Met、Thr+Met、Lys+Thr+Met加入到反应体系中,研究底物抑制剂对AK酶活力的影响,每个样品3个平行,对照组没有底物抑制剂,相对酶活为100%。
1.3 数据处理
每组实验重复3次或3次以上,结果以x±s表示,采用SPSS 19.0软件对实验结果进行统计学分析并用OriginPro 8.5软件作图。
2 结果与分析
2.1 Thr关键结合位点的确定
通过Clustal X 1.83、ESPript 3.0进行同源序列比对并用Discovery Studio 4.5软件对AK单体模型中抑制剂Thr周围5Å范围内关键残基位点分析,找出与Thr结合的关键残基,如图1B、1C所示,Gly295位点(图1C中Gly295用简写G295表示,其中G是氨基酸Gly的简写,图1B中各个氨基酸位点表示同理)与Thr形成氢键,其它残基也与抑制剂之间存在较强的相互作用,Gly295与周围氨基酸共同作用于Thr,有稳定Thr的作用。同源序列比对结果显示,Gly295位点高度保守,如图1A所示。Gly295位点可能有重要作用,猜想改变Gly295位点与Thr之间的作用,可能会使抑制剂结合方式改变,从而达到本研究的目的。
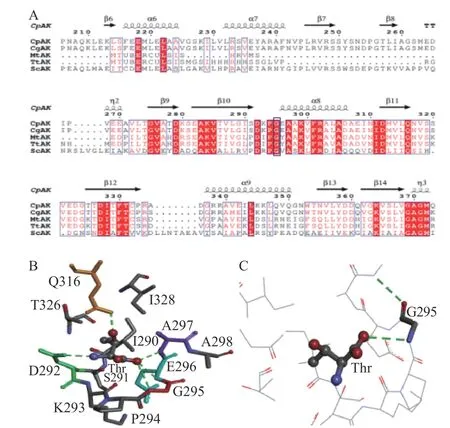
图1 Thr结合位点的筛选Fig.1 Selection of Thr binding sites
2.2 突变体NCINL AK的构建
核酸电泳结果如图2A中泳道2所示,单一明亮条带在7000 bp附近,大小与质粒pET-28a-AK(6822 bp)相符,证明质粒实现大量复制,初步说明突变成功。扩大培养高通量筛选获得的高活性突变体AK菌株。如图2B所示,单一明显条带大小在1400 bp左右,与野生型AK(1453 bp)基本一致,证明筛选的重组菌株中有AK基因。如图2C所示,五突变体NCINL AK氨基酸序列中295位点由甘氨酸(Gly)突变成Leu,证明五突变体NCINL AK构建成功。
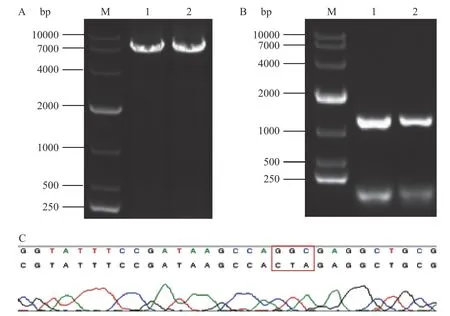
图2 五突变体NCINL AK的构建Fig.2 Construction of thefive-point mutant NCINL AK
2.3 SDS-PAGE和Western Blot验证
分别对WTAK和NCINL AK的粗酶样和纯化样进行SDS-PAGE及Western blot蛋白电泳验证,结果如图3所示,1~6泳道在48 k Da处均有单一蛋白条带,说明目的蛋白表达成功。WT AK表达的蛋白条带比NCINL AK颜色深,说明NCINL AK蛋白表达量较WT AK低。可能是突变使单体AK空间结构发生变化,导致AK蛋白表达能力降低。
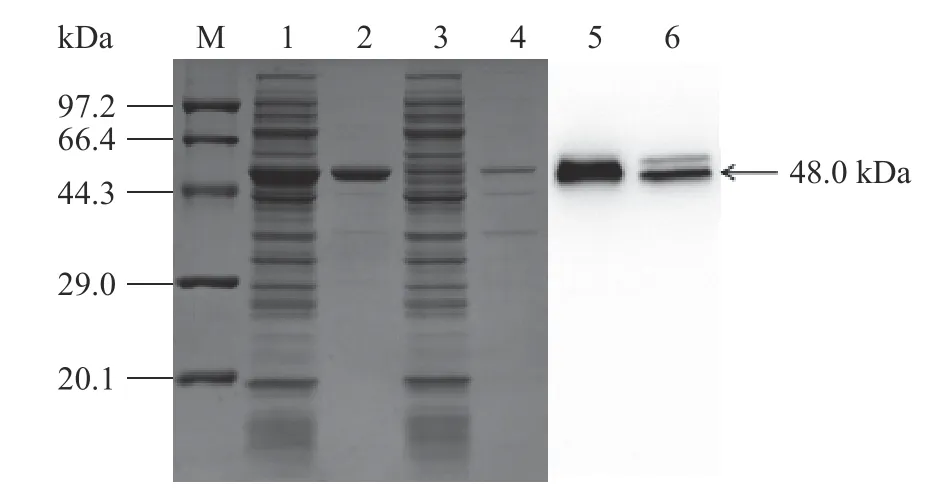
图3 SDS-PAGE 及Western blot 结果Fig.3 Results of SDS-PAGE and Western blot
2.4 反应动力学结果
如图4和表2所示。五突变体NCINL AK的最大反应速率Vmax为259 U/(mg·min),较WT AK Vmax(2.97 U/(mg·min))提高87.20倍;WTAK的反应动力学符合Hill方程V=VmaxSn/(Kn+Sn),且n值为2.73(大于1),表明AK为典型的别构酶且呈正协同性[30],五突变体NCINL AK的n值为1.21,较野生型低,表明突变后正协同性降低;NCINL AK的Km值为0.93,明显低于野生型,表明突变后与底物亲和力增强。五突变体NCINL AK的n、Km值均低于四突变体NCIN AK,表明突变后五突变体与底物亲和力更强,且酶活力也高于四突变体,可能是因为295位点突变后,由原来的Gly变为Leu(图5,其中Gly用简写G表示,Leu用简写L表示),R基侧链增长,在一定程度上破坏了与抑制剂Thr之间的非共价作用力,减弱了其与抑制剂的结合,从而增强其与底物的结合能力,说明在四突变体NCIN AK的基础上继续改造获得良好效果。
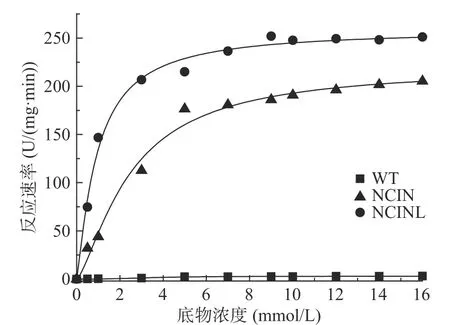
图4 WT AK和NCINL AK的反应动力学结果Fig.4 Reaction kinetic resultsof WTAK and NCINL AK

表2 WTAK和NCINL AK的反应动力学参数Table 2 Reaction kinetic parameters of WT AK and NCINL AK
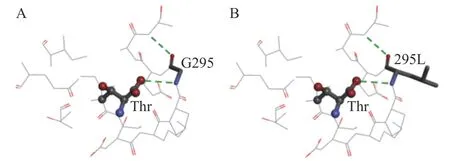
图5 G295位点突变前后与Thr位置之间的变化Fig.5 Changes before and after G295 site mutation and Thr position
2.5 野生型AK和突变体AK酶学性质表征
2.5.1 温度和p H对酶活的影响 由图6A可知,五突变体NCINL AK最适温度为28℃,突变后五突变体最适温度较野生型和四突变体提高3℃,当温度在28~50℃范围内时,酶活力随温度升高而下降,突变体NCINL AK酶活力高于此温度下野生型和四突变体,在50℃时,其相对酶活力仍能保持在57%以上,说明突变后AK酶表现出良好的耐高温性能。可能是由于突变后,酶与底物的结合更为紧密,使得催化效率提高,即使在高温条件下,仍不能破坏酶与底物的连接,所以酶活性降低的程度减慢,宏观表现为耐高温性增强。
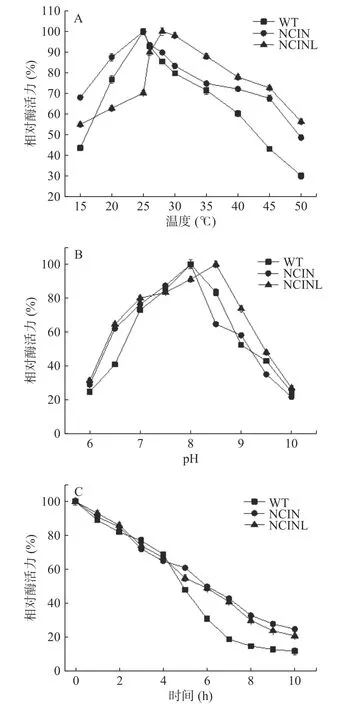
图6 WTAK、NCIN AK和NCINL AK的酶学性质表征Fig.6 Characterization of enzymatic properties of WTAK,NCIN AK and NCINL AK
由图6B可知,WT AK最适pH为8.0,突变体NCINL AK最适pH为8.5,突变未改变酶的最适pH,但pH在6.5~7范围内时,相对酶活力在60%以上,表现良好的耐酸性。低pH条件下高酶活力对发酵生产氨基酸有利。
2.5.2 AK的稳定性分析 在反应温度28℃和p H8.5条件下,对野生型AK和突变体AK稳定性进行测定,如图6C所示,突变体NCINL AK的半衰期为5.2 h,较野生型AK延长了0.5 h。8~10 h时,突变体NCINLAK酶活力较野生型和四突变体下降缓慢,直到10 h酶活力仍在25%以上,比野生型AK更稳定,也改善了四突变株半衰期缩短的情况,表明五突变体AK稳定性更好。
2.5.3 底物抑制剂对AK活力的影响 由表3、表4可知,在抑制剂Lys、Thr或Met单独存在时,Lys或Thr对WT AK的抑制作用强于Met。浓度为10 mmol/L的Lys+Thr对WT AK的抑制作用最大,约为73%,说明AK受Lys和Thr的单独和协同抑制。五突变体NCINL AK在不同浓度Lys存在时被明显激活,激活作用与抑制剂浓度呈剂量依赖关系,最大激活作用可达114.79%,较四突变体NCIN AK提高5.48%,表明对抑制剂Thr结合位点的突变使AK酶活力进一步提高。NCINL AK在Thr浓度为10 mmol/L时被明显激活,相对酶活力为100.25%,NCINL AK的相对酶活力均高于同浓度抑制剂Thr条件下的WT AK和NCIN AK,说明突变能减弱甚至消除抑制剂Thr的抑制,与本实验的选点依据一致。当2种抑制剂同存在时,不同浓度的Lys+Thr条件下,激活作用随浓度增大而增大,说明突变后协同反馈抑制作用减弱,这与反应动力学结果n值减小一致。当3种抑制剂同时存在时,NCINL AK被明显激活,最大酶活可达131.57%。以上研究结果表明,叠加饱和突变能有效解除反馈抑制,NCINL AK在Lys或Thr单独存在时,均表现出激活作用,但NCIN AK在Thr单独存在时无激活作用,说明当抑制剂Lys和Thr结合位点都突变时,不同浓度的Lys和Thr均产生激活作用,这与本研究目的相符。不同配体周围关键残基位点的叠加突变效应具体机制有待进一步研究。
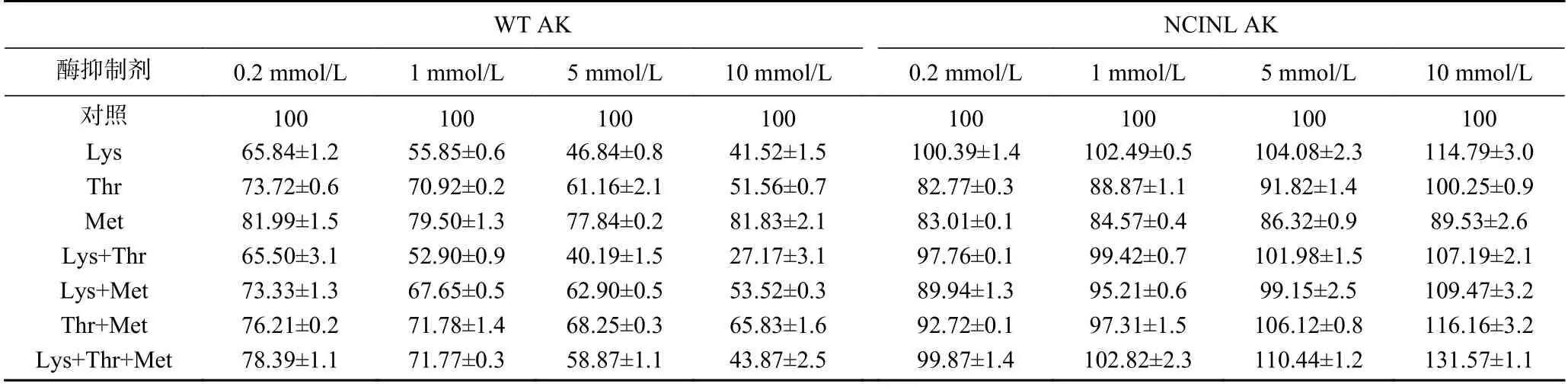
表3 不同底物抑制条件下WTAK和NCINL AK的相对酶活力(%)Table 3 Relative enzyme activity of WT AK and NCINL AK under different substrate inhibition conditions (%)
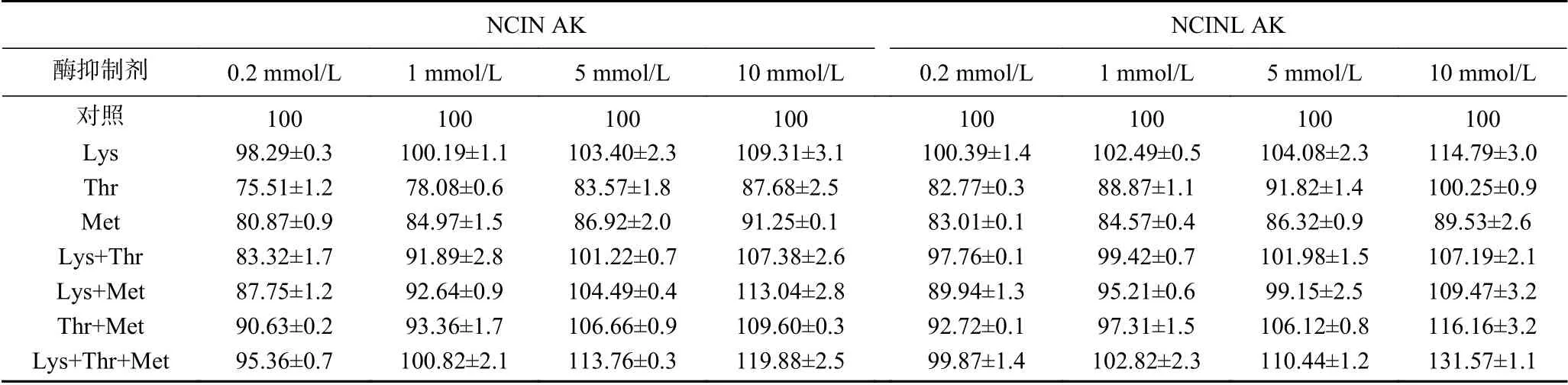
表4 不同底物抑制条件下NCIN AK和NCINL AK的相对酶活力(%)Table 4 Relative enzyme activity of NCIN AK and NCINL AK under different substrateinhibition conditions(%)
3 结论
本实验在北京棒杆菌天冬氨酸激酶(CpAK)四突变体NCIN AK的基础上,对抑制剂Thr结合位点Gly295进行定点饱和突变,成功构建五突变体NCINL AK。酶动力学结果显示,NCINL AK的相对酶活力较WT AK提高87.20倍,且高于NCIN AK,n值减小,呈正协同性降低,Km减小,增强了其与底物的亲和力。酶学性质研究结果表明:NCINL AK最适反应温度提高3℃,pH在6.5~7范围内时,酶活力高于WT AK和NCIN AK,相对酶活力在60%以上,半衰期由4.7 h延长至5.2 h,且改善了NCIN AK半衰期减小的情况,表现出较好的稳定性。NCINL AK在一些浓度抑制剂作用下有明显激活作用,不同浓度Lys条件下,抑制作用被完全解除,且不同浓度Thr条件下,抑制作用被部分解除,这表明五突变体能基本解除Lys、Thr对AK的反馈抑制作用,为解除末端产物对Cp AK的反馈抑制作用提供理论依据。本研究为优化CpAK代谢途径及构建对高温、酸性友好的高产天冬氨酸族氨基酸工程菌提供参考,为天冬氨酸族氨基酸大量积累提供可能。

