西藏产区葡萄表皮及根际土壤真菌群落结构组成分析
张二豪,赵润东,尹 秀,蔡 皓,禄亚洲,罗 章
(西藏农牧学院食品科学学院,西藏林芝 860000)
西藏昌都市芒康县和林芝市位于西藏东南部,该地区具有光照充足、阳光辐射强、土壤砂质深厚、昼夜温差大等独特的生态环境,为葡萄种植提供了得天独厚的环境条件,以此原料酿造的葡萄酒香气浓郁、口感饱满,因此,素有“中国野生红葡萄之乡”和“西藏红酒之乡”之称。
根际土壤微生物是葡萄园生态系统中的重要组成成分,在土壤能量转化和物质代谢等方面扮演着重要角色[1]。根际存在多种对植物有益的微生物类群,如生防菌、固氮菌及能产生植物生长激素的微生物,对植物生长发育、物质吸收和能量代谢影响较大,因此,其微生物多样性是土壤质量的重要评价指标[2−4]。葡萄表皮上的微生物复杂多样,其微生物群落结构组成对后续葡萄酒酿造及葡萄酒品质会产生一定的影响[5]。Bedriana等[6]研究表明,本土酵母与酿酒酵母共同发酵培养时,芳香类化合物含量显著增加,Bokulich等[7]在研究增芳德葡萄表皮微生物时发现Candida zemplinina真菌能够增强葡萄酒的感官品质。葡萄根际土壤及葡萄表皮微生物群落结构组成受地理因素、气候条件、葡萄品种和土壤理化性质等因素影响,魏玉洁等[8]在研究新疆产区葡萄果实、叶片及根际土壤微生物多样性时发现葡萄园地理位置不同,其微生物多样性存在差异,且Saccharomyces、Sordaria、Tetracladium和Geomyces是土壤中的优势真菌属,而葡萄表皮真菌以Aureobasidium、Cryptococcus、Aspergillus和Sporospora为主;王伟等[9]发现新疆四大产区葡萄园土壤微生物多样性存在显著差异,且Guehomyces、Gibberella和Tetracladium是土壤真菌的优势类群。杨敏等[10]发现香格里拉产区不同葡萄园间根际土壤菌群丰度存在差异,且土壤微生物群落受土壤电导率、有机质和速效钾含量影响;张世伟等[11]研究表明葡萄品种是影响其表皮微生物多样性的重要因素。综上所述,葡萄表皮及根际土壤微生物群落结构组成与其生长环境和葡萄品种等诸多因素有关。西藏独特的地理位置和气候环境,蕴藏着丰富的微生物资源,研究葡萄表皮及根际土壤真菌群落结构组成,对筛选和利用葡萄酒产区特色微生物具有重要意义。目前,有关国内外产区葡萄表皮、根际土壤微生物的研究较多[7−10,12],而西藏产区葡萄表皮及根际土壤微生物的研究尚未见报道。
高通量测序技术由于其通量大、准确性高、能基本反映自然界中微生物的真实情况等优点,在生物学研究中得到广泛的应用和发展[13−14]。因此,本文采用高通量测序技术对西藏昌都芒康和林芝2个产区黑珍珠葡萄园中的酿酒葡萄表皮和根际土壤真菌群落结构组成及多样性进行研究,揭示不同产区核心微生物菌群的作用,以期为筛选利用本土特色酿酒微生物提供理论依据。
1 材料和方法
1.1 材料与仪器
黑珍珠葡萄及葡萄根际土壤 于2019年9月分别从林芝市(纬度29°25'33.37"N,经度94°26'50.93"E)和昌都市芒康县(纬度29°1'53.1"N,经度98°36'21.77"E)采集并将样品命名如下:LG-林芝葡萄,MG-芒康葡萄,LS-林芝葡萄根际土壤,MS-芒康葡萄根际土壤;DNeasy Plant Mini Kit Qiagen,Germantown,MD,USA;2×Taq Master Mix,DNA片段纯化试剂盒 天根生化科技有限公司;真菌通用引物(ITS1和ITS2) Invitrogen公司。
Eppendorf 5424R高速冷冻离心机 德国Eppendorf公司;Bio-Rad T100 PCR仪 美国Bio-Rad公司;电泳仪 北京六一;NanoDrop2000微量分光光度计 美国Thermo公司;漩涡混合器XH-D沃信公司;Illumina Misq 测序平台 美国Illumina 公司。
1.2 实验方法
1.2.1 样品采集 随机选取20株生长良好的黑珍珠葡萄植株,并用无菌剪刀采集同一葡萄植株上、中、下3个部位的果实,置于无菌袋中,并混合均匀,低温运输至实验室,−20℃保存备用;按照田间根际土壤样品采集方法采集根际土壤样品[15],除去杂质并混合均匀,每组3个重复,放入无菌袋中,低温保存并带回实验室,−20℃保存备用。
1.2.2 根际土壤理化性质分析 按照《土壤农化分析》[16]操作步骤测定根际土壤样品中的总磷(TP)、总钾(TK)、总氮(TN)、有效磷(AP)、有效氮(AN)、p H、电导率(EC)和有机质(SOM)含量。
1.2.3 样品总DNA提取 称50 g葡萄果实,加入200 mL PBS缓冲液(0.1 mol/L,p H7.0),200 r/min涡旋振荡30 min,超声15 min,0.22μm(Millipore,USA)微孔滤膜过滤,用无菌剪刀剪碎滤膜并放入无菌离心管中[11]。按照DNeasy Plant Mini Kit(Qiagen,Germantown,MD,USA)操作步骤提取新鲜葡萄表皮和根际土壤样品总DNA,琼脂糖凝胶电泳检测所提DNA的质量,并在NanoDrop ND-2000紫外分光光度计下检测所提DNA的浓度和纯度。
1.2.4 样品PCR 利用真菌转录间隔区(ITS)的通用引物对核糖体DNA的ITS1-ITS2区域进行PCR扩增,引物为ITS1F(CTTGGTCATTTAGAGGAA GTAA)和ITS2R(GCTGCGTTCTTCATCGATGC)。PCR反应扩增体系(20 μL)如下:10×PCR Buffer 2.0 μL,10 mmol/L ITS1F和ITS2R引物各1μL,5 mmol/L dNTPs 1μL,5.0 U/μL rTaq酶0.2 μL,DNA模板1μL,补dd H2O至20μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,35个循环;72℃延伸10 min,4℃保存。琼脂糖凝胶电泳检测PCR扩增产物,纯化后委托上海美吉生物医药有限公司进行高通量测序。
1.3 数据处理
利用QIIME(Version 1.9.1)对Illumina MiSeq测序所得原始数据进行去杂、优化、α多样性和主坐标分析(Principal coordinates analysis,PCoA);α多样性指数包括Chao1指数、Shannon指数、Simpson指数和均匀度指数(Shannoneven),其中Chao1指数值越大,说明丰富度越高;Shannon指数值越大,Simpson指数值越小,说明群落多样性越高;在97%相似度下,利用UPARSE(7.0.1090)软件进行OTU聚类;通过RDP classifer(Version 11.5)软件将OTU代表序列与真菌UNITE数据库比对,进行物种注释并统计各样本在各分类水平下的相对丰度和群落组成;利用Mothur(Version 1.30.2)软件进行α多样性分析;利用R语言进行韦恩图、冗余分析(RDA,redundancy analysis)和热图制作。
2 结果与分析
2.1 样品根际土壤理化性质分析
根际土壤理化性质由表1可知,MS样品中的总磷(TP)、总氮(TN)、速效氮(AN)、电导率(EC)和土壤有机质(SOM)含量均显著高于LS,而MS样品中的速效磷(AP)含量显著低于LS(P<0.05),但两地样品中的总钾(TK)含量无显著差异,两地土壤pH差异显著(P<0.05),LS土壤偏酸性,而MS土壤偏碱性。

表1 样品根际土壤理化性质分析Table 1 Physical and chemical properties of rhizosphere soil samples
2.2 样品真菌群落多样性分析
本研究共获得546888条有效序列,隶属12门,37纲,86目,176科,357属;LG、MG、LS和MS样品所产生的OTUs数分别为114、150、297和794。LG样品中所获得的OTUs低于MG,MS样品中所获OTUs显著大于LS。稀释曲线分析结果如图1A所示,随着测序深度的增加,稀释曲线逐渐趋于平坦,各样本的测序覆盖度均大于99.99%,说明此次测序结果能基本反映样品中真菌群落结构组成的真实情况。韦恩图分析结果如图1B所示,4个样本中共获得的物种数为1008种,共同拥有的物种数为22种,LG和MG共同拥有的物种数为46种,LS和MS共同拥有的物种数为140种,LG、MG、LS和MS样品中特有物种数分别为17、47、121和593种。α多样性分析结果如表2所示,MS样品中真菌群落多样性和丰富度指数最高,MG样品中真菌群落均匀度指数最高,而LG样品中真菌群落多样性、丰富度和均匀度指数最低。总体而言,芒康地区葡萄和根际土壤真菌种类最多,多样性指数最高,这可能与芒康土壤性质有关,芒康葡萄园土壤以腐殖土为主,而林芝葡萄园土壤以沙土为主。
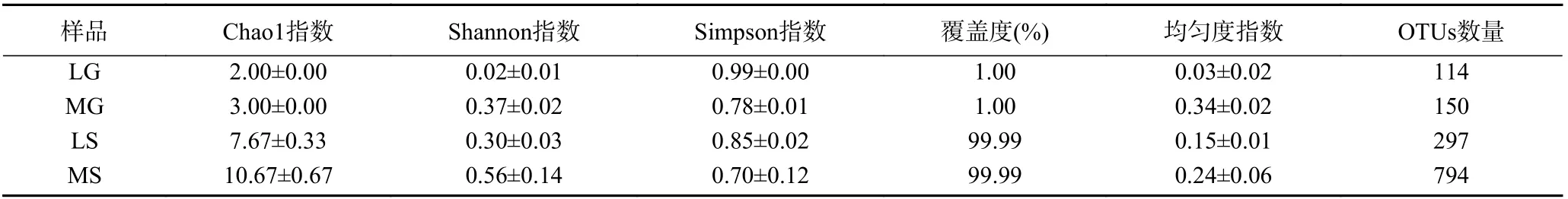
表2 样品真菌群落多样性Table 2 Fungal diversity indexes in different samples
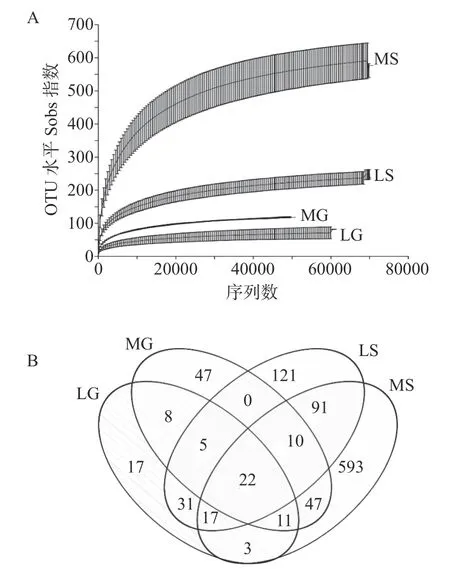
图1 稀释曲线(A)和OTU韦恩图(B)Fig.1 Rarefaction curves(A)and Venn chart of OUT(B)
2.3 样品真菌群落组成分析
样品真菌在门分类水平相对丰度如图2所示,不同样品真菌群落结构在门分类水平组成差异较大,LG样品门数最少,为2个门,MS最多,为11个门。子囊菌门(Ascomycota)和担子菌门(Basidiomycota)在不同样品中广泛存在,它们的相对丰度分别为76.06%~99.60%、0.40%~12.21%。Mortierellomycota是MS中的次优势菌门,其相对丰度为20.17%,壶菌门(Chytridiomycota)、油壶菌门(Olpidiomycota)、芽枝霉门(Blastocladiomycota)和Kickxelomycota是MS样品中特有的门,其平均相对丰度分别为0.12%、0.06%、0.01%和0.003%,而Mucoromycota是LS样品中特有的门,其平均相对丰度为0.03%。
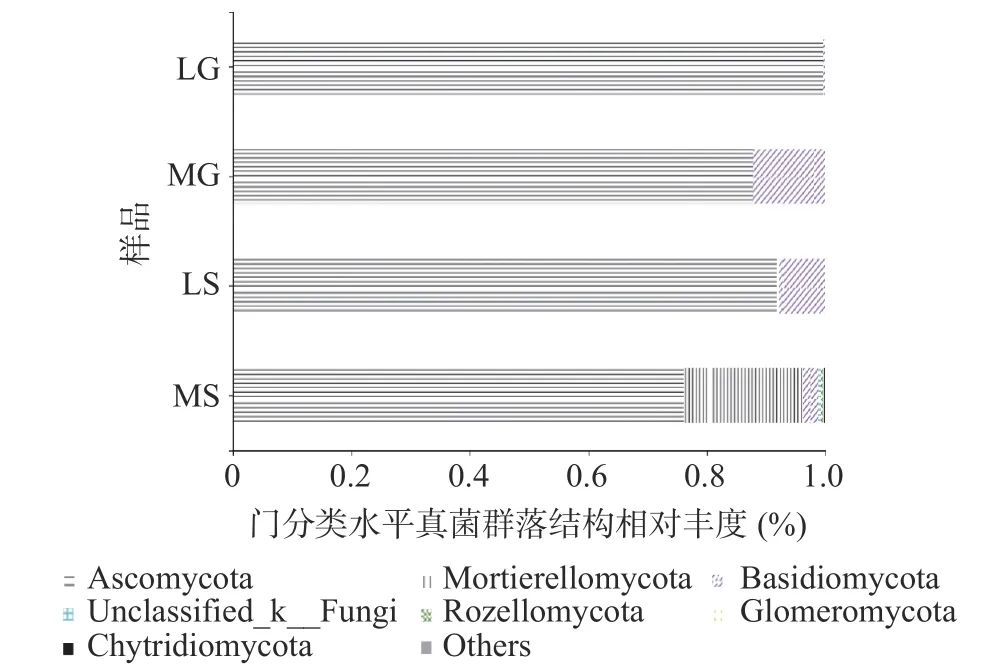
图2 样品真菌门分类水平群落结构组成Fig.2 Composition of fungal community in the samples at phylum level
属分类水平群落结构组成如图3所示,枝孢属(Cladosporium)和青霉属(Penicilium)是LG样品中的优势属,其平均相对丰度分别为64.43%和23.31%;MG样品中的优势属是汉逊酵母属(Hanseniaspora)、枝孢属(Cladosporium)和毕赤酵母属(Pichia),其平均相对丰度分别为31.59%、26.78%和18.71%;镰胞菌属(Fusarium)、青霉属(Penicilium)和枝孢属(Cladosporium)是LS样品中的优势属,其平均相对丰度分别为50.02%、10.15%和8.18%;MS样品中的优势属是被孢霉属(Mortierella)、unclassified_f_Didymellaceae和青霉属(Penicilium),其平均相对丰度分别为20.16%、10.72%和7.82%。样本聚类分析表明,不同地区的葡萄表皮和不同地区的根际土壤真菌被聚为一类。以上结果表明,不同样品中的优势属群落结构组成差异较大,而不同地理位置环境下的葡萄表皮和根际土壤真菌群落组成相似。
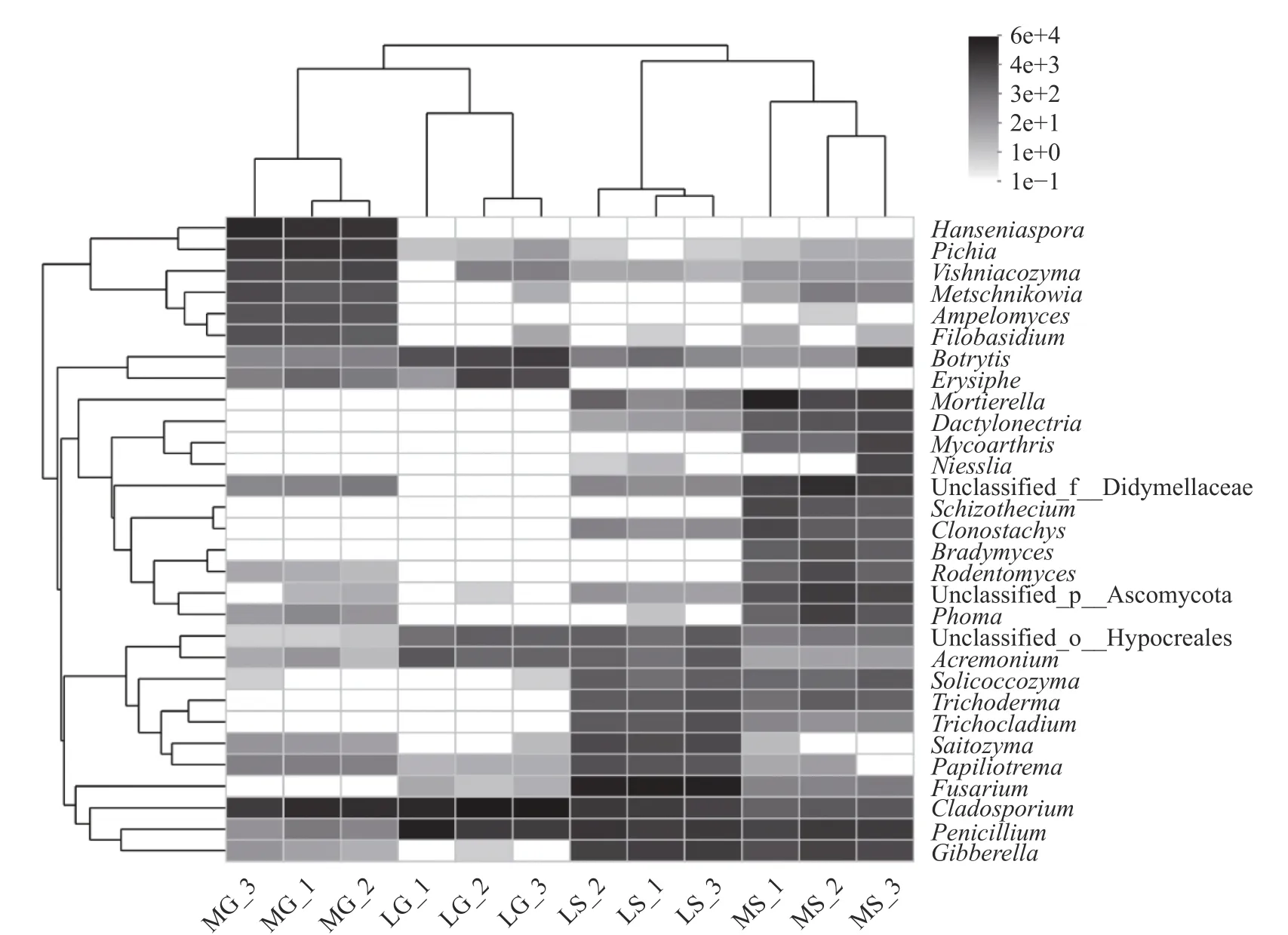
图3 样品真菌属分类水平群落结构组成热图Fig.3 Composition of fungal community in the samples at genuslevel
2.4 样品真菌群落聚类分析
主成分分析(Principal coordinate analysis)结果如图4所示,主成分分析PC1和主成分分析PC2对群落结构组成差异的贡献率分别为39.98%和24.48%,合计64.46%,是差异的主要来源,能够很好的区分不同地区的葡萄和根际土壤样品。样本层级聚类分析如图5所示,不同地区的葡萄样品和根际土壤样品聚为一类,说明不同地区的葡萄和不同地区的根际土壤样品真菌群落结构组成相似。
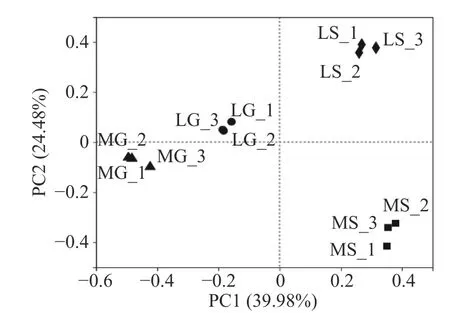
图4 真菌群落PCA分析Fig.4 Principal coordinate analysis of fungal communities

图5 UPGMA聚类分析Fig.5 UPGMA cluster analysis
2.5 门分类水平样品真菌群落结构与环境因子冗余分析
土壤理化性质对真菌群落结构的影响如图6所示,TK、TP、AN、TN和p H对真菌群落结构组成有影响,其中TK影响最大,而AP、SOM和EC不影响真菌群落结构组成;MG样品真菌群落结构与TP、AN、TN和pH呈正相关,而与TK呈负相关,LG和MS则相反,LS样品与TK呈正相关,而与TP、AN、TN和pH呈负相关。在门分类水平上,子囊菌门(Ascomycota)丰度变化与TK、TP、AN、TN和p H呈负相关,而Mortierellomycota丰度变化与TP、AN、TN和TK呈正相关,与p H呈负相关,而担子菌门(Basidiomycota)丰度变化与TP、AN、TN和pH呈正相关,而与TK呈负相关。
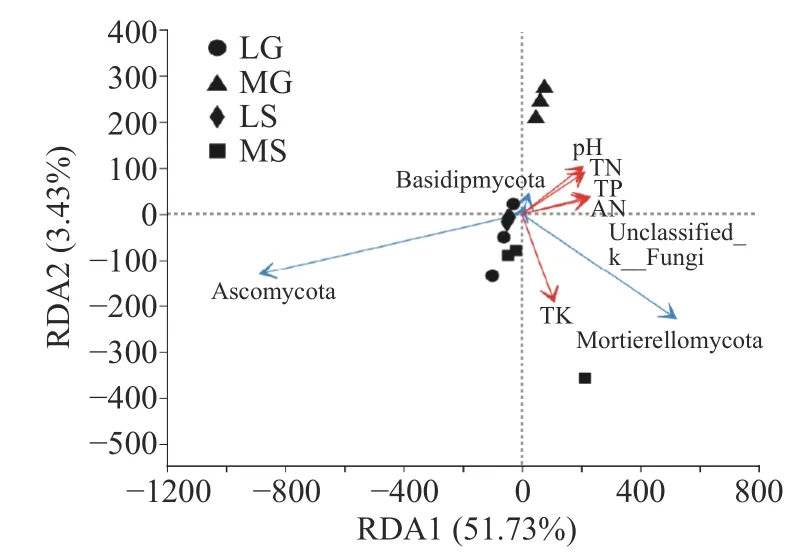
图6 真菌群落结构与环境因子的冗余分析Fig.6 Redundancy analysis biplot between the fungal community and environment factor
3 讨论与结论
本研究利用Illumina Miseq测序技术对西藏产区昌都芒康县和林芝市两个地区的葡萄表皮及根际土壤真菌群落结构进行分析。结果表明,MS样品中的总磷、总氮、速效氮、电导率和土壤有机质含量均显著高于LS,这可能与土壤类型有关,MS以腐殖质为主,而LS以沙土为主;有研究表明,根际土壤作为一个天然的微生物资源库,为微生物生长提供必需的营养物质[8,17],杨敏等[10]发现香格里拉产区葡萄根际土壤微生物群落受土壤电导率、有机质和速效钾含量影响。在门分类水上,子囊菌门(Ascomycota)是葡萄表皮和根际土壤真菌的优势菌门,Pinto等[18]和Stevanato等[19]研究表明,子囊菌门(Ascomycota)是葡萄和根际土壤真菌的优势类群,这与本文研究结果一致。MS样品中检测到的真菌门最多,而LS样品中检测到相对较少的真菌门,这可能是两地土壤理化性质有关[20−23]。在属分类水平上,枝孢属(Cladosporium)和青霉属(Penicilium)是LG样品中的优势属,而MG样品中的优势属是汉逊酵母属(Hanseniaspora)、枝孢属(Cladosporium)和毕赤酵母属(Pichia),两地葡萄表皮真菌差异较大,这可能与两地葡萄栽培、管理和杀菌剂等因素有关[24]。魏玉洁等[8]在研究新疆产区葡萄果实时发现葡萄表皮真菌以Aureobasidium、Cryptococcus、Aspergillus和Sporospora为主,赵昱等[25]研究表明短梗霉属(Aureobasidium)和红酵母属(Rhodotorula)是四个产区赤霞珠葡萄表皮真菌的优势属,与本文研究结果差异较大,可能与气候环境和葡萄品种等因素有关。两地根际土壤真菌群落组成差异较大,土壤微生物群落结构和功能受果园土壤理化性质及果园果树自身种类、覆草、施肥、农药等因素影响[26−27],因此以上因素可能是导致两地根际土壤真菌群落组成差异的关键因素。α多样性分析发现,MS样品真菌多样性、均匀度和丰富度指数明显高于LS,且MG明显高于LG,可能与两地土壤理化性质、施肥及水源等因素有关,张翔等[28]研究发现生物有机肥可显著提高果园土壤微生物的丰富度和多样性,赵昱[25]研究发现不同产区酿酒葡萄微生物存在的差异性可能与气候、水源、栽培等因素有关,杨敏等[10]研究发现气候和土壤差异可能是导致根际微生物差异的重要原因。
众所周知,酵母菌是葡萄酒酿造的关键菌株,目前已报道的与酿酒相关的酵母菌高达24属120余种。酵母菌在酿造过程中能够将糖类物质转化为乙醇及其他次生代谢产物并释放多种香气物质,同时能够抑制细菌生长;Bedriana等[6]研究表明,本土酵母与酿酒酵母共同发酵能够增加芳香类化合物和风味物质的合成,提高葡萄酒的香气,本文在MG样品中检测到大量汉逊酵母属(Hanseniaspora)、Metschnikowia、Vishniacozyma和毕赤酵母属(Pichia),说明芒康地区葡萄富含与酿酒相关的酵母菌,可为本地酿酒酵母菌株的筛选、开发和利用提供理论依据。
本研究通过高通量测序技术对西藏两个地区葡萄表皮和根际土壤真菌群落结构组成的进行分析。结果表明,两地土壤理化性质差异较大,RDA分析可知,总磷、总氮和速效氮对真菌群落结构组成影响较大;MS样品真菌多样性、均匀度和丰富度指数均明显高于LS,且MG明显高于LG;在门水平,各样品中的优势菌是子囊菌门(Ascomycota),在属水平,各样品的优势属差异较大,枝孢属(Cladosporium)、汉逊酵母属(Hanseniaspora)、镰胞菌属(Fusarium)和被孢霉属(Mortierella)分别是LG、MG、LS和MS样品的优势属;主成分分析及样本聚类分析表明,不同地区的葡萄表皮和根际土壤真菌群落组成相似,这可能与样品特异性等因素有关;同时在芒康地区发现较多与酿酒相关的酵母菌,可为本地酿酒菌株的筛选和利用提供理论依据。

