体外培养细胞中细胞器的分离与纯化
周梦,史熊杰
(武汉大学 生命科学学院,湖北武汉 430072)
在真核生物中,细胞内部被严格地组织成分门别类的细胞器[1],它们各自拥有特殊的结构特征以及动态特性,发挥着不同的生物学功能。为了研究某一特定细胞器的微观结构、生化组成以及特定的功能,需要将其从细胞中分离纯化出来。在这个过程中,要求纯化的细胞器结构完整、形态与细胞内无异、具有生物学活性,在数量足够基础上,提高纯度、节省时间、提高效率、节约经济成本。如在蛋白质组学的研究中,需要分离纯化出纯度较高的细胞器,以满足电泳或色谱分离要求,从而建立相应的细胞器蛋白质组数据库[2]。因此,针对分离的目的和后期鉴定要求,选择合适细胞破碎溶剂、破碎方法以及分离纯化方式对于纯化的细胞器至关重要。细胞器分离纯化方法分为离心分离、亲和免疫纯化分离、自由流电泳分离、荧光激活细胞器分选、光学镊子和激光捕获显微解剖、双向电泳分离等[3],本文主要介绍离心和亲和纯化两种分离方法,对这两种分离纯化方法的原理、操作步骤以及特点讨论分析。
1 细胞器的释放
理想的匀浆是成功分离纯化细胞器的第一步,即细胞器等细胞成分能完整、均一地分布在匀浆液中[4]。在匀浆过程中,经常观察到细胞质聚集体,这是因为细胞破碎不充分或不当,细胞器与围绕在细胞核周围的细胞骨架元素相联系,或被困在大的聚集物中,形成大的细胞沉积团块。这会导致在去除核的初始离心步骤中,细胞器大量损失,因此必须优化每个细胞系的均匀化条件[4]。
1.1 溶剂的选择
在离心分离细胞器过程中,适用的溶剂通常是由细胞器的种类决定的[5],每一步分离溶液成分都有所变化。最开始分离细胞器是以大鼠肝脏和其他软组织为原材料,以离心分离为基本方式纯化,因此这些试剂是以动物组织中细胞器分离的目的而发明的,通常含有蔗糖作为渗透平衡剂。许多培养的细胞也可以在通用培养基或其他类似的等渗培养基中均质[6],但如果是在低渗介质中进行均质,则应尽快调整到推荐的蔗糖和其他添加剂浓度。本文列举以下离心分离常见溶剂体系。(1)通用的匀浆溶剂:0.25 mol/L 的蔗糖,1 mmol/L 的EDTA,10 mmol/L 的Hepes-NaOH(或10 mmol/L 的Tris-HCl),pH=7.4;(2)细胞核:与通用的体系基本相同,只是将1 mmol/L的EDTA 换成25 mmol/L 的KCl,5 mmol/L 的MgCl2;(3)过氧化物酶体:在通用的体系上加入0.1%的乙醇;(4)线粒体:0.2 mol/L的甘露醇,50 mmol/L的蔗糖,1 mmol/L 的EDTA,10 mmol/L 的HEPES-NaOH,pH=7.4。
亲和纯化分离细胞器中,一般采用磷酸盐缓冲溶液(Phosphate Buffer Saline,PBS)作为溶剂,其主要成分是Na2HPO4、KH2PO4、NaCl 和KCl,其中Na2HPO4和KH2PO4可以通过二级解离起到缓冲作用,而NaCl 和KCl 主要作用为增加盐离子浓度,使细胞里pH 和渗透压保持不变,最大限度起到保护细胞的作用。对于特殊的细胞器纯化,可在PBS 补加1 mmol/L 的CaCl2和0.5 mmol/L 的MgCl2,提供二价阳离子。虽然PBS 适用范围很广,但是针对于某些细胞器的亲和纯化需要改进溶液体系,如加入KCl的缓冲液可以分离出能够支持膜电位的耦合的线粒体[7]。因此,2016 年来自于剑桥大学CHEN 等[8]开发了一种仅由KCl 和KH2PO4组成的LC/MS 兼容的缓冲液KPBS,能显著提高纯化效率。越来越多的学者选择KPBS 来代替PBS,不仅局限于纯化线粒体,也包括溶酶体和过氧化物酶体等[1]。
1.2 细胞破碎
常见的细胞破碎方法分为玻璃匀浆器法、超声波破碎法、化学法和液氮反复冻融法。
(1)玻璃匀浆器法。玻璃匀浆器法是最常用的细胞器破碎方法,匀浆器一般由一根底端为球形表面磨砂的玻璃杆和一个内壁磨砂的玻璃套管组成,研钵磨球和玻璃管内壁之间间隙保持在几微米距离。使用时,将剪碎的组织或细胞悬液加入匀浆管中,然后将研磨杆放入玻璃套管上下移动数次,即可将细胞破碎。
(2)超声波处理法。超声波破碎仪能产生固定频率的超声信号,声波形成冲击和振动会产生一定的剪切力,致使细胞破碎。超声破碎仪耗时短且省力,但是在超声时会产热,因此在超声时应将材料置于冰浴中,避免温度升高造成生物大分子失活。
(3)化学裂介法。处理前,常需要在破碎过程中加入表面活性剂,常见的表面活性剂有Triton-100、NP-40、SDS 以及脱氧胆酸钠等,然后加以机械辅助,如用针头裂解。这类化学试剂可以改变细胞膜的通透性使生物大分子从细胞中释放出来,从而达到细胞破碎的目的,注意后续操作中应将这些表面活性剂清除,避免影响分析。
(4)反复冻融法。将制备好的组织或细胞悬液放在液氮中冷冻后,然后在室温或者37 ℃融化,经过3 ~4 次冻融周期,可使细胞破碎。
2 细胞器的分离纯化
2.1 离心分离纯化法
2.1.1 背景及原理
离心法分离中离心转子的旋转产生离心场和离心力,离心力作用于离心场中的粒子并取决于粒子的质量、旋转速度和离旋转中心的距离[9]。离心分离技术原理非常简单,根据细胞器的大小、密度、沉降系数不同,采用逐渐增加离心速度或低速和高速交替进行离心,使沉降速度不同的颗粒在不同的分离速度及不同的离心时间下分批分离的方法。1974年,来自洛克菲勒和纽约大学的DUVE、CLAUDE 和PALADE 发现并总结了现代微观分析技术和密度梯度离心的基本原理,并使用离心技术成功分离来自大鼠肝脏的细胞器而共同获得了诺贝尔生理学或医学奖[10]。如今,随着离心机种类增多和功能不断完备,离心技术已经成为实验室中分离细胞器使用最广泛和可信的手段,离心机的分类(按转速)见表1。

表1 离心机的分类(按转速)
2.1.2 离心分离过程
在离心分离纯化细胞器过程中,分为差速离心和密度梯度离心。差速离心是根据离心机不同转速下产生不同离心力,将各种细胞器进行分离的,其一般操作过程如图1 所示。

图1 差速离心的一般过程
因此,差速离心需要多次离心以达到分离不同组分的目的。尽管如此,得到的细胞器纯度并不高,所以实验室在分离纯化细胞器的过程中往往还会在差速离心分离的基础上,将得到的沉淀利用密度梯度离心进行再分离。
密度梯度离心法是由BRAKKE 在1951 年发明的[9],用于根据物质的密度分离样品。用这种方法分离细胞器,梯度液的配制是一个要点,常见的配制梯度液的介质有蔗糖、Ficoll[11]、Percoll、碘化介质(OptiPrep,Nycodenz 及metrizamide)等[12]。因蔗糖溶液配制简单,材料易得而且价格低廉,实验室中多采用蔗糖作为密度梯度液来分离细胞器。但是蔗糖本身在不同密度都具有一定的渗透性,分离渗透性敏感的细胞器如溶酶体,需要用其他材料代替。
根据以往的文献报道,密度梯度离心分离纯化细胞器常见的介质以及转速如表2 所示。
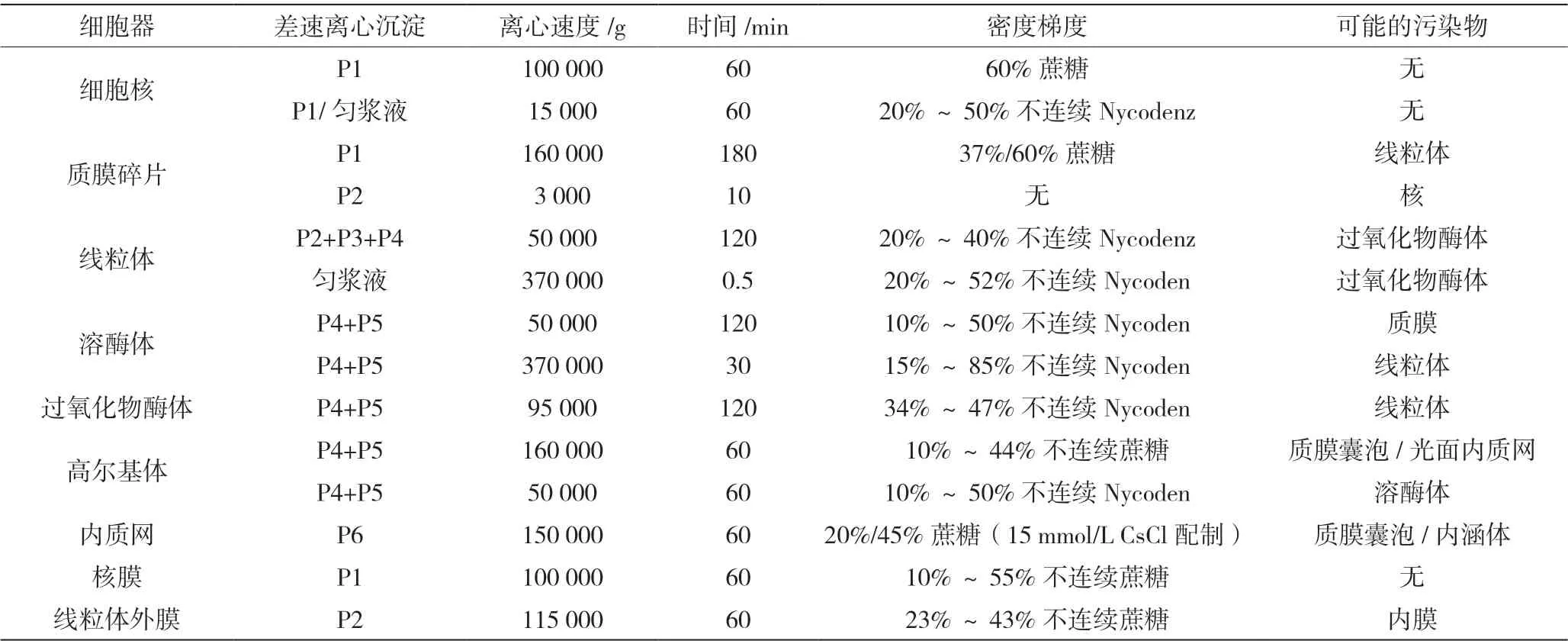
表2 细胞器分离推荐使用的密度梯度和离心条件
总的来说,用离心分离法纯化细胞器可以处理大批量材料,成本低,适用性广。但是离心分离法的缺陷也很明显:第一,纯度低,达不到生化分析尤其是在蛋白质组学分析要求[1];第二,耗时耗力,不适用于分析细胞内某些信号分子或者不稳定小分子代谢物,如溶酶体携带了氧化铁共轭右旋糖酐后,离心分离无法去除这部分溶酶体[13],因为随着载入和追逐时间的延长,梯度液在不同的核内体和溶酶体中都有不同程度的富集[14],且长期积累不可降解的右旋糖酐可能会对溶酶体功能产生一些意想不到的影响[15];第三,离心分离过程中需要的各种类型的离心设备价格昂贵,对于缺乏相应设备的实验室来说可能无法进行相关实验。
2.2 亲和纯化
2.2.1 原理及背景
亲和纯化,最开始被称为免疫分离。1978 年ITO和PALADE 提出了免疫分离亚细胞器的方法,随后多个研究小组以此为基础进行了方法研究,每种方法都使用了不同的固体载体和原理[16]。亲和纯化依赖于暴露在抗原外表面的抗原位点的存在,利用抗原抗体特异性识别结合特性,而不是细胞器的物理特性。识别抗原的抗体通常与一个固体载体结合,一般称为磁珠,通过含有特异性抗体的磁珠将细胞器与其他成分分离,因此亲和纯化的限制性因素是特异性抗体的制备[3]。而细胞器标志蛋白的发现、抗体数量增加和蛋白标记技术飞速发展使这项技术得到了广泛的应用。
2.2.2 纯化过程
亲和纯化一般流程如图3 所示。以从体外培养的细胞中纯化细胞器为例,实验室常用的做法是构建稳定特异性表达细胞器标志蛋白和标签蛋白的融合蛋白的细胞株,将一定量的细胞株匀浆后,用匀浆液与磁珠结合一定时间,用等渗缓冲液清洗和去除不必要的污染物,最后用多肽或者其他竞争性洗脱液洗脱。细胞器亲和纯化技术可用于分离包括质膜[17]、突触囊泡[18]、叶绿体[19]、线粒体[20]、过氧化物酶体[21]和溶酶体[22]等细胞器。
相对于离心分离,亲和纯化分离细胞器优势明显:(1)速度快,对于分析某些信号分子和代谢物来说适用;(2)特异性强,分离纯化得到的细胞器纯度高;(3)分离过程中不涉及一些大型的实验设备和复杂的过程,可操作性强,从而克服了传统方法的一些缺点。但是,亲和纯化分离细胞器也有包括抗体亲和纯化需要大量的抗体、用多肽洗脱细胞器效率不高等问题。
3 细胞器纯化分离后鉴定
细胞器纯化分离后需要鉴定细胞器的纯度和完整性。常见的鉴定细胞器完整性方法是胰蛋白酶消化实验、定量Western Blot 鉴定纯度辅助质谱分析。用双向凝胶电泳也可以对分离的细胞器组分进行定量和定性分析[17]。对于所有组分的形态分析,可以采用标准的电子显微镜程序[4]。
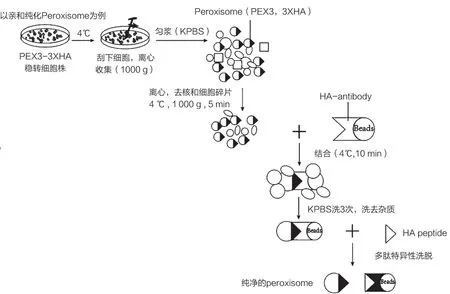
图2 亲和纯化一般流程
4 结语
随着现代生物学的发展,人们对各种细胞器的功能以及相关蛋白的研究越来越深入。高效快速的分离纯化纯度较高的单个细胞器对于后续蛋白质组学分析起着重要作用。因此,在纯化分离细胞器的过程中应该根据实验目的,在试剂、破碎方法、纯化方式中综合设计最佳方案。
传统的离心分离处理批量大、适用性广、稳定可靠,但处理过程耗时耗力而且有时达不到理想的纯度。亲和纯化是现在比较受欢迎的纯化方式,纯化速度快,特异性强,纯度高,但适用于小批量纯化,受限于抗体的可用性,且磁珠价格昂贵。未来生物学的发展将不断改进这些试验方法的缺陷,细胞的分离纯化方式将会得到更进一步完善。
——可作为磷酸盐库再利用!

