基于高通量测序的设施连作果类菜根际土壤细菌群落结构和多样性分析
姜 伟,白红梅,薛国萍,杜金伟,高 婧,李 杰,慕宗杰,胡玉珍,宋庆成
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.赤峰市农牧科学研究院,内蒙古 赤峰 024031;3.宁城县农牧局,内蒙古 宁城 024200)
土壤微生物作为温室土壤生态系统中的重要组成部分,土壤中80%~90%的反应中均有微生物参与,有助于作物的营养获取,并承担着养分循环、分解、作物生产及病虫害防治的作用,同时与植物保持着十分密切的互作关系[1],因此不同蔬菜连作生产中会引起土壤微生物群落结构的变化[2],细菌作为微生物中含量最多、丰富度最高的类群,在土壤生态过程中有着不可或缺的地位,因此加强对土壤细菌群落的研究就显得极为重要。
截止到2016年我国设施蔬菜栽培面积达到370万 hm2[3]。而随着设施农业产业化和集约化的发展,许多地方出现了“一乡一品”、“一村一品”的种植模式,蔬菜的种植种类单一,导致单一作物的复种指数增加[4-5],加剧了土壤的连作障碍。作物的连作通常导致土壤微生物多样性减少,使土壤细菌群落结构趋于简化,土壤微生态环境恶化[6],最终降低作物产量[7]。目前,土壤连作障碍已经成为限制设施蔬菜栽培可持续发展的重要因素之一[8]。研究表明,土壤微生物群落结构和多样性除了受温度、土壤养分、土壤类型和土壤管理等[9-10]的影响外,还包括植被类型的影响。关于土壤微生物群落多样性与植被关系的研究主要在不同植被类型[11-12]、土地管理方式[13-14]、病害[14]、植被的不同演替阶段[15]等方面,但关于设施连作不同果类菜对根际土壤微生物群落结构和多样性影响的研究较为鲜见。本研究以露地土壤为对照,分别对比连作5 a的番茄、黄瓜、茄子、辣椒等作物的根际土壤细菌群落结构和多样性,探讨设施连作的不同果类菜是否会对土壤细菌群落造成影响,旨在从设施果类菜根际土壤微生物方面入手,为设施连作作物的生产实践和可持续种植提供理论基础。
1 材料和方法
1.1 供试材料
试验土样为内蒙古设施蔬菜主产区赤峰市宁城县大城子镇万亩番茄基地、一肯中乡辣椒和茄子基地、大双庙镇黄瓜基地连续栽培5 a的日光温室土样,2018年3月在大城子镇瓦南村采集连作番茄根际土壤,2018年6月在大双庙镇、一肯中万家营子村和葛家窝村分别采集黄瓜、辣椒和茄子根际土壤,所有根际土壤均在果类菜拉秧前取样,每种果类菜取3个根际土样,露地土壤分别在4种果类菜相邻露地各取1份土样,供试土样16份。
1.2 采样点基本情况
宁城县位于内蒙古自治区赤峰市南部,地处燕山山脉东段北缘,处于东经118°21′26″~119°55′25″,北纬41°16′17″~41°57′53″。该地属于温带半干旱大陆性季风气候,四季分明,冬季严寒少雪,夏季雨量集中,多在7,8月份,春秋两季南北气流交互剧烈,形成多风少雨的特点,日照时数2 800~3 100 h。年降雨量430~500 mm,蒸发量约1 517 mm。试验地从2013-2018年种植同一个蔬菜,番茄一年两茬,越夏茬每年3月底4月初开始种植,到9月初拉秧清棚;越冬茬9月底10月初种植,翌年3月拉秧清棚。黄瓜、辣椒、茄子一年一大茬栽培,每年9月中旬至10月初定植,翌年6月初拉秧清棚。4种果类菜基肥为农家肥250 m3/hm2、氮磷钾复合肥900 kg/hm2、抗重茬菌肥60 kg/hm2,番茄一年两茬,追肥12次、黄瓜一年一大茬,追肥16次、茄子和辣椒一年一大茬追肥14次,盛果期每10 d追肥1次,每次施氮磷钾复合肥和高钾肥450 kg/hm2。
1.3 土壤样品的采集
土壤样品的采集采用抖根法。于2018年3,6月作物拉秧前采集各供试果类菜的根际土壤,每种蔬菜种类取3个重复,每个重复随机取5个样点,每样点选取3株作物,先铲去作物根际表层0~5 cm的土壤,取5~20 cm附着于根毛上的土壤装入无菌自封袋后充分混匀后,装进外旋冻存管保存液氮处理后保存在-80 ℃冰箱中,用于土壤微生物的测定。
1.4 土壤细菌的测序分析
土壤细菌DNA的提取:利用土壤DNA抽提微生物群落总DNA,用1%琼脂糖凝胶电泳检测抽提基因组DNA,确保提取质量,用NanoDrop2000超微量紫外分光光度计选取DNA纯度和含量较高的样品进行下一步的试验。
PCR扩增及产物的纯化:使用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对16S rRNA基因V3~V4 可变区进行 PCR扩增,PCR反应条件:预变性95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;然后72 ℃稳定延伸10 min,最后10 ℃进行保存。用2%的琼脂糖凝胶电泳进行检测,并使用AXYGEN公司的AxyPrepDNA纯化回收试剂盒回收。PCR回收产物后,并用QuantusTMFluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTFLEX®Rapid DNA-Seq Kit进行建库:①接头链接;②使用磁珠筛选去除接头自连片段;③利用PCR扩增进行文库模板的富集;④磁珠回收PCR产物得到最终的文库。最后将PCR产物利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
高通量测序的结果分析:本研究进行的高通量测序数据分析均基于上海美吉生物医药科技有限公司所提供的云服务(https://www.https://cloud.majorbio.com)进行,项目号为MJ20190704156. 所用到的数据分析软件和算法参考上海美吉生物医药科技有限公司官方网站的说明。
2 结果与分析
2.1 不同果类菜根际土壤测序结果分析
利用NanoDrop2000测定DNA浓度和纯度;使用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对16S rRNA基因V3~V4可变区进行 PCR 扩增测序,共得到有效序列768 560 条,平均长度447~525 bp,其中包含44个门、150个纲、364个目、575个科和1 046个属。经筛选后,露地(CK)、番茄(T)、黄瓜(C)、辣椒(P)、茄子(E)的根际土壤样品分别得到44 331,57 647,49 424,48 616 和41 391条高质量序列(表1)。其中稀释曲线可以用来比较测序数量不同的样本物种丰富度,也可说明样本的取样大小是否合理。由图1可知,各处理土样的稀释曲线均趋于平缓,说明该测序深度包含了样品中绝大多数细菌类型,表明测序量合理,可以用来研究细菌的群落结构。

表1 不同作物根际土壤有效序列数Tab.1 Number of effective sequences in different crop rhizosphere soils

图1 各样本中OTU数的稀释曲线图Fig.1 Sparse graph of OTUs in each sample
2.2 不同果类菜根际土壤细菌群落结构
2.2.1 不同果类菜根际土壤OTU数 由图2可知,露地(CK)、番茄(T)、黄瓜(C)、辣椒(P)和茄子(E)的OTU总数分别为4 715,4 136,4 128,4 362,3 983。5个样本共有的OTU数为1 584个,露地(CK)、番茄(T)、茄子(E)、辣椒(P)和黄瓜(C)特有的OTU数分别为806,217,326,312,331,其余OTU为样本两两共有的。其中露地(CK)土壤样本中特有的OTU数最多,说明该样本中含有较多的特有微生物种类。
2.2.2 不同果类菜根际土壤细菌门水平群落结构 由图3可知,各果类菜根际土壤优势细菌门基本相同,其中变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)和芽单胞菌门(Gemmatimonadota)为优势菌门,优势菌门占各果类菜细菌群落总数分别为露地84.56%、番茄83.02%、黄瓜82.21%、辣椒80.67%、茄子79.25%。但各果类菜中细菌门所占相对丰度大小存在差异,如变形菌门在黄瓜(C)中相对丰度最高,为31.53%,在露地(CK)中最低,为22.34%,高低次序为:黄瓜>辣椒>茄子>番茄>露地;绿弯菌门在番茄(T)处理中最高,为20.37%,在露地(CK)处理中最低,为12.47%,高低次序为:番茄>茄子>黄瓜>辣椒>露地;酸杆菌门在露地(CK)中最高,为18.98%,在番茄(T)中最低,为5.16%,高低次序为:露地>辣椒>黄瓜>茄子>番茄;放线菌门在番茄(T)中最高,为23.56%,在黄瓜(C)中最低,为4.95%,高低次序为:番茄>露地>茄子>辣椒>黄瓜;拟杆菌门在黄瓜(C)中最高,为9.34%,在番茄(T)中最低,为4.87%,高低次序为:黄瓜>茄子>露地>辣椒>番茄;芽单胞菌门在黄瓜(C)中相对丰度最高,为8.21%,在辣椒(P)中最低,为5.01%,高低次序为:黄瓜>茄子>露地>番茄>辣椒。
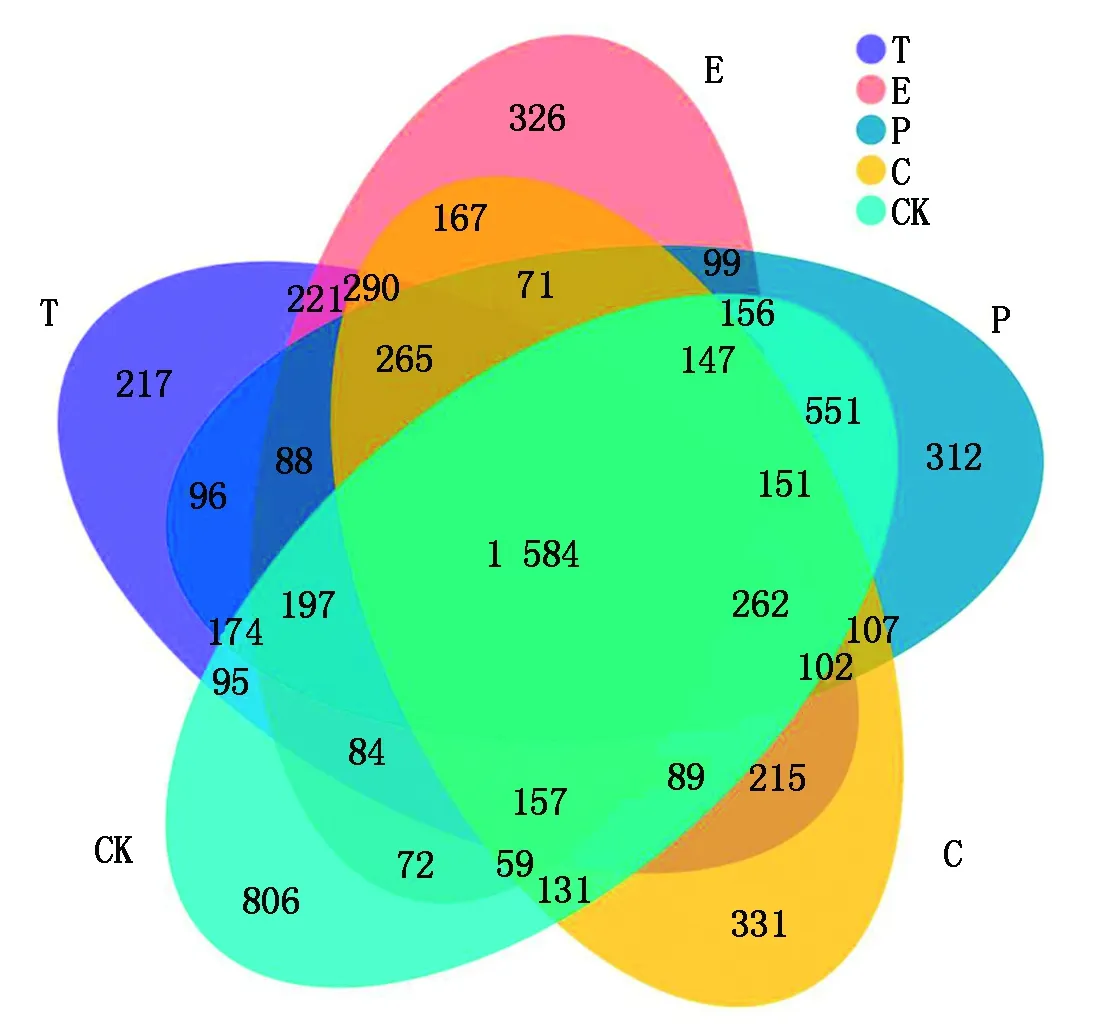
图2 细菌 OTUs 分布韦恩图Fig.2 Venn graph of bacteria OTUs distribution

图中柱子内数据表示该物种所占百分比。The data in the column shows the percentage of the species.
2.2.3 不同果类菜根际土壤细菌属水平群落结构 在属分类水平,露地和4种果类菜土壤细菌相对丰度排序前15的细菌属,通过群落组成分析,物种和样本间相似性的丰度会进行聚类,并将结果呈现在群落Heatmap图上,可使高丰度和低丰度的物种分块聚集,通过颜色变化来反映不同分组。在属水平上,土壤中细菌根据丰度高低共聚成3个大簇,丰度高低次序为:第Ⅰ簇>第Ⅱ簇>第Ⅲ簇(图4)。第Ⅰ簇包含了高丰度细菌,主要种类为norank_f__Vicinamibacteraceae、norank_f__norank_o__vicinamibacterales、norank_f__norank_o__SBR1031、芽单胞菌属(norank_f__Gemmatimonadaceae)和norank_f__A4b,这5个属在不同果类菜根际土壤中丰富度高低次序为:辣椒>露地>茄子>黄瓜>番茄,由深红色变为浅粉。
第Ⅱ簇包含了中丰度细菌,不同果类菜的优势菌群明显不同,如鞘氨醇单胞菌属(Sphingomonas)在番茄(T)和黄瓜(C)土壤中丰富度极低(白色~浅蓝色),其他果类菜根际土壤中丰富度较高(粉色);RB41在露地(CK)和黄瓜(C)土壤中丰富度较高(浅粉色),而其他果类菜根际土壤中丰富度极低(浅蓝色~深蓝色);MND1在番茄(T)和茄子(E)土壤中丰富度极低(浅蓝色),其他作物土壤中丰富度相对较多(粉色);norank_f__norank_o__norank_c__KD4-96在露地(CK)土壤中丰富度较高(粉色),其他作物土壤中丰富度极低(白色~蓝色)。
第Ⅲ簇包含了微丰度细菌,茄子(E)土壤中优势菌群均存在一定程度的交叠,区域颜色相近,表明它们的群落结构相似性高,而露地(CK)和其他果类菜根际土壤的颜色变化明显不同,说明它们的群落结构差异明显。而且不同果类菜的优势菌群明显不同,norank_f__JG30-KF-CM45在番茄(T)土壤中丰富度最高,茄子(E)土壤中丰富度相对较高,其他处理中极低(白色~深蓝色);
根据细菌群落丰度组成,露地土壤和4种果类菜根际土壤的细菌物种丰度(%)可以聚成两类,番茄(T)和茄子(E)为一类,辣椒(P)、黄瓜(C)和露地(CK)为一类,相似度较高。
2.2.4 不同果类菜根际土壤优势菌门和优势菌属组间差异性 基于样本中群落丰度数据进行露地(CK)土壤和番茄(T)、黄瓜(C)、辣椒(P)和茄子(E)等4个果类菜根际土壤进行前15种优势门(图5-A)和优势属(图5-B)的组间差异显著性检验分析,结果表明,在门水平,变形菌门、酸杆菌门、放线菌门、髌骨细菌门(Patescibacteria)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirota)、异常球菌门(Deinococcota)和Methylomirabilota在不同果类菜根际土壤之间有显著或极显著差异,其中异常球菌门(Deinococcota)差异极显著(图5-A)。在属水平,norank_f__Vicinamibacteracea、norank_f__Vicinamibacterales、鞘氨醇单胞菌属(Sphingomonas)、norank_f__JG30-KF-CM45、α变形菌属(norank_f__norank_o__norank_c__Alphaproteobacteria)、RB41、norank_f__AKYG1722、norank_f__norank_o__S085和norank_f__norank_o__norank_c__S0134_terrestrial_group在不同果类菜根际土壤之间有显著差异(图5-B)。
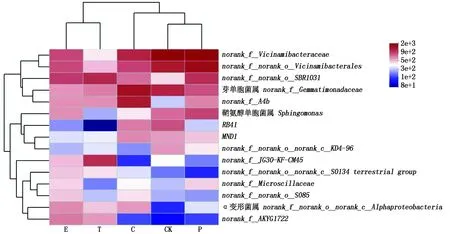
图4 不同果类菜根际根际土壤在属水平的细菌类群比较Fig.4 Community heatmap analysis on genus level in rhizosphere soil of different treated soils

同组不同字母表示差异显著(P<0.05) 。Different letters in the same group meant significant difference at 0.05 level.
2.3 不同果类菜根际土壤细菌多样性分析
2.3.1 α-多样性分析 α-多样性指数能够反映微生物群落的多样性和丰富度。其中,ChaoI指数和ACE指数反映物种丰富度,Shannon指数反映群落多样性,Simpson指数反映物种优势度。由表2可知,与露地(CK)相比,除黄瓜(C)种植后细菌丰富度和多样性指数降低,其他3个蔬菜均升高。稀释后的物种丰富度指数:ChaoI指数介于3 320.79~4 039.87,ACE指数介于3 357.06~4 037.38,其中辣椒(P)的ChaoI指数和ACE指数均最高,说明种植辣椒后土壤丰富度最高。香农指数在露地(CK)和黄瓜(C)间存在显著差异,辣椒(P)的香农指数最高,为6.82,表明了种植辣椒的土壤细菌群落多样性最高。优势度指数在露地和4个果类菜之间不存在显著差异,其中黄瓜(C)处理的优势度指数最大,为0.004 3,说明种植黄瓜后土壤优势菌群最高,分布最为均匀。

表2 不同果类菜根际土壤细菌多样性指数变化Tab.2 Changes of bacterial diversity index in rhizosphere soil of different fruit vegetables
2.3.2 β-多样性分析 主坐标轴分析(Principal co-ordinates analysis),是一种对数据进行降维的非约束性分析方法,可以反映不同样本的群落组成相似性和差异性。由图6可知,同种果类菜根际土壤的样本聚在一起;而不同种类果类菜土壤的样本分别分布在不同的区域,番茄(T)、黄瓜(C)和茄子(E)分布在PC1负方向,露地(CK)和辣椒(P)分布在正方向;此外,可以明显看出露地和4种果类菜之间都有明显的距离,说明土壤细菌群落组成结构不同,表明4种果类菜之间和露地的细菌群落结构差异较大。因此,该结果表明不同作物类型显著影响土壤细菌群落构成。
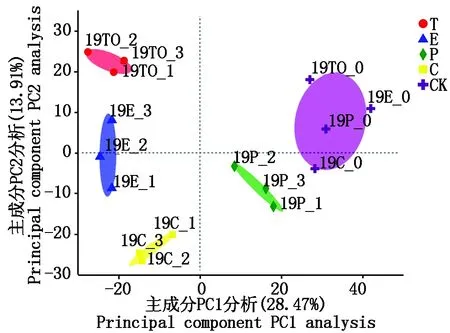
图6 不同果类菜根际土壤细菌β-多样性的二维主坐标分析(PCoA)Fig.6 Principal coordinate analysis(PCoA)two-dimensional diagram of bacterial diversity in rhizosphere soil of different fruit vegetables
3 结论与讨论
土壤微生物群落结构及群落多样性受作物类型影响[16],由于不同作物的生长习性不同,对土壤养分的吸收及根系分泌的不同,导致不同作物根际土壤生态微环境发生变化,进而导致细菌组成和丰富度发生变化[17]。本研究表明,与露地相比,露地因其光照、雨水、栽培管理和地表植被丰富,向土壤中归还有机物多,所以利于土壤微生物的繁殖,因而土壤微生物量高[12,18]。本研究中露地土壤OTU数最高,说明露地有较高的土壤微生物量,与相关学者的基本一致。
通过Illumina MiSeq高通量测序技术,研究设施连作5 a的番茄、黄瓜、辣椒、茄子果类菜的根际土壤细菌群落结构和多样性,探讨设施连作的不同果类菜对土壤细菌群落结构和多样性的影响。共获得768 560条有效序列,其中包含44个门、150个纲、364个目,575个科和1 046个属。对5组土样细菌群落在门和属分类水平上的优势菌分布特征进行分析,发现变形菌门、绿弯菌门、酸杆菌门、放线菌门、拟杆菌门和芽单胞菌门为各处理丰度较高的优势菌,这些菌群在其他一些研究中也被认为是优势种群[19],这说明设施连作根际土壤具有一般土壤微生物优势菌群组成的共性,只是占比不同。已有研究表明,变形菌门的微生物多为兼性或者专性厌氧及异养生活微生物,该门的鞘氨醇单胞菌属有去除难降解污染物的能力[20],酸杆菌门是土壤中的一类重要菌群,在土壤中可降解植物残体,参与铁循环、单碳化合物代谢以及光合作用等物质循环和生态环境构建过程[21],可以作为较贫瘠土壤环境的指标[22],其丰度越低,土壤质量越高。本研究中种植黄瓜处理变形菌门最高,酸杆菌门最低,分别占所有细菌群落总数31.53%和4.95%,不同果类菜的酸杆菌门丰度高低顺序为:番茄>露地>茄子>辣椒>黄瓜;说明连作黄瓜根际土壤有益菌群高于其他蔬菜和露地。生产中瓜果类蔬菜连作障碍严重,但本研究中黄瓜的优势菌群高于其他果类菜,这可能与试验布置前当地前2 a采用秸秆反应堆技术改变优势菌丰度有关。放线菌能够分解纤维素和木质素,丰富的放线菌有利于土壤中植物有机残体的分解[23],本研究中连作番茄处理酸杆菌门丰度最高,放线菌风度最低,说明连作番茄土壤质量相对最差,这可能与番茄栽培模式有关,由于番茄一年两茬次,中间没有休闲时间导致某些菌群富集,降低土壤菌群质量。同时,各细菌门和属分类在不同果类菜中的相对丰度存也在显著性差异,根据露地土壤和4种果类菜细菌群落丰度组成可以聚成两类,番茄和茄子为一类,辣椒、黄瓜和露地为一类,相似度较高,可能因为番茄和茄子根系要比其他作物根系发达,从土壤吸收养分差异导致整个土壤均属丰度发生变化。经Alpha多样性和Beta多样性分析,不同果类菜的根际土壤细菌群落丰富度和多样性存在一定的差异,与露地土壤相比种植番茄、辣椒、茄子后土壤中细菌香农指数和辛普森指数均有所提高,而黄瓜作物根际土壤与露地土壤的群落多样性存在显著性差异。群落丰富度和多样性高低次序为:辣椒>番茄>茄子>露地>黄瓜,4个作物类型中群落丰富度和多样性有差异但不显著。从细菌在门和属分类水平上的组成可以得知,虽然4种个果类菜群落丰富度和群落多样性差异不大,但在细菌群落构成有显著性差异,这可能是由于不同果类菜的根系分泌物不同,从而导致细菌群落结构的变化。上述结果与孙倩等[12]对谷子(Setariaitalica)、藜麦(Chenopodiumquinoa)、黑豆(Glycinemax)及休闲地研究结果一致,均表明不同作物根际微生物多样性存在差异。导致的土壤微生物群落结构变化的原因有很多方面,例如栽培管理、土壤质地、种植模式等,都会造成微生物群落结构的变化[24]。近些年,许多研究认为不同作物根系分泌物导致细菌群落组成发生变化的主要原因之一[25]。
因此,与露地相比,设施连作可以改变微生物多样性,且不同设施连作果类菜对土壤根际土壤微生物群落结构及多样性影响不同。该项研究的微生物多样性在对常规种植的设施连作的果类菜的相关研究尚属首次,能够为设施连做在内的许多农作物领域提供参考和可持续种植提供理论基础。

