拟南芥转录因子MYB54的体外纯化及功能初探
郑艺超,张 昊,,赵 丹,3,王凤茹,刘西岗,郭 琳
(1.河北师范大学 生命科学学院,分子细胞生物学教育部重点实验室,河北 石家庄 050000; 2.河北农业大学 生命科学学院,华北作物改良与调控国家重点实验室,河北省植物生理与分子病理学重点实验室,河北 保定 071001;3.衡水学院 生命科学学院,河北 衡水 053000)
MYB(v-MYB avian myeloblastosis viral)是一类在植物中普遍存在的转录因子。30 a前,人们从玉米(Zeamays)中鉴定出了第一个植物MYB基因-COLORED1(C1),C1基因编码的MYB结构域蛋白是合成玉米糊粉中花青素所必需的蛋白[1]。从那时起,植物MYB基因的功能得到了人们的广泛关注。20 a前,拟南芥基因组序列发表,首次对植物MYB基因进行了全面的描述和分类[2]。之后MYB基因在拟南芥、玉米、水稻、矮牵牛花、金鱼草、葡萄、白杨、苹果和番茄等植物中的功能也通过遗传和分子分析得到了证实[3-4]。
MYB基因表达的蛋白具有高度保守的DNA结合结构域:MYB结构域,该结构域通常由至多4个重复序列(R1、R2、R3、R4)组成,每个重复序列包含52个氨基酸,能够形成3个α螺旋。并且每个重复序列的第二和第三螺旋会与3个规则间隔的色氨酸残基形成螺旋-转角-螺旋(HTH)结构,其中色氨酸残基构成了三维HTH结构中的疏水核心[5]。MYB蛋白可分为1R-MYB/MYB-related、R2R3-MYB、3R-MYB、4R-MYB(4个R1/R2的重复)4种不同的亚类[6-7]。迄今分离出的大多数植物MYB基因编码的DNA结合域由2个重复序列构成,这2个重复序列与动物c-MYB蛋白的R2和R3重复序列最相似[8-10]。
研究发现,MYB基因是microRNA(miRNAs)和ta-siRNA(ta-siRNAs)的靶点[11],同时MYB转录因子也是其他调控因子的直接靶点[12]。MYB转录因子在植物中可以发挥很多功能,例如调控初级和次级代谢,影响细胞生命活动,控制花青素和黄酮醇的生物合成[13],调控植物生长发育[14],参与植物对生物和非生物胁迫的响应等[15]。
迄今为止,人们已经研究和报道了很多MYB家族基因在拟南芥中的功能:AtMYB30被证明在控制下胚轴细胞伸长的油菜素内酯途径中发挥重要作用[16];AtMYB60和AtMYB96能够通过ABA信号级联调控气孔运动[17]、干旱胁迫和抗病性[18];AtMYB23与AtMYB5联合调控毛状体的伸长和分支[19-20],AtMYB5还调控外种皮分化[21];AtMYB16/MIXTA控制花瓣表皮细胞的形状[22],和AtMYB17一起作为早期花序发育和种子萌发的调控因子[23];MYB28和MYB29参与植物胺胁迫响应的调节[24];AtMYB103调控纤维素的生物合成[25];AtMYB61发挥多效作用,影响木质素沉积[26]、黏液生成[27]和气孔孔径[28]。之前的研究发现,AtMYB54参与了盐胁迫响应,在抗逆中发挥了一定功能。阐明MYB蛋白在生长发育和干旱胁迫的功能和调控作用,能够为预测MYB蛋白在小麦等其他植物物种中的功能提供坚实的基础。
本研究主要对拟南芥和小麦中MYB54在不同物种之间的保守性、蛋白结构、表达模式、高温胁迫进行了研究分析,并在拟南芥中对MYB54蛋白的诱导表达,转录活性进行初步探究,为MYB54在植物中的功能研究提供理论基础,以期能在作物产量应用中提供帮助。
1 材料和方法
1.1 试验材料
本研究选择的植物材料为兰兹贝格(Landsberg erecta)野生型拟南芥(Arabidopsisthaliana),载体构建所用的菌株为大肠杆菌(Escherichiacoli)DH5α,蛋白诱导所用的菌株为大肠杆菌BL21(DE3),酵母菌株为Y2HGold,此材料都为刘西岗实验室保存。限制性内切酶、RNA反转录试剂盒与RT-PCR mix为Thermo公司购买,胶回收试剂盒为Biomiga公司购买。酵母转化试剂盒为北京Coolaber公司购买。
1.2 试验方法
1.2.1 MYB54的生物信息学分析 利用NCBI(http://www.ncbi.nlm.nih.gov)网站和TAIR网站(http://www.arabidopsis.org)对MYB54的蛋白序列进行搜索,并将蛋白序列导入到https://plants.ensembl.org/index.html网站中进行不同物种之间的同源对比,利用MEGA 10软件对不同物种之间的MYB54蛋白进行进化学分析。同时利用DNAMAN软件预测MYB54的蛋白质结构;利用同源模型服务软件SWISS-MODEL(http://www.swissmodel.expasy.org/)预测MYB54蛋白三维空间结构。
1.2.2MYB54在拟南芥中的不同部位的表达量分析 选取16 h光照/8 h黑暗条件下生长了40 d的野生型拟南芥植株,取全根、莲座叶、茎生叶、花序以及果荚组织。利用TRIzol法提取总RNA,利用反转录试剂盒反转录为cDNA后进行RT-PCR检测,内参基因为UBQ5。反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。
1.2.3 高温和低温处理下拟南芥幼苗MYB54的表达量分析 将野生型Ler的种子用75%乙醇消毒后,铺在1/2MS培养基中,在22 ℃,16 h光照/8 h黑暗条件下生长8 d后,将幼苗分别放入4,30 ℃进行高温和低温处理,2 h后全苗取样,进行RNA提取,反转录后利用RT-PCR测定MYB54的表达量。反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL,内参基因为UBQ5。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。
1.2.4 热胁迫下小麦中MYB54基因的表达量分析 将大小均一饱满的KN9204小麦种子,用2.5%次氯酸钠浸泡2 min,随后再用蒸馏水冲洗3次,冲洗干净后,均匀摆放在盛有蛭石的培养皿中,并将种子放入22 ℃培养箱中,在16 h光照,8 h黑暗条件中萌发,待小麦长至一叶一心时期在4 ℃进行春化处理28 d,随后将幼苗移栽进培养土中(营养土∶蛭石=1∶1),在12 h光照(18 ℃),12 h黑暗(13 ℃)进行培养,待幼苗长至两叶一心时,分别进行4 ℃冷处理和30 ℃热处理,处理2 h后全苗取材,随后利用RNA提取试剂盒和反转录试剂盒获取cDNA进行RT-PCR检测,反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL,内参基因为GAPDH。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。

表1 引物序列Tab.1 Primer sequence
1.2.5 MYB54蛋白相关表达载体的构建 利用snapgene软件对MYB54基因 CDS序列以及pGEX-4T-1,pGBKT7表达载体进行酶切位点分析,用EcoR Ⅰ和SalⅠ 2个酶切位点对目的基因和载体进行酶切回收,25 ℃条件下,用T4连接酶将MYB54基因 CDS序列与pGST-4T-1与pGBKT7载体连接,随后将重组质粒转入大肠杆菌DH5α中,加500 μL无抗LB培养液,并均匀涂布在氨苄霉素LB培养基上37 ℃培养12~16 h,挑取20个单菌落进行PCR鉴定,对鉴定出的阳性菌落提取质粒,利用BamH Ⅰ进行酶切验证,将酶切正确的重组质粒送金唯智公司(GENEWIZ)进行测序。
1.2.6 pGEX-4T-1-MYB54蛋白诱导纯化 考马斯亮蓝染色以及Western Blot检测 将构建好的pGEX-4T-1-MYB54重组质粒利用热激法转入大肠杆菌BL21(DE3)菌株中,37 ℃过夜培养。挑取单菌落加入5 mL氨苄抗性的LB培养液中,37 ℃摇床中220 r/min培育12~14 h,后转入250 mL的氨苄抗性的LB培养液中扩培4~5 h,待菌液OD600值达到0.6时加入IPTG,使其终浓度为0.3 μmol/L,分别在18 ℃过夜诱导,30 ℃诱导6 h,37 ℃诱导4 h。诱导结束后收集菌液,利用超声仪对菌液进行超声破碎,将超声后的上清加入GST凝胶树脂进行蛋白纯化,在4 ℃摇床中孵育4~6 h,将纯化出的GST-MYB54蛋白进行SDS-PAGE电泳后,考马斯亮蓝染色,并选取最适诱导条件下的纯化蛋白进行Western Blot检测。
1.2.7 MYB54在酵母中的转录激活活性分析 利用酵母双杂交系统对MYB54的转录活性进行分析,构建重组质粒pGBKT7-MYB54用于转化酵母菌株。首先将酵母菌株Y2HGold在YPDA固体培养基上划线,30 ℃倒置培养2~3 d,挑取直径2~3 mm的单克隆于3 mL YPDA培养液中,30 ℃,250 r/min摇床培养8 h,吸取100 μL~10 mL YPDA中,30 ℃,250 r/min摇床培养12~16 h,直至OD600达到 0.5左右。提前将1.5 mL离心管,枪头,ddH2O高温灭菌。用1.5 mL的离心管1 000 r/min离心2 min收集菌体2次,倒去上清并用1 mL无菌ddH2O重悬酵母;目的是洗去残留的YPDA培养液,再次室温1 000 r/mim离心2 min收集菌体,倒去上清并加入 1 mL 10× TE/LiAc,500 μL PEG8000和10 μL Carrier DNA 溶液重悬酵母;同时加入pGBKT7-MYB54重组质粒或pADT7空质粒作为对照。振荡混匀后30 ℃水浴 30 min,每 10 min 上下颠倒混匀1次。静置过夜后在42 ℃水浴锅中热激30 min,每10 min上下颠倒混匀1次。3 000 r/min离心5 min后,倒掉上清加入100 μL无菌水,重悬菌体后铺在SD-Leu/-Trp的培养基上,30 ℃培养2~3 d后,转接到SD-Leu/-Trp/-His/-Ade培养基中继续培养3~4 d后,观察酵母生长状况。
2 结果与分析
2.1 MYB54系统进化树分析以及氨基酸序列对比
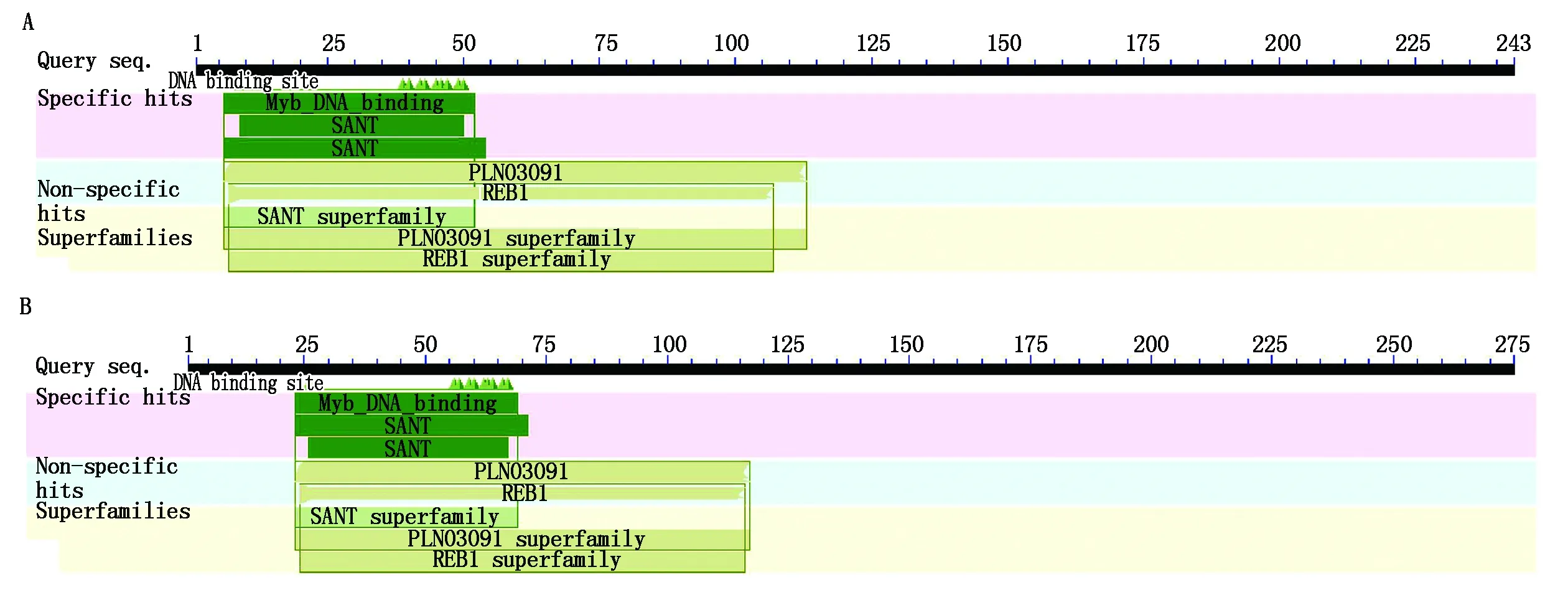
利用生物信息学软件,将拟南芥中的MYB54蛋白序列与欧洲油菜(Brassicanapus)、芥蓝(Brassicaoleracea)、白菜(Brassicarapa)、亚麻荠(Camelinasativa)、圆锥南芥(ArabisalpinaA)、大豆(Glycinemax)、烟草(Nicotianaattenuata)、水稻(Oryzasativa)、高粱(Sorghumbicolor)、谷子(Setariaitalica)、小麦(Triticumaestivum)和番茄(Solanumlycopersicum)进行了蛋白同源性分析,如图1所示,拟南芥中的MYB54蛋白与十字花科中的芥蓝、白菜、亚麻荠等同源性比较接近,分别达到了87%,87%,81%,与禾本科植物高粱、谷子和水稻的同源性较低,分别为54%,57%,47%,与小麦和番茄的同源性为42%。同时,通过图2中MYB54的氨基酸序列比对可以看出,在不同物种之间,MYB54具有非常保守的一段氨基酸序列,这段序列包含20个氨基酸片段,位于MYB-like DNA-binding 结构域之中。

图1 系统进化树分析Fig.1 Phylogenetic tree analysis
2.2 MYB54氨基酸序列的生物信息学分析
小麦作为我国主要的粮食作物之一,其中基因功能的研究对小麦育种具有重要的意义和价值,随后笔者利用 NCBI(http://www.ncbi.nlm.nih.gov)网站对MYB54蛋白分别在拟南芥和小麦中的氨基酸序列进行分析比对,结果如图3-5所示,拟南芥中MYB54蛋白具有243个氨基酸,相对分子质量为28.169 ku,等电点为10.17。小麦中MYB54蛋白具有275个氨基酸,相对分子质量为29.881 ku,等电点为10.005 4,对比图3-A、B可以看出,MYB54在小麦和拟南芥中存在非常保守的蛋白结构域,例如MYB-like DNA-binding结构域,该结构域在小麦和拟南芥中都存在,包含MYB蛋白的DNA结合结构域,以及与核小体滑动相关的SANT(“SWI3,ADA2,N-CoR and TFIIB”)结构域[29]。用同源模型服务软件 SWISS-MODEL(http://www.swissmodel.expasy.org/)分别对拟南芥和小麦中的MYB54蛋白进行三维空间结构的预测,结果如图4-A和图5-A所示。拟南芥中MYB54蛋白在第84位疏水性最高,峰值为2.15,在第157位亲水性最高,峰值为-1.71,结合ProtPram预测的平均亲水性为0.03,分析可知该蛋白为亲水性蛋白。小麦中MYB54蛋白在第1位疏水性最高,峰值为2.83,在第82位亲水性最高,峰值为-1.58,平均亲水性为0.04,预测为亲水性蛋白。同时对拟南芥和小麦中MYB54蛋白的二级结构进行预测,拟南芥MYB54蛋白包含96个螺旋,36个折叠,111个卷曲。小麦MYB54蛋白包含87个螺旋,48个折叠以及140个卷曲(图4-B-D和图5-B-D)。综合以上数据,可以看出小麦中MYB54蛋白与拟南芥中MYB54蛋白在保守结构域、亲水性、二级结构以及三级结构都十分相似,所以对拟南芥中MYB54蛋白的研究能够为预测小麦中MYB54蛋白功能提供有力的理论依据。

图2 MYB54氨基酸序列同源对比Fig.2 MYB54 amino acid homology comparison
A.拟南芥MYB54蛋白序列;B.小麦MYB54蛋白序列。A. Arabidopsis MYB54 protein sequence;B. Wheat MYB54 protein sequence.

A.蛋白质三级结构预测;B.疏水性预测;C.亲水性预测;D.蛋白质二级结构预测。图5同。A.Prediction of tertiary structure of proteins;B.Hydrophobicity prediction;C. Hydrophilicity prediction;D. Protein secondary structure prediction;The same as Fig.5.

图5 小麦MYB54蛋白质生物信息学分析Fig.5 MYB54 protein bioinformatics analysis in wheat
2.3 MYB54基因在拟南芥不同组织的表达量分析
以拟南芥野生型(Ler)为材料,利用RT-PCR分别对根、莲座叶、茎生叶、花、果荚中的MYB54表达量进行分析,结果如图6所示,在这些组织中MYB54均有表达,但在果荚中的表达量最高,在花序和根中的表达量次之,在莲座叶和茎生叶中的表达量最少。综合以上结果,猜测MYB54可能在生殖发育过程中起着重要的作用。
2.4 拟南芥MYB54基因在高温和低温处理下的表达量分析
对野生型幼苗进行高温和低温处理,2 h后检测MYB54基因的表达量,结果如图7所示,高温处理后,MYB54基因的表达显著降低,表明MYB54能够响应高温胁迫,而在低温处理后,MYB54基因的表达量与对照组没有显著差异,这与前人在热胁迫中MYB54功能的研究相印证。
2.5 小麦MYB54基因在高温和低温处理下的表达量分析
随后对两叶一心时期的小麦幼苗进行高温和低温处理,2 h后检测了MYB54基因的表达变化,结果如图8所示,高温处理之后,MYB54的表达量与对照组相比下降1/2,低温处理之后,MYB54的表达量与对照组相比没有显著差异,这些结果与拟南芥中MYB54基因的变化趋势一致,表明MYB54对热较敏感,高温可以抑制MYB54的表达。

n=3,采用t检验分析数据的显著性;不同字母表示数据之间差异显著(P<0.05)。图7-8同。
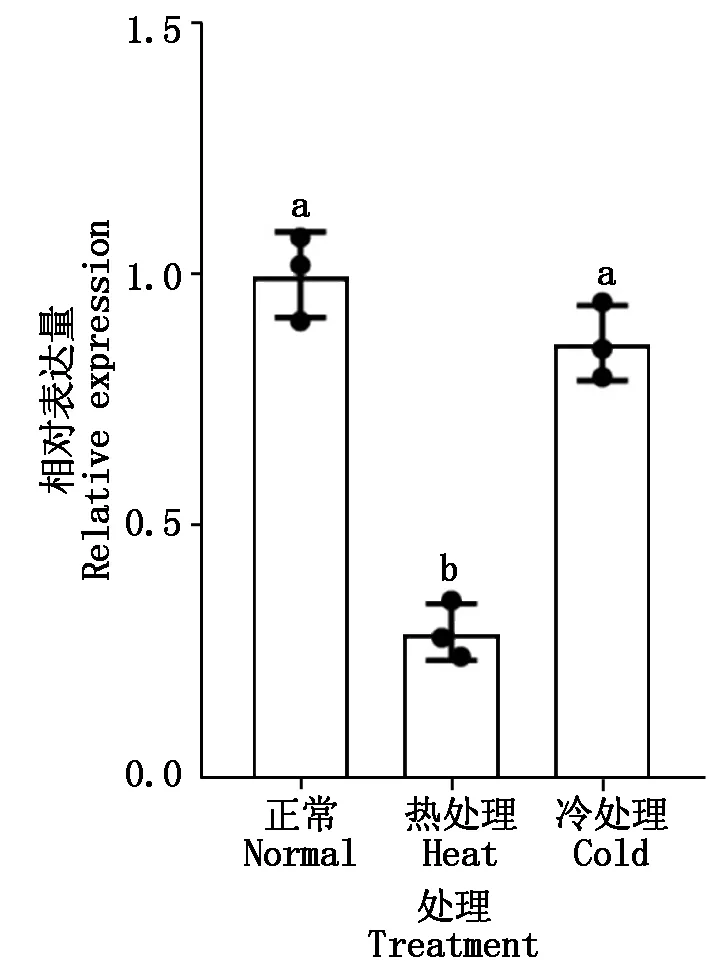
图7 高温和低温胁迫下拟南芥MYB54基因的表达Fig.7 Expression of MYB54 gene under high and low temperature stress in Arabidopsis

图8 高温和低温胁迫下小麦MYB54基因的表达Fig.8 Expression of MYB54 gene under high and low temperature stress in wheat
2.6 MYB54蛋白的诱导纯化以及Western Blot分析
为了探索pGEX-4T-1-MYB54融合蛋白的最适诱导纯化条件,分别在18,30,37 ℃对该蛋白进行诱导,之后通过凝胶电泳和考马斯亮蓝染色对诱导纯化结果进行分析。MYB54蛋白分子量大小约为27 ku,GST蛋白分子量大小约为26 ku,故融合蛋白分子量大小约为53 ku。结果如图9所示,18,30,37 ℃条件下,蛋白都可以被正常诱导(泳道2-4),并且在超声后的上清液(泳道5-7)和沉淀中(泳道8-9)都可以检测到融合蛋白,随后将蛋白利用GST凝胶树脂进行纯化,结果发现,在37 ℃条件下纯化出的蛋白数量更多(泳道13)。随后对37 ℃条件下纯化出的融合蛋白利用GST抗体进行Western Blot检测,结果如图10所示,pGEX-4T-1-MYB54融合蛋白可以正确的表达翻译。
2.7 MYB54转录激活活性分析
MYB54作为转录因子来发挥功能,转录因子具有转录激活或转录抑制活性,为了验证MYB54的转录激活活性,利用了酵母双杂交GAL4系统进行验证,GAL4含有DNA结合结构域(DNA-Binding domain)BD和转录激活结构域(Transcription-activating domain)AD。将MYB54基因的CDS连接到pGBKT7载体上,构建了MYB54-BD,如果MYB54蛋白具有转录自激活活性,即使没有与其他蛋白质相互作用也可以启动下游报告基因的表达。将构建好的MYB54-BD与不带有其他表达蛋白的空AD共同转入酵母中,在四缺培养基中进行培养,结果如图11所示,MYB54-BD与空AD依然能够在四缺培养基上生长,空AD和空BD不能在四缺培养基上生长,这一结果表明MYB54在酵母中具有转录激活活性。
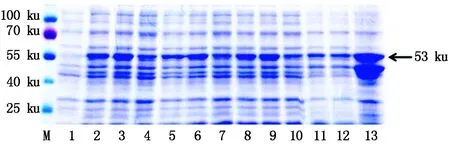
M.蛋白Marker;1.蛋白诱导前;2-4.分别在18,30,37 ℃条件下诱导后的蛋白;5-7.分别在18,30,37 ℃条件下诱导后蛋白的超声上清;8-10.分别在18,30,37 ℃条件下诱导后蛋白的超声沉淀;11-13.分别在18,30,37 ℃条件下纯化的蛋白。

M.蛋白Marker;1.GST凝胶树脂;2.纯化的GST-MYB54蛋白。M.Protein Marker;1.GST gel resin;2.Purified GST-MYB54 protein.

图11 酵母双杂交系统检测MYB54基因自激活活性Fig.11 Yeast two-hybrid system to detect the self-activating activity of MYB54 gene
3 结论与讨论
MYB蛋白包含了非常保守的MYB DNA-binding结构域,该结构域通常由至多4个重复序列(R1、R2、R3、R4)组成,植物中MYB相关蛋白通常包含2个螺旋-转角-螺旋(HTH)结构,即R2和R3重复序列[30]。据估计,拟南芥含有超过100个R2R3-MYB基因。功能数据表明,这些基因在次级代谢的调节、细胞形状的控制、抗病性和激素反应中发挥重要作用。对拟南芥中MYB蛋白家族的MYB54蛋白进行了研究,研究发现,拟南芥中的MYB54蛋白与十字花科的同源性比较接近,与禾本科植物的同源性较低。MYB54蛋白在小麦和拟南芥中的保守结构域、亲水性、二级结构以及三级结构都十分相似,因此,探明模式植物拟南芥中MYB54蛋白的功能对小麦等农作物的研究具有重要的参考意义。MYB54基因在根、莲座叶、茎生叶、花、果荚中均有表达,暗示该基因在植物各个部位的生长发育都可能起到一定的调控作用,但在果荚中的表达量最高,因此,猜测MYB54可能在生殖发育过程中起着重要的作用。拟南芥和小麦中,经过高温处理后,MYB54的表达量都显著降低,这也暗示着MYB54在对热胁迫的响应中发挥着重要功能。MYB54蛋白的诱导条件并不严格,在18,30,37 ℃温度条件下,都可以被成功诱导,但在37 ℃温度下纯化的蛋白数量更多,Western Blot检测表明MYB54蛋白可以在体外正确翻译表达。利用酵母GAL4体系发现MYB54作为转录因子,具有转录激活活性。拟南芥MYB基因家族中依然有90%的MYB基因功能尚未被完全了解,对MYB54蛋白进行了基础的研究和初步的探索,以期为发掘更多的MYB蛋白家族功能提供理论基础和参考指导。

