虎杖苷通过蛋白激酶B信号通路影响胃癌细胞增殖凋亡
张翠翠,李强
作者单位:1枣庄矿业集团枣庄医院消化内科,山东 枣庄277100;2枣庄市立医院消化内科,山东 枣庄277100
胃癌是常见的消化系统恶性肿瘤,其严重影响着人类的生活质量,胃癌具有恶性程度高、易复发等特点,寻找有效的药物治疗胃癌是目前医学工作者研究的热点。虎杖苷是从虎杖中提取出来的芪类化合物,是白藜芦醇同葡萄糖的结合产物,虎杖苷具有广泛的药理学作用,如平喘、镇咳、降低胆固醇等。以前的研究表明,虎杖苷能够抑制肿瘤生长,对于白血病、乳腺癌等肿瘤细胞具有抑制作用,并且可以诱导肿瘤细胞凋亡发生。虎杖苷抗肿瘤机制较为复杂,在研究虎杖苷诱导宫颈癌细胞凋亡的实验研究中发现,其可以通过下调蛋白激酶B(Akt)信号通路的激活水平发挥抗肿瘤功效。目前对于虎杖苷在胃癌细胞增殖和凋亡中的作用和机制还不清楚。本次实验于2018年1月至2019年4月用虎杖苷处理体外培养的胃癌细胞,通过MTT法等多种实验技术手段探究虎杖苷对胃癌细胞增殖、克隆、周期、凋亡的作用和机制,为虎杖苷治疗胃癌的临床应用提供资料。
1 材料与方法
1.1 材料
胃癌细胞SGC-7901购自南京科佰生物科技有限公司;周期蛋白依赖性激酶4(CDK4)抗体、Bcl-2相关X(Bax)蛋白抗体购自美国Sigma-Aldrich;剪切型胱天蛋白酶-3(Cleaved-caspase-3)抗体购自武汉博士德生物工程有限公司;虎杖苷购自北京索莱宝科技有限公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;细胞周期蛋白D1(cyclin D1)抗体购自美国Santa Cruz Biotechnology;磷酸化Akt(p-Akt)抗体购自美国Santa Cruz;Akt信号激活剂胰岛素样生长因子-1(IGF-1)购自美国Sigma。1.2 MTT法测定虎杖苷处理后胃癌细胞增殖活性
胃癌细胞接种到96孔板中,分成两组,依次为对照组和虎杖苷组,虎杖苷组分成5个浓度梯度分别为2、4、6、8、10 μmol/L,对照组为0 μmol/L。细胞培养48 h以后,分别在每个孔中添加10 μL的噻唑蓝(MTT)溶液,继续放在37℃的培养箱中孵育4 h。然后把孔内的液体弃掉,添加150 μL的二甲基亚砜(DMSO)溶液,震荡反应10 min。以不含细胞的空白孔调零,检测490 nm的吸光度。1.3 平板克隆实验测定虎杖苷处理后胃癌细胞克隆形成能力
胃癌细胞按照对照组和虎杖苷分组每个孔中添加250个细胞接种到6孔板中,放在细胞培养箱中培养14 d。添加磷酸盐缓冲盐溶液(PBS)洗涤细胞,然后以4%的多聚甲醛溶液固定20 min。将甲醛弃掉,添加10%结晶紫染色30 min。在室温中晾干,在光学显微镜下观察并计数细胞克隆形成数目。随机选择5个实验,计算平均值。1.4 PI单染法测定虎杖苷处理后胃癌细胞周期变化
收集培养处理48 h以后的对照组和虎杖苷组细胞,添加事先预冷后的PBS溶液,以1 000g
离心10 min。把上清吸除,然后添加50 μL的PBS溶液,继续加入70%的乙醇,放在4℃条件下反应12 h。1 000g
离心10 min,吸弃上清,添加PI染色液500 μL,在37℃条件下反应30 min。流式细胞仪检测细胞周期分布。1.5 Annexin V
-FITC/PI双染法测定虎杖苷处理后胃癌细胞凋亡变化
收集培养处理48 h以后的对照组和虎杖苷组细胞,以PBS将细胞洗涤2次,以250 μL的结合缓冲液将细胞悬浮,细胞浓度为1×10个/毫升。收集1 mL细胞至流式管中,然后添加PI和Annexin V-FITC溶液各5 μL到细胞中,放在避光条件下结合15 min。添加400 μL的结合缓冲液,流式细胞仪检测凋亡。1.6 蛋白质印迹法(Western blotting)测定虎杖苷处理后胃癌细胞中cyclin D1、CDK4、Bax、Cleaved
caspase
-3、p
-Akt蛋白水平
收集培养处理48 h以后的对照组和虎杖苷组细胞,在细胞中添加RIPA裂解试剂,放在冰上裂解20 min。然后根据BCA蛋白定量检测试剂盒测定蛋白的浓度。制备8%的分离胶以及5%的浓缩胶,按照每孔中加入40 μg的蛋白样品上样,预染蛋白Marker上样量为5 μL。在浓缩胶中设置80 V电压电泳,在分离胶中设置110 V电压电泳。将凝胶取出,以100 V电压转膜,将蛋白从凝胶上转移至聚偏二氟乙烯(PVDF)膜上,转膜装置放在冰上操作。PVDF膜置于封闭液(5%牛血清白蛋白溶液)中,于室温孵育2 h。然后将PVDF膜放在一抗中,在低温4℃条件下孵育12 h。最后把PVDF膜放在1∶2 000稀释以后的二抗反应液中,在室温中孵育2 h。将ECL超敏液滴加到PVDF膜上,以Bio-rad采集图像,分析蛋白灰度值。内参为GAPDH,分析目的蛋白表达水平。1.7 Akt信号激活剂IGF
-1对虎杖苷调控胃癌细胞增殖、克隆、周期、凋亡的影响
以含有3 μg/L的Akt信号激活剂IGF-1和6 μmol/L的虎杖苷细胞培养液培养胃癌细胞,设置为虎杖苷+IGF-1组,以虎杖苷组为对照,以上述MTT、平板克隆实验、PI单染、Annexin V-FITC/PI双染以及蛋白质印迹法检测细胞增殖、克隆、周期、凋亡和cyclin D1、CDK4、Bax、Cleaved-caspase-3、p-Akt蛋白水平。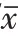
2 结果
2.1 虎杖苷抑制胃癌细胞增殖
对照组、2、4、6、8、10 μmol/L虎杖苷组吸光度分别为(0.58±0.06)、(0.45±0.03)、(0.38±0.03)、(0.31±0.02)、(0.25±0.02)、(0.20±0.01),F
=166.429,P
<0.001。胃癌细胞经过虎杖苷处理以后,细胞吸光度降低(P
<0.05)。6 μmol/L的虎杖苷对胃癌细胞抑制率接近50%,后续实验选用6 μmol/L的虎杖苷处理胃癌细胞。2.2 虎杖苷抑制胃癌细胞克隆形成并阻滞细胞周期
结果见表1和图1,胃癌细胞经过虎杖苷处理以后,细胞克隆形成数目下降,G0/G1细胞比例升高,细胞中周期蛋白cyclin D1、CDK4表达水平下降。虎杖苷抑制胃癌细胞克隆形成并阻滞细胞周期。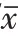
表1 虎杖苷处理后胃癌细胞克隆形成数目、细胞周期分布以及细胞周期蛋白D1(cyclin D1)、周期蛋白依赖性激酶4(CDK4)蛋白水平变化/±s

图1 蛋白质印迹法检测虎杖苷处理后胃癌细胞中细胞周期蛋白D1(cyclin D1)、周期蛋白依赖性激酶4(CDK4)蛋白水平
2.3 虎杖苷诱导胃癌细胞凋亡
结果见图2、图3、表2,胃癌细胞经过虎杖苷处理以后,细胞凋亡率升高,细胞中凋亡蛋白Bax、Cleaved-caspase-3表达水平升高。虎杖苷诱导胃癌细胞凋亡。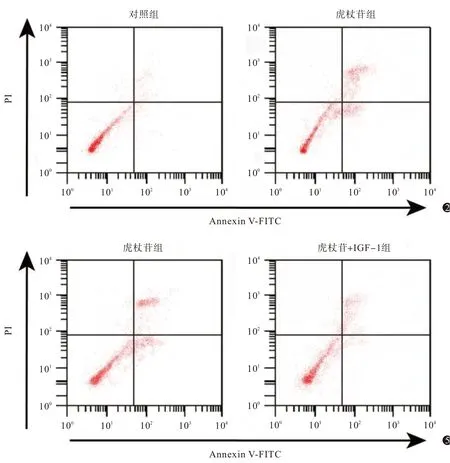
图2 流式细胞术测定虎杖苷处理后胃癌细胞凋亡变化 图5 流式细胞术测定虎杖苷和蛋白激酶B(Akt)信号激活剂胰岛素样生长因子-1(IGF-1)共同处理后胃癌细胞凋亡情况
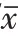
表2 虎杖苷处理后胃癌细胞凋亡率和Bcl-2相关X(Bax)、剪切型胱天蛋白酶-3(Cleaved-caspase-3)蛋白水平/±s
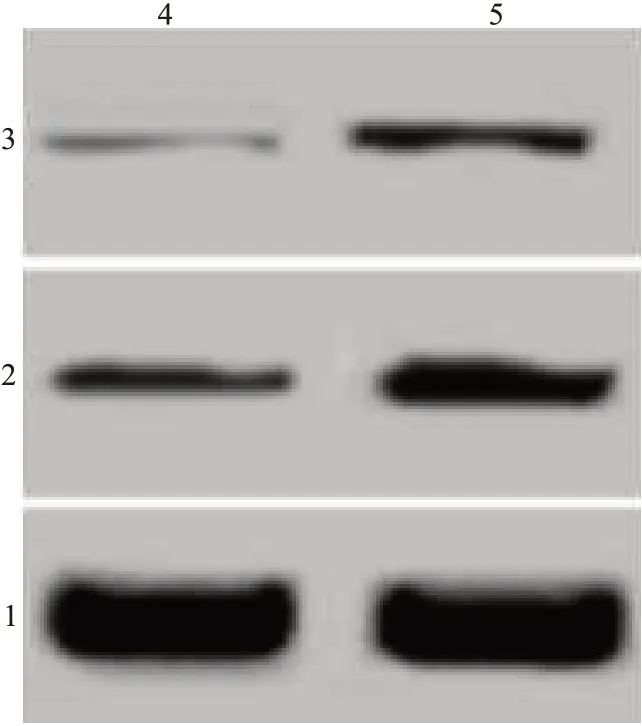
图3 蛋白质印迹法测定虎杖苷处理后胃癌细胞中Bcl-2相关X(Bax)、剪切型胱天蛋白酶-3(Cleaved-caspase-3)蛋白水平
2.4 虎杖苷抑制胃癌细胞中Akt信号通路激活
结果见图4,胃癌细胞经过虎杖苷处理以后,细胞中Akt信号通路蛋白p-Akt水平降低[(0.51±0.05)比(0.24±0.03),t
=13.891,P
<0.001]。虎杖苷降低胃癌细胞中Akt信号通路激活水平。
图4 蛋白质印迹法测定虎杖苷处理后胃癌细胞中磷酸化-Akt(p-Akt)蛋白表达
2.5 Akt信号激活剂IGF
-1逆转虎杖苷对胃癌细胞增殖、克隆、周期、凋亡的影响
结果见图5、图6、表3,Akt信号激活剂IGF-1可以提高虎杖苷作用条件下胃癌细胞吸光度和克隆形成数目,减少G0/G1期细胞比例,减少细胞凋亡,提高细胞中cyclin D1、CDK4蛋白表达水平,减少细胞中Bax、Cleaved-caspase-3蛋白表达,提高细胞中p-Akt/Akt水平。Akt信号激活剂IGF-1逆转虎杖苷对胃癌细胞增殖、克隆、周期、凋亡的影响。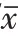
表3 虎杖苷和Akt信号激活剂胰岛素样生长因子-1(IGF-1)共同处理后胃癌细胞吸光度、克隆形成数目、周期分布、凋亡率和细胞周期蛋白D1(cyclin D1)、周期蛋白依赖性激酶4(CDK4)、Bcl-2相关X(Bax)、剪切型胱天蛋白酶-3(Cleaved-caspase-3)、磷酸化-Akt(p-Akt)蛋白水平/±s

图6 蛋白质印迹法测定虎杖苷和Akt信号激活剂胰岛素样生长因子-1(IGF-1)共同处理后胃癌细胞中细胞周期蛋白D1(cyclin D1)、周期蛋白依赖性激酶4(CDK4)、Bcl-2相关X(Bax)、剪切型胱天蛋白酶-3(Cleaved-caspase-3)、磷酸化-Akt(p-Akt)蛋白水平
3 讨论
虎杖苷是从虎杖中提取出来的一种单体,是一种羟基二苯乙烯类化合物,国内外的研究显示,虎杖苷可以加强心肌舒张及收缩功能、抑制血栓形成、改善微循环、降血脂,对于结肠炎、子宫内膜异位症导致的疼痛也具有改善作用。虎杖苷具有肿瘤预防和治疗的作用,其对于小鼠移植性肝癌具有抑制作用,能够明显降低肺癌、宫颈癌等细胞生长速度。本次实验显示,虎杖苷处理后的胃癌增殖、克隆能力均下降,提示虎杖苷可以抑制胃癌细胞增殖,虎杖苷具有抗胃癌进展的作用。
本次实验还发现虎杖苷处理后的胃癌细胞G0/G1比例升高,细胞凋亡增加,说明虎杖苷可能通过阻滞细胞周期和诱导细胞凋亡发挥抗肿瘤功效。细胞周期是细胞增殖的基础,分裂间期是细胞增殖能力改变的关键。G0/G1期是DNA物质准备阶段,受到细胞内多种蛋白的调控作用,cyclin D1是细胞周期素中与肿瘤关系最为密切的调节因子,其是CDK4的调控亚基,参与细胞从G0/G1期向S期转变过程,cyclin D1可以与CDK4结合刺激细胞生长,影响细胞周期进展。细胞凋亡与细胞周期一样,受到细胞内凋亡蛋白的表达调控作用,Caspase蛋白家族是目前研究最多的与细胞凋亡有关的直接调控因子,其含有多个蛋白成员,分别在细胞凋亡反应中发挥不同的作用,Caspase-3是位于凋亡级联反应下游的执行因子,正常情况下以没有活性的酶原形式存在,只有被激活形成Cleaved-caspase-3后才可以不可逆的诱导细胞凋亡发生。Bax是Bcl-2蛋白家族成员,其在细胞凋亡过程中发挥促进作用,是一种促凋亡蛋白。我们的实验表明,虎杖苷处理后的胃癌细胞中cyclin D1、CDK4蛋白水平下降,Cleaved-caspase-3、Bax蛋白水平升高,提示虎杖苷阻滞细胞周期和诱导细胞凋亡作用,这与细胞周期和凋亡检测结果一致,进一步证实了虎杖苷对胃癌细胞的作用。
目前对于虎杖苷抗肿瘤机制的研究表明,其可以通过下调细胞中Akt信号通路的激活水平抑制宫颈癌细胞生长。Akt信号通路具有多种作用,在人体组织中广泛存在,对于细胞生长、凋亡等具有明显的调控功能。研究报道证实,肿瘤组织中存在Akt信号通路过度激活现象,而抑制Akt信号激活可以抑制肿瘤细胞的恶性生长。p-Akt是Akt的磷酸化形式,其水平升高是Akt信号激活的标志。本次实验显示,虎杖苷处理后的胃癌细胞中p-Akt水平降低,并且Akt信号激活剂可以逆转虎杖苷对胃癌细胞增殖、克隆抑制和细胞周期阻滞以及细胞凋亡促进作用,证实虎杖苷抗胃癌细胞恶性生物学行为机制与Akt信号有关。
总之,虎杖苷能够在体外抑制胃癌细胞的恶性生长、阻滞细胞周期和诱导细胞凋亡,虎杖苷对于胃癌进展具有抑制作用,其作用机制与下调Akt信号激活水平有关。我们的结果为研究虎杖苷抗肿瘤机制提供了参考,为虎杖苷治疗胃癌的临床应用提供了理论资料。

