基于网络药理学探讨人参治疗失眠的潜在分子机制与实验研究
2石和元丁莉
(1.湖北中医药大学 老年医学研究所, 湖北 武汉 430065;2.湖北中医药大学附属黄冈中医医院, 湖北 黄冈 438000;3.湖北中医药大学 药学院, 湖北 武汉 430065)
0 引言
失眠是常见的睡眠问题,以长期不能获得正常睡眠为主要特征。在成年人之间,有10%~15%的人群符合失眠的诊断标准,中国睡眠研究会在我国6个城市的调查报告显示有57%的人群具有失眠的症状[1]。长期不能获得正常睡眠,使得失眠患者的生活质量下降,工作效率降低,焦虑情绪增加,同时也导致机体免疫、代谢等功能失常,最终产生一系列疾病。中药人参在诸多治疗失眠的方剂中出现,人参甘温,归肺、脾经,具有安神的作用,现代药理学研究发现人参可能通过调节免疫而改善失眠症状。网络药理学是基于“疾病-药物”互作网络,揭示药物对疾病的作用靶点,从整体研究药物与疾病的关系[2],因此,笔者选用网络药理学的方法,分析人参对失眠的作用机制并以斑马鱼睡眠剥夺为失眠动物模型进行验证。
1材料
1.1 数据库中化合物的筛选
本研究利用中药系统药理学和分析平台TCMSP(http://tcmspw.com),以口服利用度(OB)≥30%,类药性(DL)≥0.18为筛选条件,获得人参的化合物活性成分。
1.2 人参化合物相对应靶点的收集和网络构建
利用DrugBank数据库(https://www.drugbank.ca/)确认经TCMSP数据库中筛选所得人参中化合物的有效作用靶点。在UniProt(https://www.uniprot.org/)数据库中录入经筛选剔除相同靶点后得到的化合物-靶点并进行检索,以“Homo sapiens”条件进一步剔除非人源及重复的靶点,得到人参活性成分的基因靶点(gene symbol),将最终所收集的人参化合物和靶点导入Cytoscape3.7.0软件中,建立化合物和靶点网络。
1.3 失眠相关靶点的获取
构建疾病数据库时,以“insomnia”为关键词,对GeneCards及TTD数据库进行挖掘,搜集失眠相关的靶点,化合物靶点与失眠相关度的计算使用Gifts算法,然后将计算结果进行排序,选取失眠靶点的条件为得分≥30,最后将所纳入的靶点的标准基因名摘录出来。
1.4 人参对失眠的作用靶点蛋白互作网络
基于Venny在线分析软件,获得人参与失眠有共同交集的靶点,进而明确人参治疗失眠的作用靶点。通过利用STRING10.5平台得到基因靶点。最后通过使用Cytoscape3.7.1软件构建蛋白互作网络图。
1.5 人参基因本体(GO)功能富集分析
通过David6.8.0数据库对人参作用于失眠的靶点蛋白进行GO功能富集分析,具体内容则包括生物过程、细胞组成和分子功能的功能富集分析,并将GO功能富集结果进行可视化分析。
1.6 人参KEGG通路富集分析
利用David在线平台的KEGG富集分析功能,对人参作用于失眠的靶点中涉及的蛋白质的功能进行了研究,共富集出14条信号通路,利用Omicshare 3.0软件进行可视化处理。
1.7 分子对接
从人参活性成分中选取核心成分与失眠靶点蛋白GABRA1分子对接。随后从RSCB PDB数据库(https://www.rcsb.org/)下载相关蛋白结构,从Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载化合物结构。DiscoveryStudio软件用于溶剂分子和配体的去除、加氢、电子加成等操作。
1.8 实验动物
野生型AB系斑马鱼由湖北中医药大学老年医学研究所鱼房配置,房间温度为(27±1) ℃,鱼房内光线用自动计时器设置为14 h,光照10 h,黑暗循环。本次实验用鱼采用胚胎发育到5 d的幼鱼,此时期的鱼可从自身卵黄囊中获取营养。
1.9 药物与试剂
药物:人参(ginseng radix etrhizoma)购自湖北中医药大学黄家湖医院,经湖北中医药大学药学院丁莉副教授鉴定为真品。采用纯水煎煮药物2次,浓缩至终浓度为200 mg/mL,4 ℃保存备用。艾司唑仑片购于中国人民解放军中部战区总医院(批号:H42021522)。
试剂:RNA提取液(G3013)、RT First Strand cDNA Synthesis Kit(G3330)、2×SYBR Green qPCR Master Mix (High ROX)[A Synthesis Kit(G3322)],以上试剂均由武汉Servicebio公司提供;白介素1β(IL-1β)抗体(1905101141)和γ-氨基丁酸A1(GABA)受体抗体(39925)由武汉市皮诺飞生物科技公司提供,引物使用Primer-BLAST设计。
1.10 仪器
斑马鱼行为学信号采集处理系统(VPLS,V-Track 3.5);96孔板(Nest Biotech,批号:701001);体视显微镜(PXS-1020,上海蔡康光学仪器有限公司);台式高速冷冻型微量离心机(济南博科,TGL-16M型);荧光定量PCR仪(ABI,Stepone plus);超净工作台(济南博科,BBS-SDC型);超微量分光光度计(Thermo,Multiskan SkyHigh);DYCZ-40K型电泳仪;DYCZ-24D型电泳槽;WD-9413C型凝胶成像分析系统(北京六一仪器厂)。
2 方法
2.1 造模及分组
选取受精后5 d发育正常的幼鱼,分组及处理。
空白组:正常饲养24 h未处理;
模型组:用200 μmol/L的咖啡因持续处理24 h;
人参治疗组:在模型组的基础上,用不同剂量的人参水煎液给样处理24 h;
艾司唑仑治疗组:模型组基础上,用艾司唑仑片水溶液处理24 h。
2.2 斑马鱼药物最大耐受度(MTC)
人参水煎液给药浓度的确定按照动物药物毒理学[3- 4],确定使用药物最大耐受度( MTC),即药物不引起实验动物死亡的最大剂量,随机选取240尾5dpf斑马鱼,参考《中华人民共和国药典(2020版)第一部》人参用药剂量及斑马鱼与人体的药物/体重比例设置人参水煎液浓度梯度为1、2、4、8、16、32、64 mg/mL,共7组,每组40尾,处理24 h后观察各组死亡情况。艾司唑仑片药物最大耐受度参考本实验室前期数据[5],为0.05 mg/mL。
2.3 人参水煎液对斑马鱼睡眠剥夺模型行为学的影响
运用斑马鱼行为分析系统对斑马鱼在黑暗环境下的运动轨迹进行监测。
2.4 人参水煎液对斑马鱼睡眠剥夺模型的睡眠改善作用和镇静作用
实验结束后,各组分别随机选取斑马鱼12尾,使用斑马鱼行为学信号采集处理系统定量分析斑马鱼的睡眠改善率及镇静作用,其计算公式[6]如下:
式中,SIR表示睡眠改善率;T1、T2、T3分别为模型组、药物组、空白组的静息时间;SE表示镇静作用;D1、D2、D3分别为模型组、药物组、空白组的运动距离。静息时间和运动距离的行为学数据采集时间均为24 h。
2.5 RT-PCR检测GABRA1、IL-1β、HMOX1、HTR2A、HTR3A mRNA表达水平
各组取斑马鱼30尾,提取组织总RNA,扩增生成cDNA。设置PCR仪反应条件:95 ℃、3 min,95 ℃、5 s,60 ℃、30 s,共40个循环,测定GABRA1、IL-1β、HMOX1、HTR2A、HTR3A的基因表达量,用2-ΔΔCt表示mRNA相对表达水平,各个指标的引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.6 Western bolt检测GABRA1、IL-1β的表达水平
取冰冻处死的斑马鱼40尾,用PBS洗3次,加RIAP裂解液充分裂解,加入甲醇和Loading buffer,在沸水中煮10 min,使之变性;配置10%分离胶,每孔上样40 μg,80 V条件下电泳,至条带达到玻璃板底部时结束电泳,转膜,将PVDF膜置TBST室温封闭1 h,洗膜后将膜置于GABRA1、IL-1β抗体稀释液(1∶1 000)中,并置4 ℃冰箱孵育过夜,用PBST洗涤3次,每次5 min;洗膜后将PVDF膜置稀释后的二抗(1∶2 000),室温孵育1 h;向膜上滴加适量ECL显色液,置凝胶成像仪曝光各组条带值;应用ImageJ计算各条带灰度值。
2.7 统计方法
3 结果
3.1 人参活性化合物的筛选
基于TCMSP数据库,以药物标准OB≥30%和DL≥0.18为筛选条件,共获得人参的化合物共22个。化合物包括豆甾醇(stigmasterol)、人参二醇(panaxadiol)、人参皂甙Rg5_qt(ginsenoside Rg5_qt)等,各个活性成分的OB与DL值见表2。
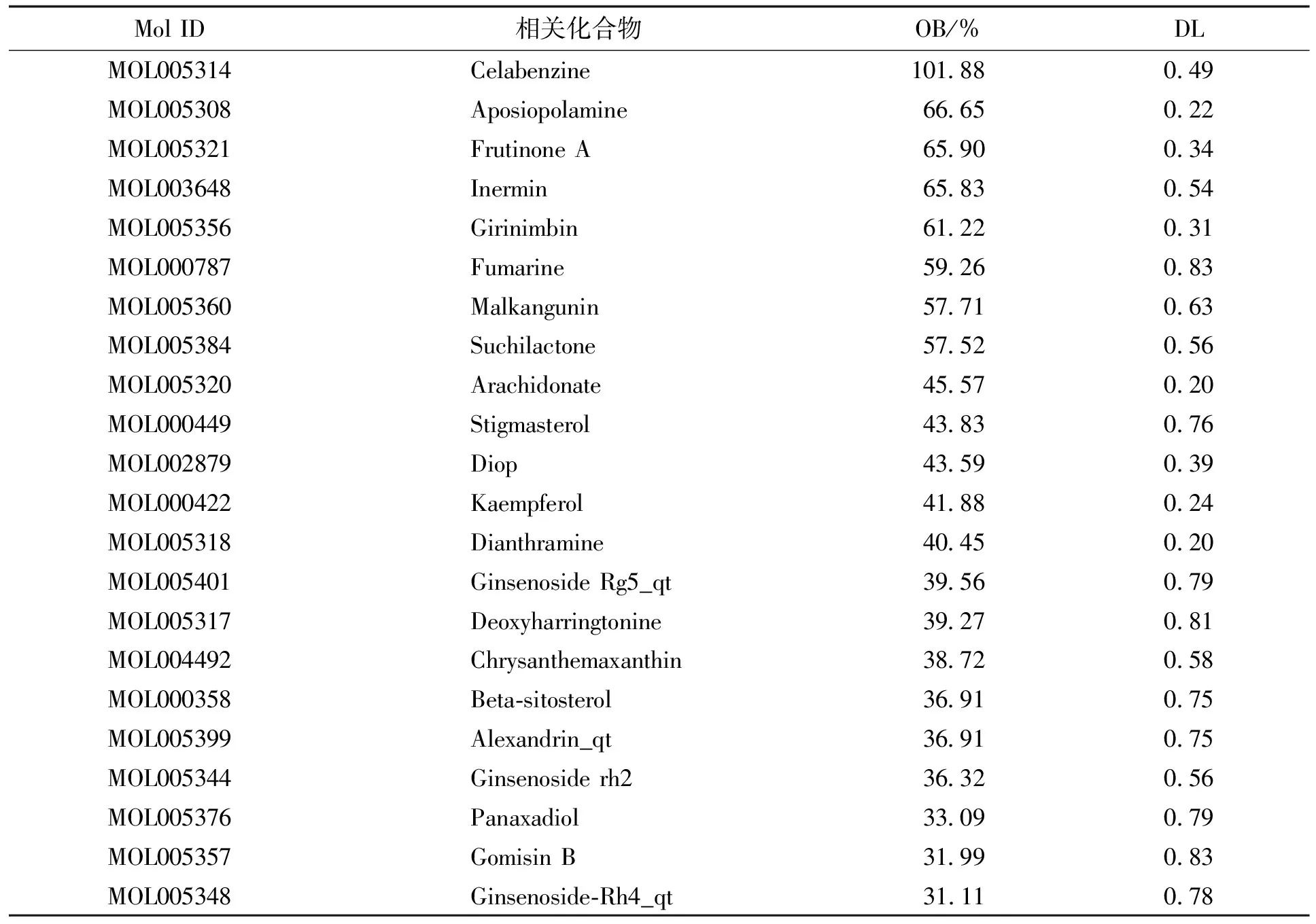
表2 人参化学成分Tab.2 Chemical composition of ginseng
3.2 人参化合物和靶点相互作用网络
为了直观地描述化合物分子与靶点之间的关系,将所纳入的蛋白导入STRING数据库,然后将非人类蛋白和重复的化合物成分靶点掉剔除,最终构建出“药物-化合物-靶点网络”,共得到16个化合物节点和77个靶点节点。如图1所示。
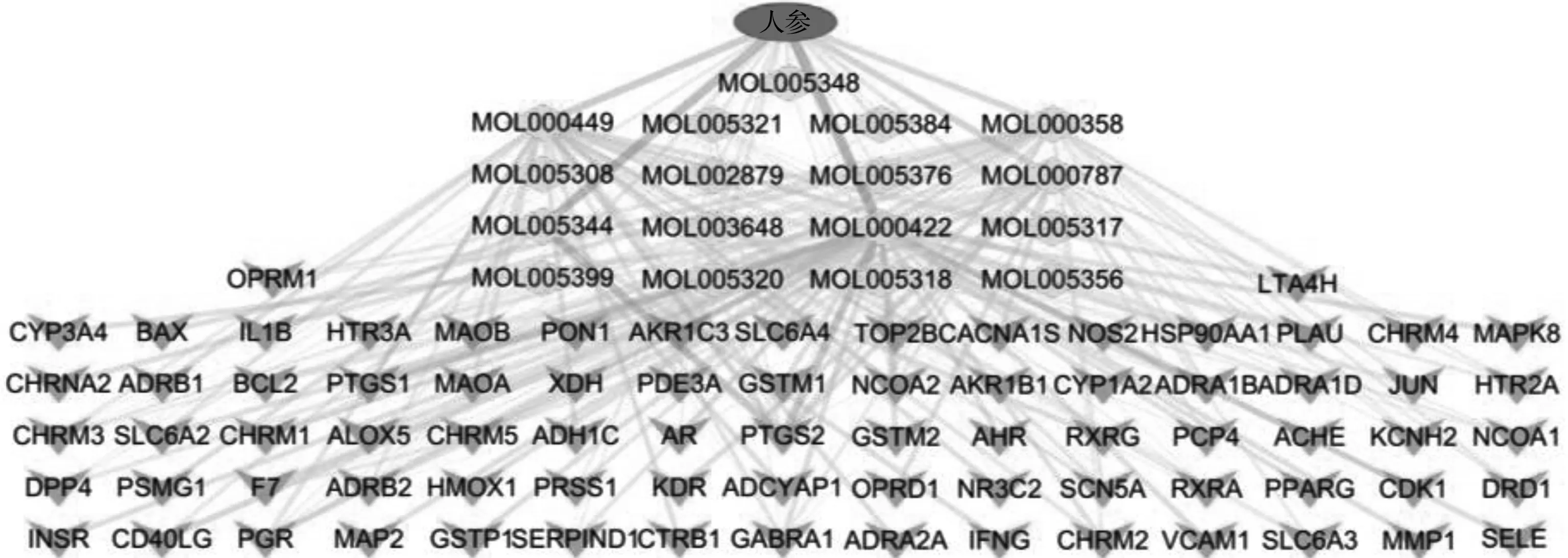
图1 药物-化合物成分-靶点的可视化关系图Fig.1 Visualization of the relationship between the targets of action of drug and compound components
3.3 人参对失眠的作用靶点
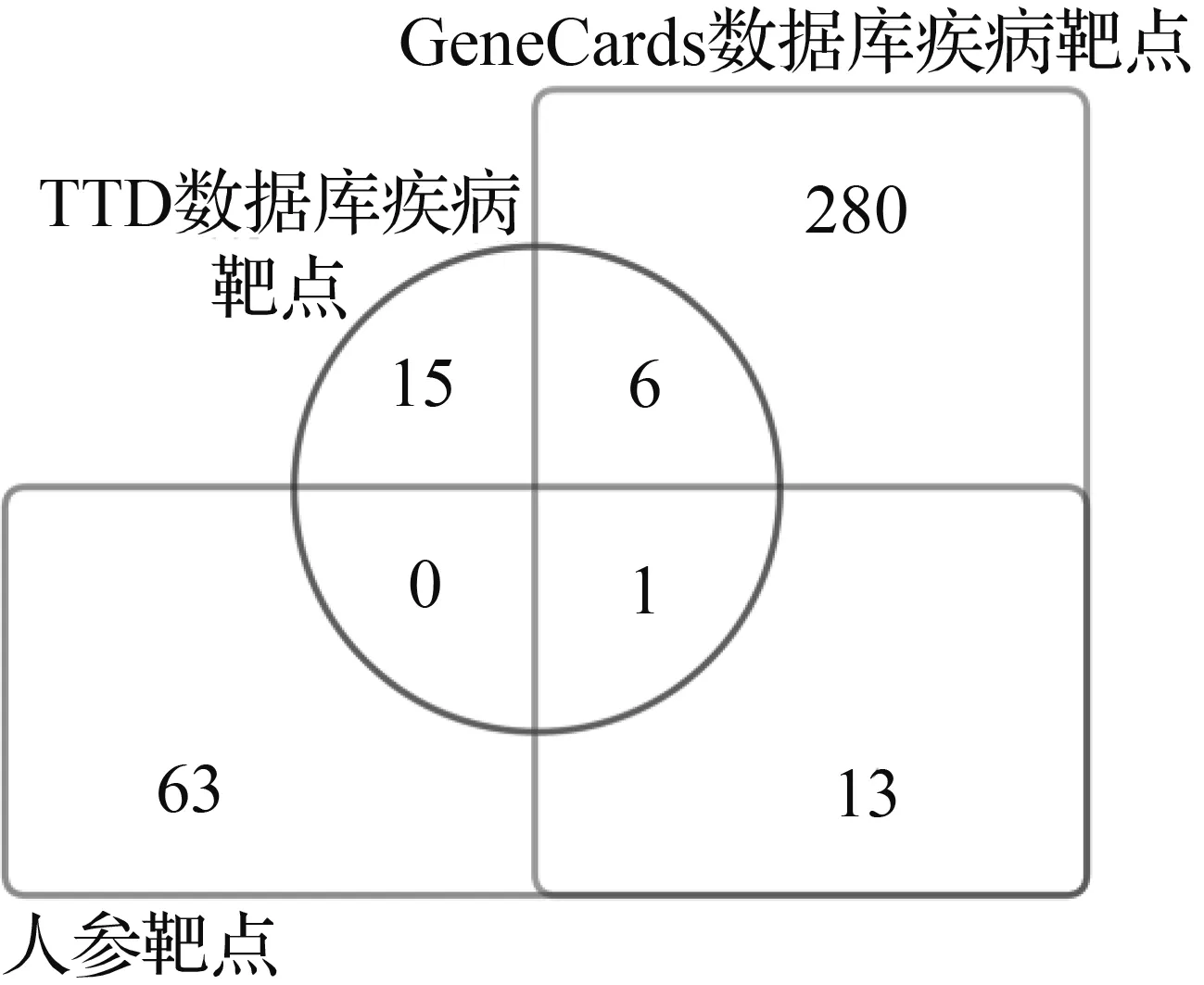
以“insomnia”为关键词,对GeneCards及TTD数据库进行挖掘,从GeneCards数据库中共获得疾病靶点2 563个,并按Gifts算法计算取其排名前300个;TTD数据库中获得22个疾病靶点,共搜集疾病靶点300个,基于Venn分析工具,将疾病靶点与人参化学成分靶点进行对比分析,得出人参成分靶点与失眠相关的13个靶点基因。如图2所示。
3.4 人参对失眠的作用靶点蛋白互作网络
为直观反应人参对失眠作用的潜在靶点的关系,对其进行可视化处理,通过Cytoscape软件,将人参与失眠相关的13个潜在靶点导入,构建PPI网络(图3)。由图3可知,这13个靶点是人参作用和失眠机制的重合靶点,其中与IL-1β关系最为密切,说明人参可能通过干预这个靶点治疗失眠疾患。
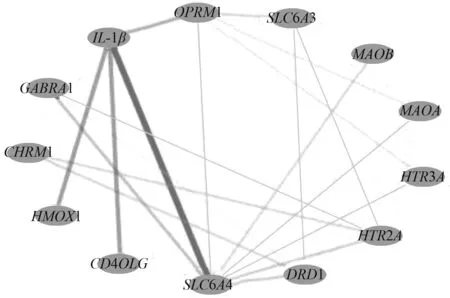
图3 人参对失眠作用靶点的蛋白互作网络图Fig.3 Network diagram of protein interactions of the targets of ginseng action on insomnia
3.5 人参对失眠作用靶点GO功能富集注释分析
为进一步探究人参中化合物靶点的基因功能,基于David数据库对其进行GO功能富集分析,共获得22个生物过程(BP),11个细胞组成(CC),7个分子功能(MF)。利用GraphPad软件,制作人参PPI网络的GO功能富集生物过程柱状图,如图4所示。
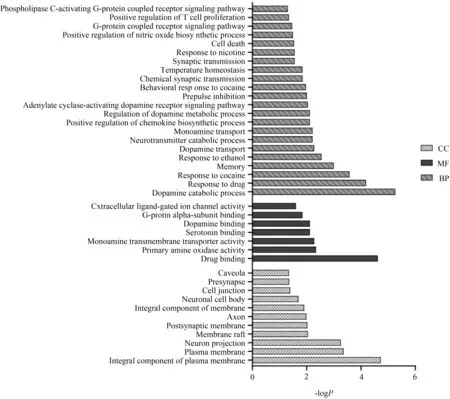
图4 人参对失眠作用靶点的GO功能分析生物过程Fig.4 Histogram of the biological process of GO functional analysis of ginseng’s action targets on insomnia
3.6 人参对失眠作用靶点KEGG通路富集分析
利用David数据库对人参的靶点在信号通路中作用进行KEGG通路富集分析功能,共得出14条信号通路,包括钙信号通路。利用omicshare平台做出气泡图,如图5所示。
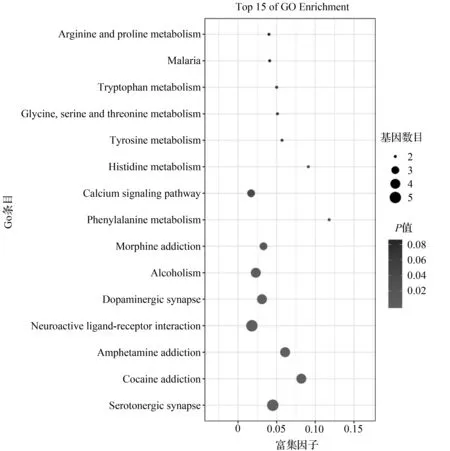
图5 人参对失眠作用靶点GO分析可视化结果Fig.5 Visualization results of GO analysis of ginseng’s action targets on insomnia
3.7 人参核心成分与失眠靶点分子对接
选取人参核心化学成分Celabenzine、ginsenoside rh2与失眠靶点分子GABRA1对接,Celabenzine对接分数为61.025,Ginsenoside rh2对接分数为88.29,结果如图6所示。

(a) Celabenzine

(b) ginsenoside rh2
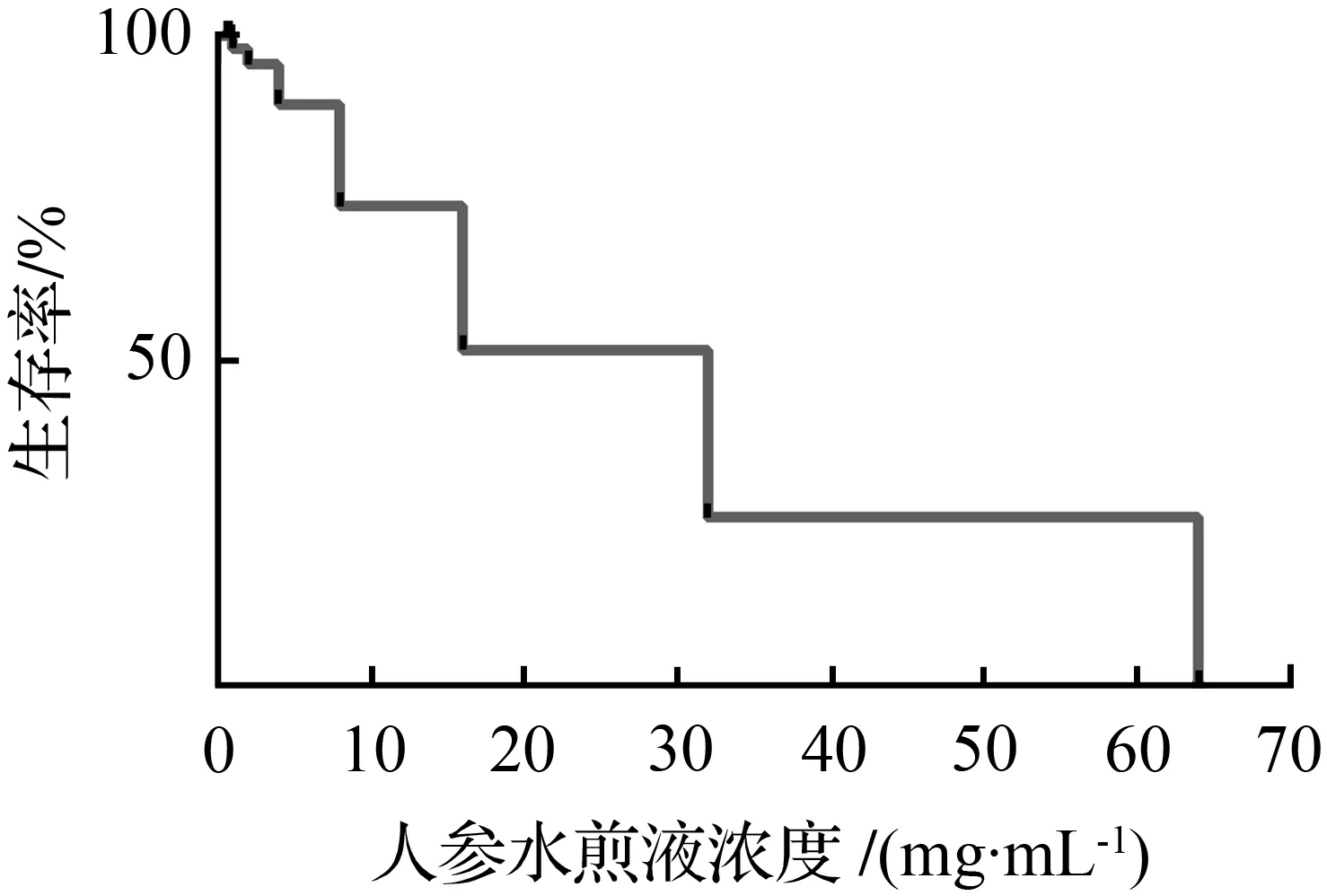
图7 人参水煎液浓度与斑马鱼生存率关系Fig.7 Relationship between the concentration of ginseng aqueous decoction and the survival rate of zebrafish
3.8 人参水煎液MTC的确定
根据2.2实验方法处理24 h后观察各组斑马鱼存活率,再次进行浓度筛选,最终确定人参水煎液的MTC为0.8 mg/mL,并以此剂量作为高剂量组,以1/3MTC为中剂量组,1/9MTC为低剂量组。根据人参水煎液MTC浓度探索实验绘制的生存率关系曲线如图7。
3.9 人参对斑马鱼睡眠剥夺模型行为学的影响
根据斑马鱼行为学追踪系统结果显示,斑马鱼运动轨迹以中运动为主(浅灰色,4~20 mm/s),夹有小运动(黑色,<4 mm/s)和大运动(深灰色,>20 mm/s),斑马鱼运动轨迹如图8所示。
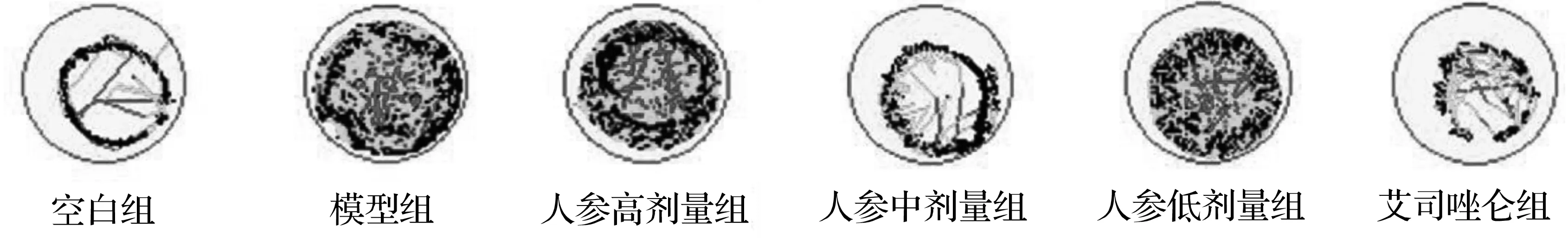
图8 不同组斑马鱼运动轨迹Fig.8 Movement trajectories of zebrafish in different groups
持续给药24 h后,各组斑马鱼静息时间与运动距离均发生改变,静息时间:与空白组相比,模型组静息时间明显减少(P<0.01),与模型组相比,人参中剂量组、艾司唑仑组静息时间明显增多(P<0.01),人参高剂量组、低剂量组静息时间未见明显变化(P>0.05);运动距离:与空白组相比,模型组运动距离明显增多(P<0.01),与模型组相比,人参中剂量组、艾司唑仑组运动距离显著减少(P<0.01),人参高剂量组、低剂量组运动距离未见明显变化(P>0.05),人参中剂量组运动距离与艾司唑仑相比未见明显差异(P>0.05)。如图9所示。
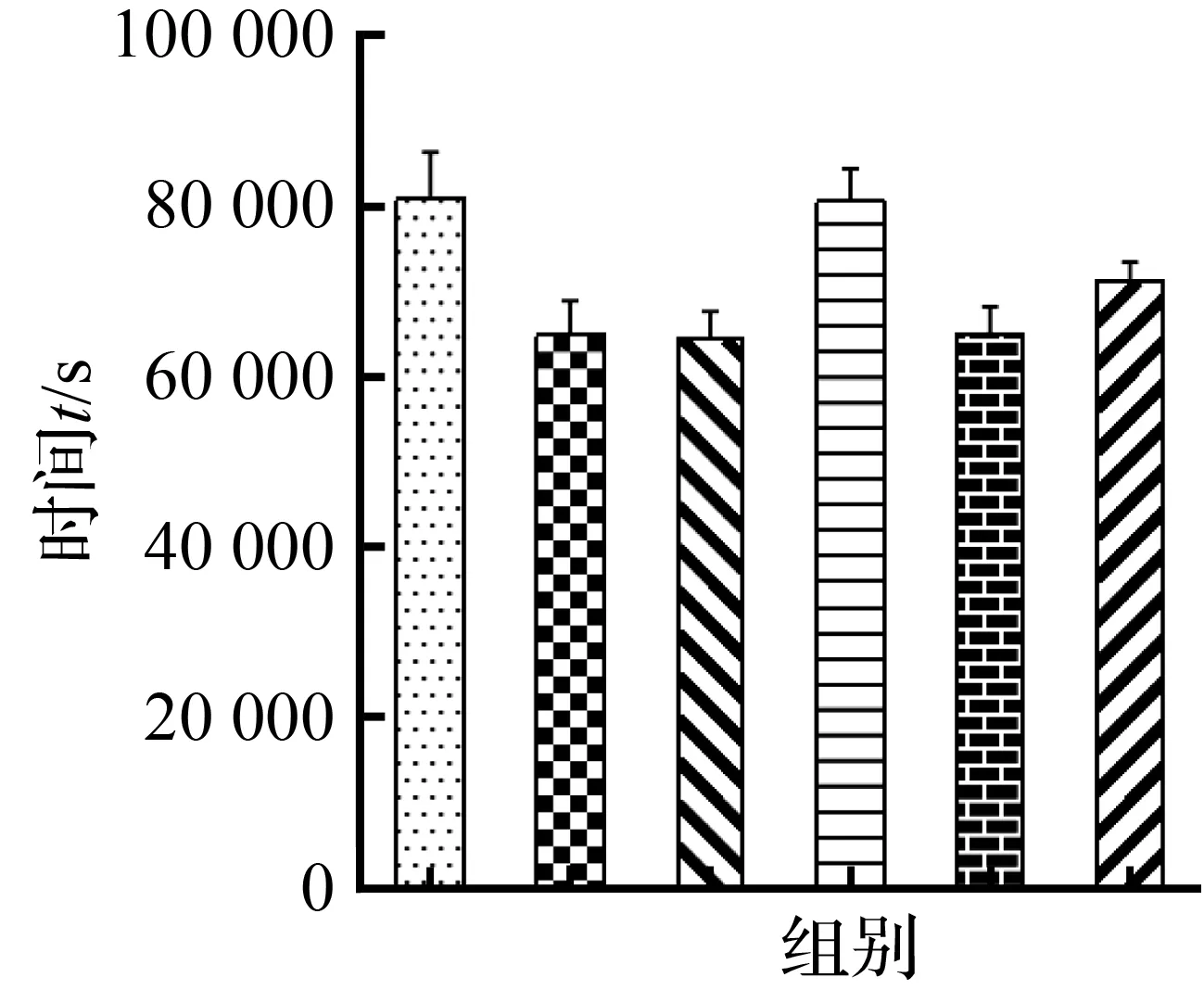
(a) 静息时间
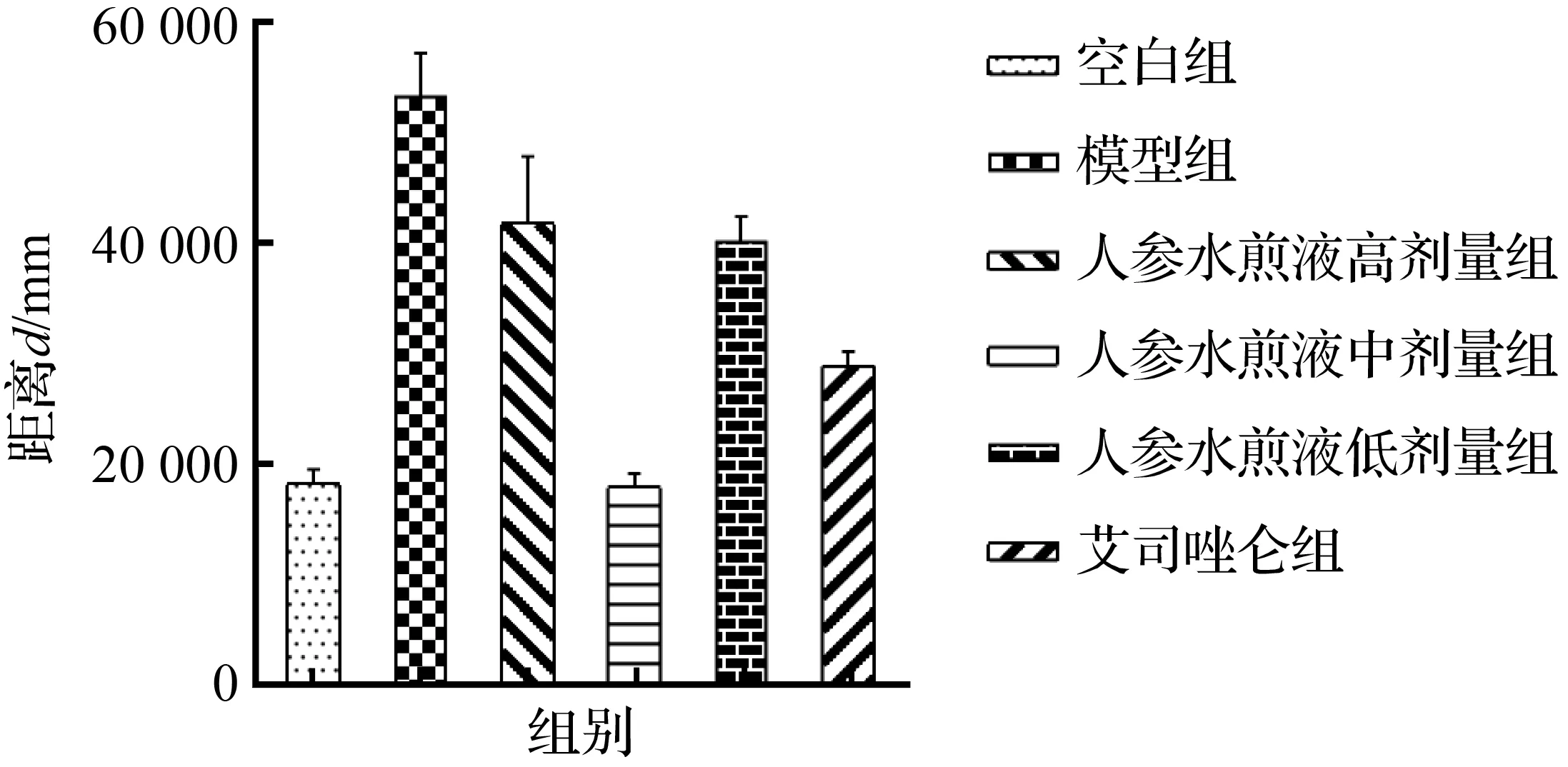
(b) 运动距离
3.10 人参对斑马鱼睡眠剥夺模型的睡眠改善作用和镇静作用
在观察的时间(86 400 s)内,斑马鱼睡眠剥夺模型静息时间(61 891.300±805.207) s高于正常对照组(84 297.233±851.846) s,差异有统计学意义(P<0.01)。与模型组比较,各组睡眠改善情况及镇静作用见表3。
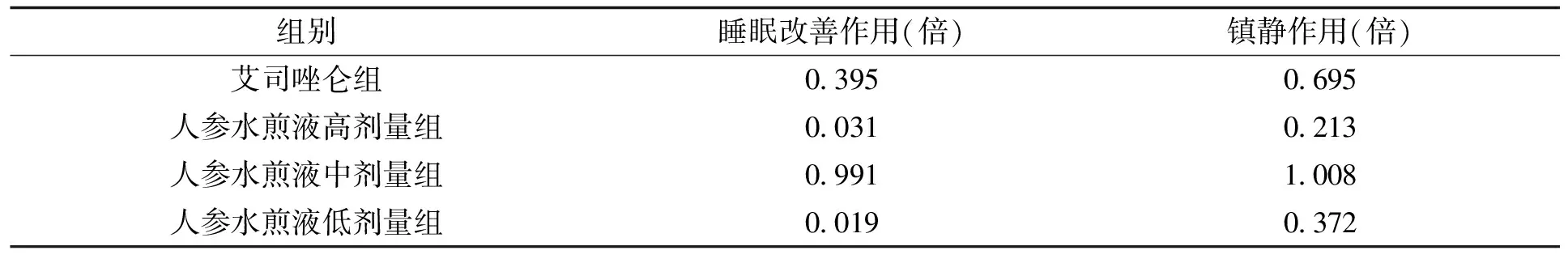
表3 人参水煎液对斑马鱼睡眠改善作用及镇静作用Tab.3 Improvement of sleep and sedative effect of ginseng aqueous decoction on zebrafish (n=12)
3.11 人参水煎液对GABRA1、IL-1β、HMOX1、HTR2A和HTR3A mRNA相对表达水平的影响
与空白组比较,模型组GABRA1、IL-1β、HMOX1、HTR2A和HTR3A表达均下降,差异有统计学意义(P<0.01);与模型组比较,人参中、低剂量、艾司唑仑组的GABRA1、IL-1β、HMOX1、HTR2A和HTR3A表达均升高(P<0.01,P<0.05),人参中剂量与艾司唑仑组、人参高剂量与模型组之间比较无差异(P>0.05),结果见表4。
表4 人参水煎液对GABRA1、IL-1β、HMOX1、HTR2A、HTR3A表达的影响Tab.4 Effect of ginseng aqueous decoction on the expression of GABRA1, IL-1β, HMOX1, HTR2A and HTR3A
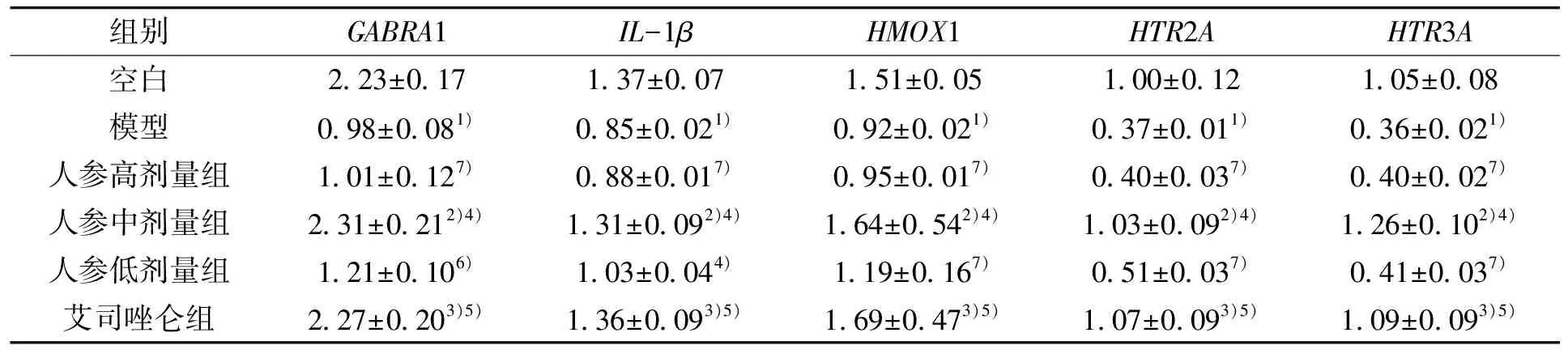
表4 人参水煎液对GABRA1、IL-1β、HMOX1、HTR2A、HTR3A表达的影响Tab.4 Effect of ginseng aqueous decoction on the expression of GABRA1, IL-1β, HMOX1, HTR2A and HTR3A
组别GABRA1IL-1βHMOX1HTR2AHTR3A空白2.23±0.171.37±0.071.51±0.051.00±0.121.05±0.08模型0.98±0.081)0.85±0.021)0.92±0.021)0.37±0.011)0.36±0.021)人参高剂量组1.01±0.127)0.88±0.017)0.95±0.017)0.40±0.037)0.40±0.027)人参中剂量组2.31±0.212)4)1.31±0.092)4)1.64±0.542)4)1.03±0.092)4)1.26±0.102)4)人参低剂量组1.21±0.106)1.03±0.044)1.19±0.167)0.51±0.037)0.41±0.037)艾司唑仑组2.27±0.203)5)1.36±0.093)5)1.69±0.473)5)1.07±0.093)5)1.09±0.093)5)
注:与空白组比较,1)P<0.01,2)P>0.05,3)P>0.05;与模型组比较,4)P<0.01,5)P<0.01,6)P<0.05;7)P>0.05。
3.12 人参水煎液对GABRA1、IL-1β蛋白表达的影响
与空白组比较,模型组各指标表达明显降低(P<0.05),人参中、低剂量、艾司唑仑组的蛋白表达量均升高(P<0.05),人参中剂量与艾司唑仑组,人参高剂量与模型组之间比较无差异(P>0.05)如图10所示。

4 讨论
通过网络药理学对人参的22个化学成分及其靶点通路进行了网络药理学分析。本次实验验证了GABRA1、IL-1β、HMOX1、HTR2A、HTR3A5个指标,此5个指标均可通过网络药理学富集信息得到。GABRA1为γ-氨基丁酸(GABA)A型受体α1亚单位,作为一种抑制性的神经递质受体,对失眠起着重要的调节作用[7]。现代医学认为失眠与免疫调节之间具有密切联系,IL-1β作为重要的促炎分子之一,具有调节睡眠唤醒的作用,有研究表明,围绝经期非器质性睡眠障碍患者的IL-1β表达明显升高,且随失眠的严重程度呈正相关[8],这可能与失眠时氧化应激状态增加有关。也有研究表明IL-1β在夜间睡眠时含量会增加,并且具有催眠作用,能不同程度地促进睡眠,这有可能是因为IL-1β影响了下丘脑神经递质的释放调节了睡眠[9]。HMOX1为血红素代谢过程中的重要酶,具有抗氧化防御的作用,有研究证实,部分睡眠剥夺和长期睡眠剥夺大鼠恢复期肺组织血红素氧合酶-1均升高[10]。HMOX1为抗氧化元件Nrf2的下游靶点,染料木素有效激活睡眠剥夺模型小鼠皮质和海马区的抗氧化元件Nrf2及其下游靶点,从而可以缓解由于睡眠剥夺模型引起的认知功能障碍[11]。有报道指出,五羟色胺(5-HT)在腹外侧视前区具有促进大鼠觉醒的作用,抑制慢波睡眠和快速眼动睡眠[12],SLC6A4作为5-HT的转运体,将5-HT从脑突触快速摄取到突触前神经元。有临床研究证实,所有的原发性失眠患者SLC6A4基因单核苷酸多态性均与失眠具有显著的相关性[13]。慢性的睡眠障碍会抑制SLC6A4的表达[14]。HTR2A、HTR3A作为五羟色胺受体,通过调节下丘脑-垂体-肾上腺轴对压力的反应、维持昼夜节律改善睡眠质量[15]。以上5个指标均对失眠和治疗起着重要的作用,提示人参可能通过抑制神经炎症、抗凋亡、抗氧化、调节神经递质等多种途径起到治疗失眠的作用。且斑马鱼的行为学结果亦显示人参具有调节睡眠剥夺斑马鱼睡眠时间和运动距离的作用。
本研究表明,人参治疗失眠的机制可能是通过上调GABRA1、IL-1β、HMOX1、HTR2A、HTR3A的基因表达,验证了网络药理学的结果,为深入研究人参治疗失眠提供了依据。

