一种犬瘟热病毒强弱毒株鉴别PCR检测方法的建立和初步应用
张 可,薛姣雄,喻 娇,唐青海※,曾繁荣,刘雪晴,隆泽桧,侯鑫军
(1.南岳山区生物资源保护与利用湖南省重点实验室,衡阳师范学院生命科学与环境学院,湖南衡阳421008;2.衡阳市畜牧水产事务中心,湖南衡阳421008)
犬瘟热病毒(Canine Distemper Virus,CDV)引起的犬瘟热(Canine Distemper,CD)传染性极高,临床症状的表现多样,各种年龄和性别的犬都会感染CDV,发病率高,染病的幼犬死亡率可达30%~80%[1,2]。CDV于1809年以来在世界范围内广泛流行,同年由Jeneer首次报道,1905年Carre发现其病原为一种病毒,1951年Dedie由组织培养方法分离得到CDV[3,4]。犬瘟热病毒的H基因是研究CDV变异情况的主要目的基因,H蛋白为CDV囊膜糖蛋白,具有血凝素功能,是病毒入侵宿主的重要调节蛋白,H基因变异会引起CDV的毒力变异,是最适合做CDV基因改变监测的基因[5,6]。
免疫接种是犬瘟热的预防控制主要手段,但曾经出现过免疫后的犬也感染了CDV的情况[7],且很多临床检测和分离的CDV毒株与疫苗株具有很高的同源性及亲缘关系[8,9],而弱毒疫苗是国内外使用最为广泛的犬瘟热疫苗,所以建立一种能鉴别CDV强弱毒株的检测方法至关重要。目前,能同时鉴别CDV强毒株和弱毒株的检测方法较少,研究最广泛的是聚合酶链反应(PCR)技术[10,11],其高效灵敏,特异性强。除了PCR技术,目前已经被用来鉴别CDV强弱毒株的方法还有环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[12],在60℃~65℃的条件下进行15~60分钟左右的恒温扩增,具有操作简单、特异性强、产物易检测等特点。
本试验主要根据CDV强毒株与弱毒株H基因的保守区域分别设计了2对特异性引物,通过优化PCR扩增反应的反应体系与反应程序来探寻最优的反应条件,从而建立一种犬瘟热病毒强弱毒株鉴别PCR的检测方法。
1 材料与方法
1.1 材料
菌株TOP-pMD19T-CDVH由南岳山区生物资源保护与利用湖南省重点实验室制备保存[13];第一链cDNA合成试剂盒、HindⅢ、EcoRⅠ和ExTaq酶购自宝生物工程(北京)有限公司;质粒提取试剂盒购自Axygen公司。
1.2 标准阳性模板的制备
取5μL菌株TOP10-pMD19T-CDVH到已加有8μL氨苄青霉素的4 mL/管的LB液体培养基中,37℃、160 rpm摇床中振荡培养16~20 h。用Axyprep质粒DNA小剂量提取试剂盒提取TOP10-pMD19T-CDVH的重组质粒,质粒的酶切鉴定体系为:质粒DNA 7μL、EcoRⅠ和HindⅢ各0.25μL、10×Buffer 2μL、ddH2O 10.5μL,酶切条件:37℃、35 min,1.2%琼脂糖凝胶进行电泳检测析,并测定其浓度。
1.3 引物的设计与合成
根据GenBank中已登录的CDV基因序列,采用Primer Premier 5.0软件在CDV的H基因的保守区内设计4对特异性引物,引物信息见表1,其中,①与②为弱毒株的引物,③与④为强毒株的引物,由深圳华大基因科技有限公司合成。
1.4 PCR扩增引物的筛选
利用表1中4对引物进行第一次PCR扩增反应,反应体系为:质粒DNA 2.0μL(10 ng/μL)、Ex-Taq 12.5μL、上下游引物各1.0μL(10μmol/L)、灭菌去离子水ddH2O 8.5μL。反应的程序为:95℃5 min;98℃10 sec,62℃20 sec,72℃20 sec,30个循环;72℃10 min;4℃保存。将PCR扩增产物于1.2%的琼脂糖凝胶中进行电泳鉴定。

表1 引物信息
1.5 PCR反应条件的优化
在第一次PCR扩增反应条件的基础上选择合适的引物、进一步探寻最优的PCR引物反应体系及反应程序,对反应总体系(10μL、15μL、20μL、25μL)、退火温度(72℃、68℃、62℃、56℃、50℃)、退火时间(5 s、10 s、15 s)、延伸时间(5 s、10 s、15 s)、循环次数(25、30、35、40、45)、阳性模板浓度(20 ng/μL、10 ng/μL、5 ng/μL、2.5 ng/μL)以及引物浓度(12.5μmol/L、10μmol/L、7.5μmol/L、6.25μmol/L、5μmol/L、2.5μmol/L)进行优化,确定最佳PCR反应条件。
1.6 犬瘟热病毒自然感染犬只的临床检测及病料采集
疑似犬瘟热感染犬只来自衡阳某养犬场,临床表现为有食欲减退、粪便呈水样、流眼泪、抽搐等症状。抽取5只犬的血液,编号为A1、A2、A3、B1和B2,另外再采集B1的粪便,用胶体金试纸条对5只犬的血液和B1的粪便进行检测。对犬进行解剖,观察犬的病理情况,取出病犬的心、肝、脾、肺、肾、肠等脏器备用。
1.7 PCR检测方法的初步应用
以A1、A2、A3、B1、B2的血液、心、肝、脾、肺、肾和肠为原料提取RNA,通过反转录合成第一链cDNA模板。其中,以A1、A2、B1、B2的血液以及A2的心、肝、脾、肺、肾、肠为原料制备的cDNA作为临床诊断的模板,用最优的反应体系及反应程序进行PCR扩增反应,反应体系为:cDNA 1μL,ExTaq 10μL,上下游引物(CDV-vac-F1397-1424与CDV-vac-R1587-1615,CDV-W-F1397-1424与 CDV-W-R1728-1752)各0.5μL,灭菌去离子水ddH2O 7μL。反应程序:95℃5 min;98℃10 sec,56℃5 sec,72℃15 sec,40个循环;4℃保存。PCR产物经1.8%琼脂糖凝胶电泳检测,拍照记录并分析结果。
2 结果
2.1 阳性模板的制备与鉴定
如图1所示,泳道2与泳道4为质粒,泳道1与泳道3为质粒的酶切产物,酶切结果为阳性,测得质粒的浓度为200 ng/μL,用无菌水稀释20倍(浓度为10 ng/μL)用于后续PCR扩增模板。
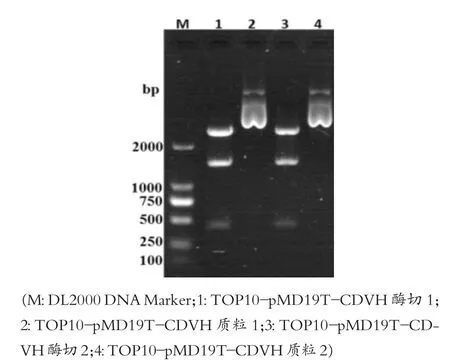
图1 菌株TOP 10-pMD19T-CDVH质粒及酶切检测结果
2.2 PCR扩增引物的筛选
采用引物(CDV-vac-F1397-1424和CDV-vac-R1587-1615)、(CDV-vac-F1101-1128和CDV-vac-R1423-1445)、(CDV-W-F1103-1128和CDV-W-R1423-1443)、(CDV-W-F1397-1424和CDV-W-R1728-1752)进行第一次PCR扩增,图2中泳道1和泳道2无特异性扩增条带,泳道3、泳道4在250 bp-500 bp之间都扩增出了明显的特异性条带,可知①②号引物不能扩增出特异性条带,③④能扩增出特异性条带,结果与预期大小相符,且④号引物比③号引物扩增效果更好。
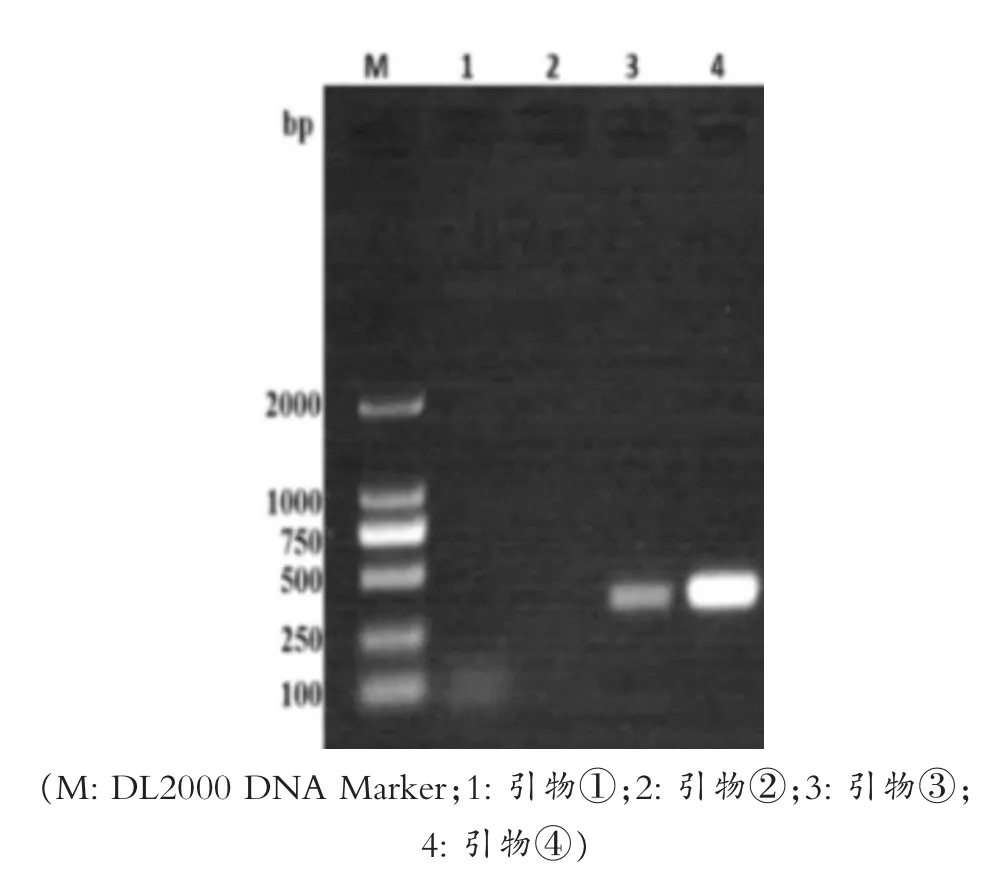
图2 第一次PCR扩增
2.3 PCR反应条件的优化
如图3所示,四对引物的扩增结果与第一次PCR扩增时一致,20μL时扩增效果最好,但为降低试验成本,先选择10μL为后续所有优化试验的总体系,选择④号引物作为强毒株的最优引物,同时选择与④号引物条带相差更大的①号引物作为弱毒株的引物进行后续优化试验。图4所示,设定的退火温度条件下都有特异性条带,其中泳道6,即62℃时的扩增效果最好。如图5所示,泳道2、4、6都扩增出了特异性条带,确定最佳退火时间为5 s。如图6所示,泳道2和泳道4扩增出了特异性条带,但泳道4的条带不明显,最终选择泳道2的15 s为最佳延伸时间。如图7所示,PCR循环次数越多扩增效果越好,选择了扩增效果较好的40次为最佳循环次数。模板浓度的优化结果显示5 ng/μL为最佳模板浓度(图8)。引物浓度优化显示,PCR扩增效果相差不大,最终选择中间值6.25 μmol/L为后续扩增浓度(图9)。
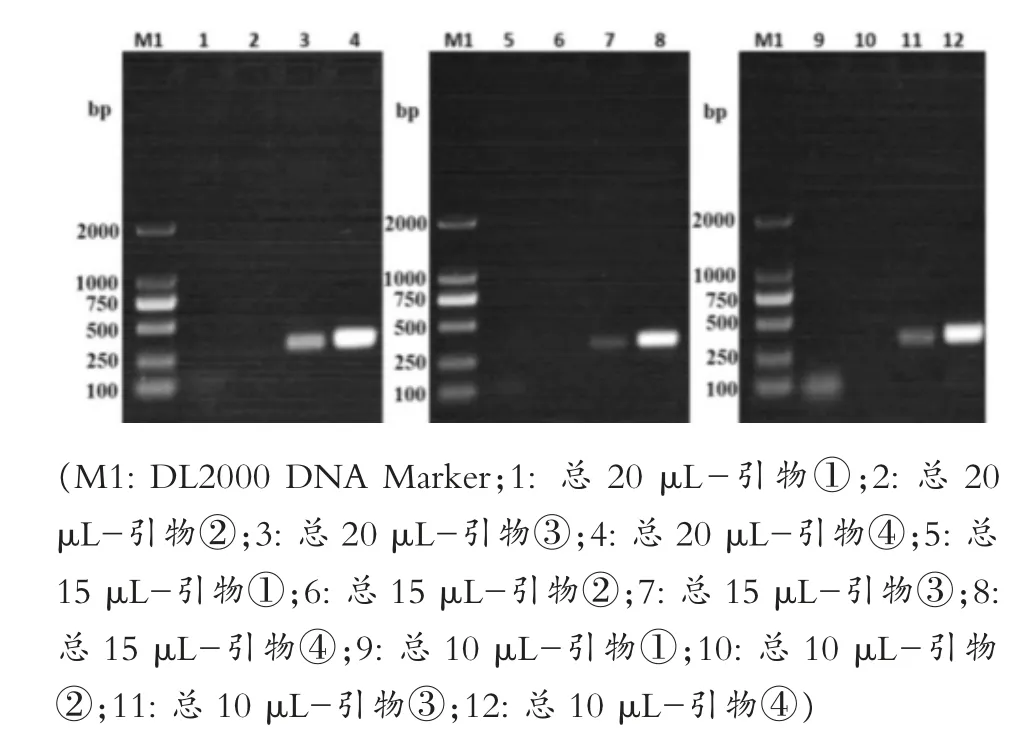
图3 反应总体系优化
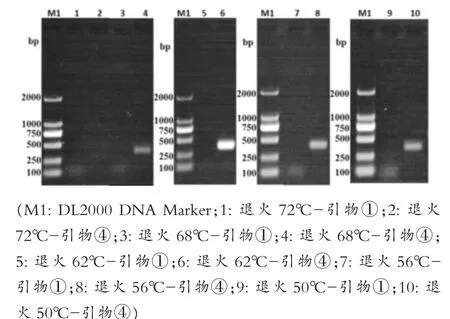
图4 退火温度优化
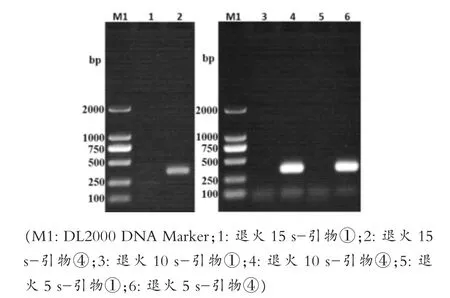
图5 退火时间优化
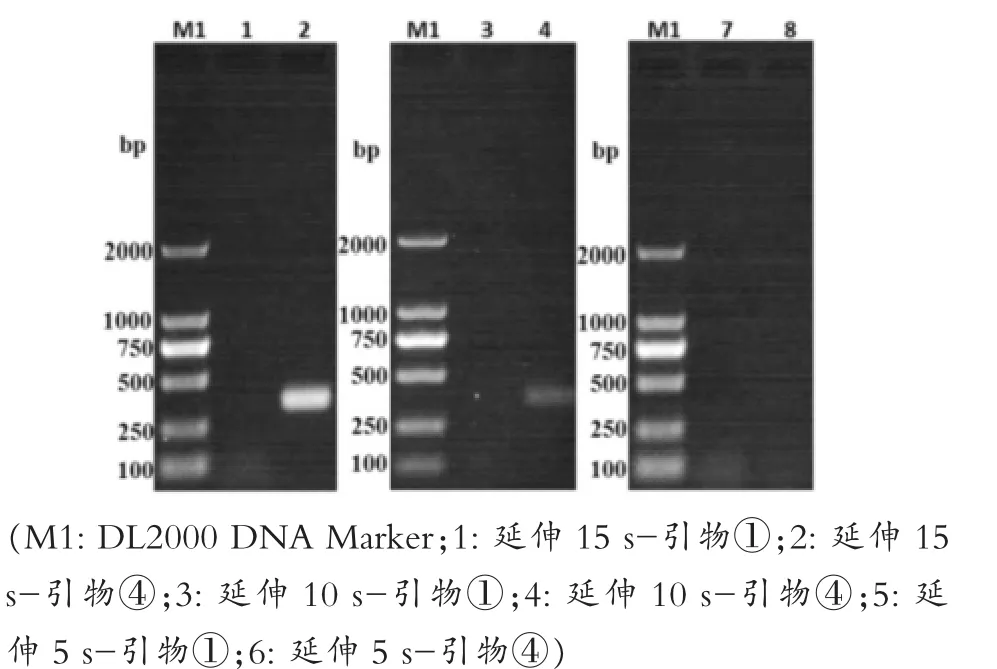
图6 延伸时间优化
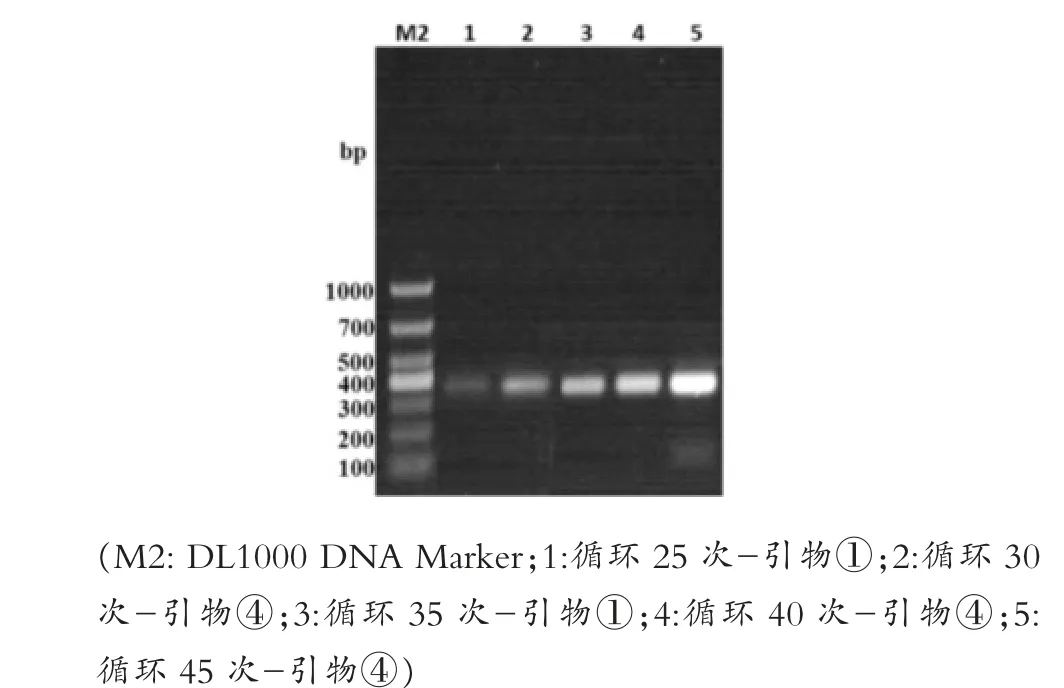
图7 循环次数优化
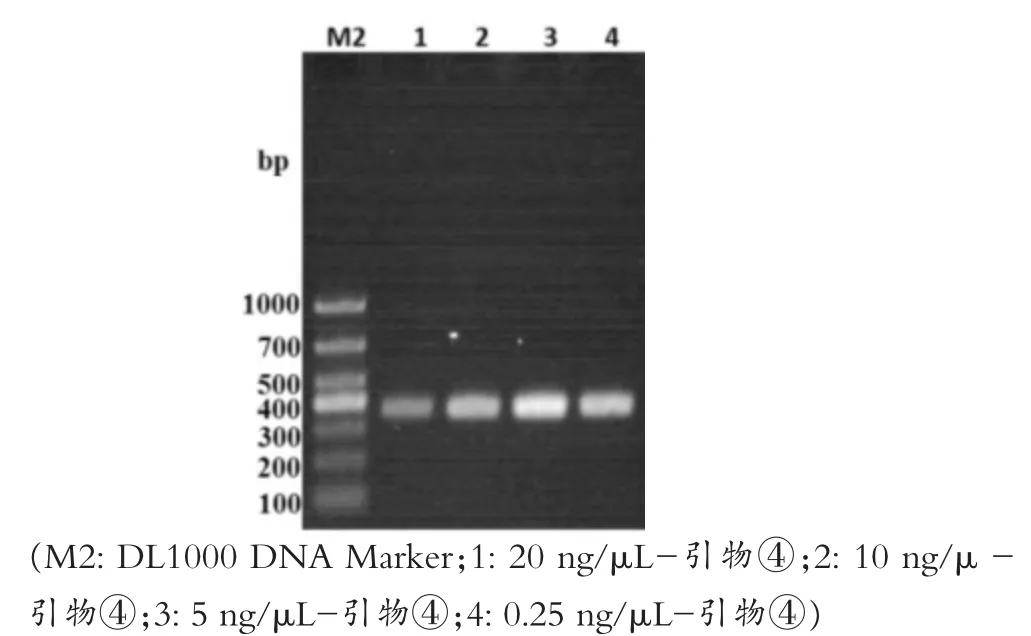
图8 模板浓度优化
最终PCR反应的最佳反应体系为:模板体积1μL(浓度5 ng/μL),ExTaq酶10μL,上下游引物体积各0.5μL(浓度6.25μmol/L),ddH2O 7μL;最佳反应程序为:95℃5 min;98℃10 sec,56℃5 sec,72℃15 sec,40个循环;4℃保存。
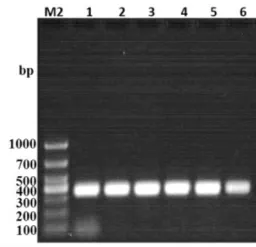
(M2:DL1000 DNA Marker;1:引物浓度12.5μmol/L-引物④;2:引物浓度10μmol/L-引物④;3:引物浓度7.5μmol/L-引物④;4:引物浓度6.25μmol/L-引物④;5:引物浓度5μmol/L-引物④;6:引物浓度2.5μmol/L-引物④)图9引物浓度优化
2.4 犬瘟热病毒自然感染犬只的临床检测结果
胶体金试纸条检测结果表明,5只犬血液为CDV阳性,B1的粪便为CDV阴性(图10)。图11为5只犬的腹腔解剖图,从图中可看出这5只犬已经处于脱水状态,肠道空虚且肠粘膜充血,其他脏器眼观无明显病变。

图10 胶体金试纸条检测结果
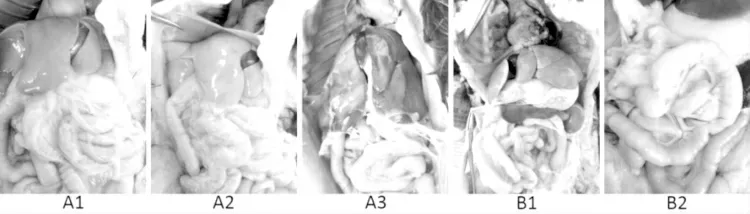
图11 A1、A2、A3、B1和B2腹腔解剖
2.5 PCR检测方法的应用
用上述优化好的PCR扩增方法检测临床样本,结果显示,泳道1、泳道2、泳道3及泳道4所检测的为A1、A2、B1及B2的血液均为CDV核酸阳性,A2的心、脾和肾都在300 bp左右处出现了特异性条带,检测结果为阳性,且为强毒株所感染,但肝、肺和肠为CDV核酸阴性(图12)。
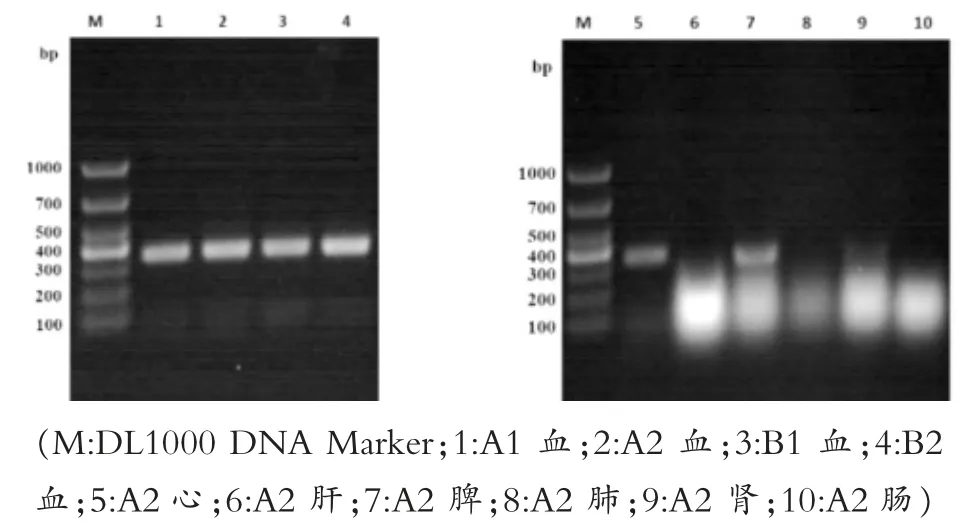
图12 临床诊断结果
3 讨论
本试验通过对CDV强弱毒株的H基因设计特异性引物,优化PCR反应体系及反应程序,建立了区分犬瘟热病毒强弱毒株PCR检测方法。所提取的强毒株模板不会与弱毒株扩增引物发生反应;强毒株的2对引物扩增的产物都出现了特异性条带,但引物CDV-W-R1423-1443和CDV-W-F1397-1424(引物③)所扩增的PCR产物都没有引物CDV-W-F1397-1424和CDV-W-R1728-1752(引物④)扩增的效果好。由于弱毒株的引物CDV-vac-F1101-1128和 CDV-vac-R1423-1445(引物②)与强毒株的引物④的条带大小相近,混合使用时PCR扩增结果不便区分,所以选用CDV-vac-F1397-1424和 CDV-vac-R1587-1615(引物①)作为弱毒株的引物。对反应总体系的优化中,虽然20μL的效果最好,从减少成本的角度,用10μL的总体系进行优化试验。退火温度、退火时间、循环次数、模板浓度及引物浓度的优化试验中,每种优化所设计的组别都能扩增出特异性条带,但产物的亮度会有一些差异;延伸10 s时,条带的亮度太浅,扩增效果不好,最后选择15 s延伸时间。
以本试验建立的CDV检测方法对CDV感染犬只样本进行检测,血液样本的PCR检测结果与胶体金结果完全相符;A2号犬只的肝、肺和肠PCR检测结果为CDV阴性,胶体金结果也显示肠道内容物为CDV阴性,由此可见,肝、肺、肠道及其内容不适宜作为CDV检测样本。PCR检测结果提示——心脏、脾脏、肾脏为CDV主要侵染器官。这些数据为CDV临床样本的准确采集提供了依据。
综上所述,本方法敏感性好、稳定性好、扩增效率高,可同时检测并区分犬瘟热病毒的强毒株和弱毒株,为犬瘟热病毒的有效诊断提供了技术支撑。

