一株从云南西部土壤中分离的蕈状芽孢杆菌(Bacillus mycoides)的抗氧化活性研究
*范集壮 程依婷 高玉婷 佘容* 杨晓燕
(1.大理大学天然抗氧化剂与抗氧化炎症研究院 云南 671003 2.中国三江并流区域生物多样性协同创新中心 云南 671003 3.大理大学 三江并流区域生物多样性保护与利用云南省创新团队 云南 671003 4.大理大学 东喜玛拉雅研究院 云南 671003)
前言
随着我国老龄化问题的加剧,暴露出了许多医疗健康问题,如关节炎、心脑血管疾病、衰老、肿瘤等许多老年性疾病正逐渐成为威胁着人们生命健康的重要疾病[1]。当前研究表明,自由基是引起这一生命趋弱化的重要因素,尤其是大量证据表明,在病理状态下、氧自由基的慢性或急性过度产生可诱发或加重心脑血管疾病,并且自由基对蛋白质和核酸的影响涉及面很广[2]。而对其预防的手段之一是使用清除自由基的药物,但目前市面上广泛使用的此类药物主要是人工合成的维生素C(Vit C)对人体健康有潜在威胁,因此不适宜长期服用。天然抗氧化剂是从天然物质中分离提取的,相比于合成维生素C,更适宜人长期服用,且其含有的其他天然活性成分更有利于人体吸收[3]。因此,对于天然抗氧化物的开发迫在眉睫。目前,关于天然抗氧化物的研究现主要集中在植物方面,利用微生物进行天然抗氧化开发的研究较少。
微生物是自然界的重要组成部分,微生物所产生的药物与一般化学药物相比,具有巨大的优越性,其主要表现为微生物生长周期短,易于选种培育,可在短时间内大规模发酵,容易实现工业化生产[4];其次关于微生物资源方面,学术界认为目前可培养微生物仍只是自然界的1%[5],其中未被开发利用的微生物资源非常丰富。但目前关于微生物抗氧化药物方面的研究主要集中在乳酸菌[6-7]和双歧杆菌[8],因此,如果能够扩大研究范围到其他微生物上,不仅能够丰富抗氧化微生物资源,还能在微生物抗氧化产品开发上起到促进作用。
蕈状芽孢杆菌(Bacillus mycoides)又称为腊状芽孢杆菌蕈状变种,属于芽孢杆菌属蜡状芽孢杆菌亚种[9],在自然界中广泛存在。已有研究表明,蕈状芽孢杆菌代谢产物具有提高免疫[10]、抑菌[11]、致病[12]等功能,但是关于其是否具有抗氧化活性的研究还未曾报道。基于此,本研究拟利用实验室已经分离获得的蕈状芽孢杆菌为研究对象,探索其作为抗氧化剂开发的潜能。研究拟以蕈状芽孢杆菌菌株的发酵产物提取物为对象,通过测定其对DPPH和ABTS的自由基清除率以及对FRAP的氧化还原能力评估样品的抗氧化能力,为利用蕈状芽孢杆菌进行天然抗氧化物的开发筛选提供参考信息。
1.材料与方法
(1)菌株与培养基
①菌株与培养基
供试菌株:蕈状芽孢杆菌SH-4 (大理大学东喜玛拉雅研究院保藏)。
②培养基
牛肉膏蛋白胨培养基:牛肉膏3g,蛋白胨10g,NaCl 5g,蒸馏水1000ml,调至pH7.4-7.6,121℃,30min灭菌备用。
(2)仪器与试剂
①仪器
冷冻干燥机(SCIENTZ-10N,宁波新芝生物科技股份有限公司),旋转蒸发器(RE-2000A,上海亚荣生化仪器厂),高速离心机(LG10-2.4A,北京医用离心机厂),可见分光光度计(722N,上海菁华科技仪器有限公公司),电子天平(PX224ZH,奥豪斯仪器有限公司),超声波清洗机(宁波新芝生物科技股份有限公司)。
②试剂
1,1-二苯基-2-三硝基苯肼(DPPH,海化成工业发展有限公司),2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,上海麦克林生化科技有限公司),2,4,6-三吡啶基三嗪(TPTZ,上海麦克林生化科技有限公司),抗坏血酸(Vit C,国药集团化学试剂有限公司),乙酸乙酯(天津市风船化学试剂科技有限公司),牛肉浸膏(广东环凯微生物科技有限公司),蛋白胨(北京奥博星生物科技有限责任公司),氯化钠(国药集团化学试剂有限公司),均为分析纯。
(3)试验方法
①菌株的纯化
在超净工作台取于甘油保种管的原始蕈状芽孢杆菌SH-4菌株在牛肉膏蛋白胨固体培养基上进行划线培养活化,然后放入28℃培养箱倒置培养。
②蕈状芽孢杆菌SH-4发酵液制备
将已经活化的蕈状芽孢杆菌SH-4菌株接种到灭菌的牛肉膏蛋白胨液体培养基中,于温度为28℃,140rpm/min摇床中培养3d。
③蕈状芽孢杆菌代谢产物提取
蕈状芽孢杆菌发酵好后用等体积的乙酸乙酯萃取,再应用超声辅助提取,超声条件:20℃、40Hz、60power、1h,超声完成后静置一晚,隔天取上清液进行旋蒸,旋蒸条件:30℃、40rpm/min。旋蒸完成后,将浓缩的提取物用少量蒸馏水超声辅助溶解,转移至已称重、干燥、干净的培养皿后置于-20℃冰箱,待提取物凝固后利用冷冻干燥机冷冻干燥数天,所获固体为菌体代谢产物。
④DPPH清除能力测定
DPPH溶液的配制:准确称取DPPH粉末1g,用无水乙醇溶解并定量转入1L棕色容量瓶中,用无水乙醇定容至刻度,摇匀,得质量浓度为1g/L的DPPH储备液,置于冰箱中冷藏备用。
DPPH标准曲线:吸取1mL DPPH储存液和19mL无水乙醇混合摇匀,将储备液稀释20倍,配制成50mg/L的DPPH工作液。再将工作液用无水乙醇依次稀释为5mg/L、2.5mg/L、2mg/L、1mg/L、0.5mg/L、0.05mg/L浓度做DPPH标准曲线使用。
DPPH自由基清除率的测定:准确称取蕈状芽孢杆菌乙酸乙酯提取物0.1g,用10ml无水乙醇溶解,得到10g/L提取物母液。再将提取物母液依次稀释为10g/L,5g/L,2.5g/L,1g/L,0.5g/L,0.25g/L,0.1g/L,0.05g/L,0.025g/L待测溶液,以等质量浓度的Vit C为参照。精确吸取0.7ml待测样品溶液和0.7ml DPPH工作溶液1:1混匀为实验组,对照组用0.7mL无水乙醇代替DPPH溶液,以加入0.7mL DPPH和0.7mL无水乙醇为标准组,每个浓度设置三个复孔,37℃水浴30min后用1mL比色皿于517nm分光光度计处测吸光值,计算清除率及IC50,并以Vit C的IC50为对照计算样本比活性[13-15]。
自由基清除率(%)=[1-(Ai-Aj)/A0]×100%
实验组吸光度记为Ai;对照组吸光度作为Aj;标准组吸光度作为A0值。
IC50计算:运用SPSS建立三个变量,分别是浓度,清除率和总数。建立好后输入数据,其中总数用1或者100表示,其他按实际输入。输好后使用回归中的Probit分析,其中响应频率为清除率,观测值汇总为总数,协变量为浓度,转换选择对数底为10,模型选择logit,随后在弹出的输出界面的置信限制中找到概率0.50的估计浓度即为IC50。
比活性的计算[16]:
“小时候,有个家伙欺负我,看到我的连环画就想抢走,我打不过他不知怎么办,就观察别的小孩,发现当一个小孩被人欺负的时候,就说我有一个哥哥,或者我有一个谁谁很厉害。当时我正好看了郑渊洁写的皮皮鲁的故事,于是我灵机一动对那个小孩说我有一个哥哥,名字叫皮皮鲁,可厉害了,你知不知道?他瞪着眼睛想了半天不知道皮皮鲁是谁,但被这个怪异的名字吓住了,居然放过了我。”
AE=1/IC50(AE为自由基清除能力)
AE(样品)=1/IC50(样品)
AE(Vitc)=1/IC50(Vitc)
比活性=AE(样品)/AE(Vitc)=IC50(Vitc)/IC50(样品)
⑤ABTS清除能力测定
ABTS工作液的配制:避光称取ABTS粉末30mg,加超纯水8mL溶解配制得7mmol/L ABTS水溶液,精密称取10mgK2S2O8加15mL超纯水溶解得4.9mmol/L过硫酸钾水溶液,将以上两种水溶液按1:1等量混合,置于4℃冰箱避光情况储存12-16h,得到ABTS母液备用。使用时,用无水乙醇在734nm稀释至吸光度为0.70±0.02Abs范围内工作液。
ABTS标准曲线:将Vit C用无水乙醇依次稀释为10mg/L,7.5mg/L,5mg/L,2.5mg/L,1.25mg/L,0.25mg/L浓度。样品和ABTS工作液体积比按1:3加入反应,做ABTS标准曲线使用。
ABTS自由基清除率(%)=[1-(Ai-Aj)/A0]×100%
实验组吸光度记为Ai;对照组吸光度作为Aj;标准组吸光度作为A0值。
⑥总抗氧化能力(FRAP法)的测定
TPTZ工作液的配制:分别配置醋酸盐缓冲液(pH3.6),10mmol/L TPTZ溶液,20mmol/L FeCl3溶液,并按照体积比10:1:1混合,制成TPTZ工作液。
FeSO4·7H2O标准曲线的绘制:配置成1.6mmol/L,0.8mmol/L,0.4mmol/L,0.2mmol/L,0.1mmol/L不同浓度FeSO4标准溶液,取不同浓度FeSO4标准溶液0.1mL,分别加入TPTZ工作液2.4mL,混匀后37℃避光反应10min,593nm测定吸光度,并根据FeSO4浓度与吸光度绘制标准曲线。
样本总氧化还原能力测定:准确称取蕈状芽孢杆菌乙酸乙酯提取物0.1g,用10mL乙醇溶解,得到10g/L提取物母液。用无水乙醇将提取物母液梯度稀释为5g/L,2.5g/L,1g/L,0.5g/L,0.25g/L,0.1g/L,0.05g/L,0.025g/L浓度的待测液。精确吸取待测样液0.1mL,加入TPTZ工作液2.4mL,37℃条件下水浴10min,于593nm处测定吸光度为实验组。同时,以无水乙醇代替TPTZ工作液分别与不同浓度FeSO4标准溶液反应,所得吸光度为对照组吸光度。根据FeSO4·7H2O标准曲线求得1.0mmol/L标准FeSO4和TPTZ工作液反应,所得吸光度为标准组吸光度[15]。
FRAP值计算:
FRAP=(Ai-Aj)/Ao
其中,Ai为实验组吸光度;Aj为对照吸光度;Ao为标准吸光度。
2.结果与分析
(1)DPPH自由基清除率
①DPPH自由基标准曲线
DPPH自由基标准曲线结果显示DPPH溶液在0.05mg/L-5mg/L浓度范围内,浓度与清除率呈现良好的正相关关系,其回归方程y=-5.5084x2+45.365x-4.8754,相关系数R2=0.9842,如图1。

图1
②DPPH自由基清除率测定结果
蕈状芽孢杆菌乙酸乙酯粗提取物具有良好的清除DPPH自由基的能力,且随着样品浓度的升高,清除能力增加。提取物质量浓度0.025g/L到10g/L之间,DPPH自由基清除率从(2.23±0.01%)增加到(95.74±0.02%)。样品的IC50为1.395g/L是Vit C的0.0717%(Vit C的IC50为0.001g/L),如图2。
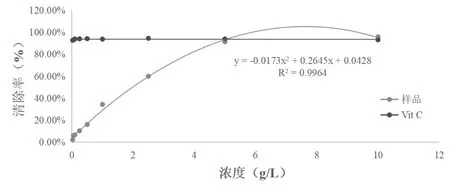
图2 DPPH自由基清除率的测定结果
(2)ABTS法测定
①ABTS自由基标准曲线
ABTS自由基标准曲线结果显示ABTS溶液在0.25mg/L-10mg/L浓度范围内,浓度与清除率呈现良好的正相关关系,其回归方程y=0.602x2+1.1322x,相关系数R2=0.9766,如图3。
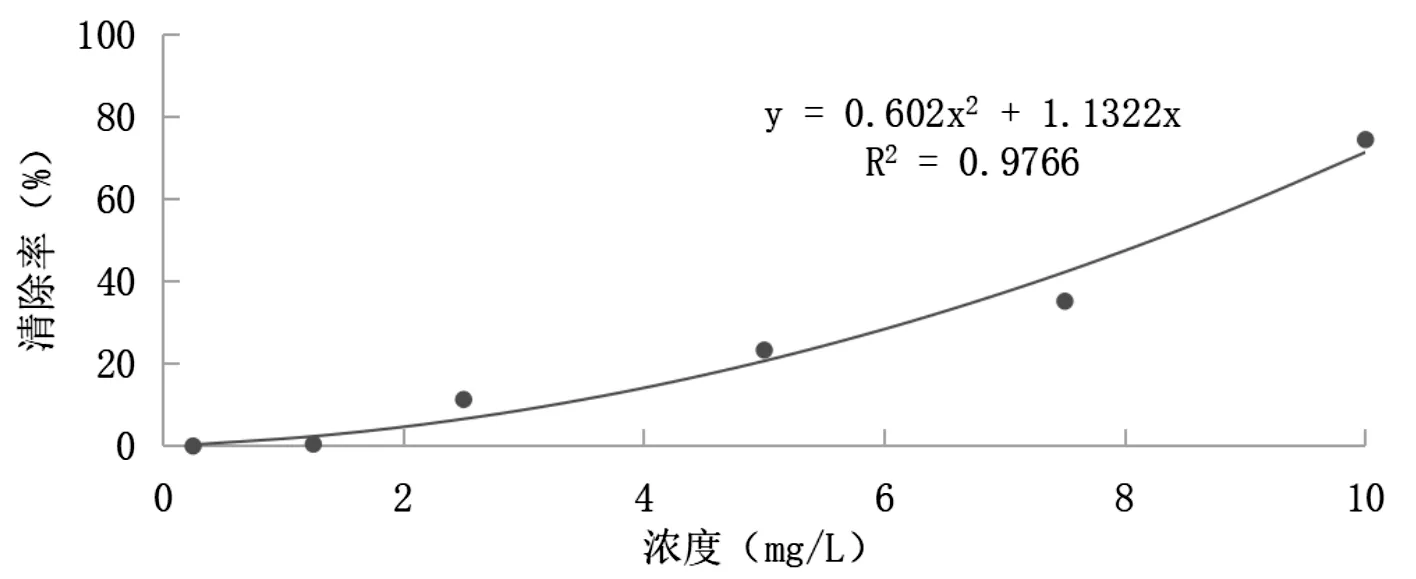
图3 ABTS自由基标准曲线
②ABTS自由基清除率测定结果
蕈状芽孢杆菌乙酸乙酯粗提取物对ABTS自由基的清除率随浓度升高明显的增加。在试验浓度0.025g/L到0.5g/L浓度范围内,当浓度为0.025g/L时,清除率可达(23.76±0.0055%),浓度为0.5g/L时,清除率高达(88.30±0.0018%)。样品的IC50为0.0830g/L,为Vit C的9.639%(Vit C的IC50为0.008g/L),蕈状芽孢杆菌粗提物具有较好的清除效果,如图4。

图4 ABTS自由基清除率的测定结果
(3)总抗氧化能力(FRAP法)测定结果
①FeSO4·7H2O标准曲线
FeSO4溶液在0.1-1.6mmol/L范围内,与TPTZ工作液反应,其浓度与吸光度呈现良好的正相关关系,标准曲线方程y=-0.0322x2+0.148x+0.0699,R2=0.9999,如图5。

图5 FeSO4标准曲线
②蕈状芽孢杆菌总抗氧化能力
蕈状芽孢杆菌乙酸乙酯粗提物在试验浓度0.025g/L~10g/L下,总还原力随着浓度的增加而升高,FRAP值从0.3267mmol/L增加到1.502mmol/L,如图6。

图6 FRAP总抗氧化能力的测定结果
3.结论与讨论
(1)粗提液浓度不同影响抗氧化效果
低浓度抗氧化剂起抗氧化效果,高浓度抗氧化剂起促氧化效果。本实验结果也显示,在低浓度下蕈状芽孢杆菌粗提物对自由基的清除率随浓度的升高而上升,但当清除率达到峰值后升高浓度,粗提物对自由基的清除率不升反降。2011年,《Cell》杂志就曾指出,低浓度自由基能刺激机体启动保护机制,进而提高机体抗氧化能力[17]。说明对于抗氧化剂使用的剂量越多对于自由基的清除效果并非越好,甚至Sesso等就曾证实Vit C和Vit E不仅不能有效的预防心血管疾病,Vit E甚至还会增加血性中风的概率[18]。
(2)抗氧化微生物资源丰富
目前对于抗氧化微生物的筛选主要集中在高原、荒漠[19-20]、深海[21]等异质性较强的生境中,在这样极端的环境中的微生物就更容易受到氧化损伤,这也就更可能刺激在极端环境中存活的微生物形成了独特抗逆机制来保护自身的生存和传代。那在极端环境中就更有利于我们筛选出具有抗氧化性的微生物。云南西部地区受综合地理因素影响,自然气候景观多种多样,是亚洲地区生物多样性最高的区域,所蕴含微生物资源非常丰富。本研究自云南西部土壤中分离所得蕈状芽孢杆菌的发酵液粗提物表现出很好的抗氧化能力,可进一步探究其有效抗氧化分子及抗氧化机制,为开发新型、优质天然抗氧化及提供参考。

