早期低剂量肠内营养对重症颅脑损伤患者的临床影响
罗辑
(辽健集团抚矿总医院重症医学科,辽宁 抚顺 113000)
重度颅脑损伤属于神经外科的危重疾病之一,主要由于脑部遭受外部暴力而引起较为严重的损伤,患者通常伴有较为严重的多脏器损伤,无法自主饮食,且患者多处于严重应激状态,易造成神经、内分泌等系统紊乱,不仅会导致肠黏膜屏障功能严重受损,还会导致机体出现炎症反应,严重威胁患者生命安全[1]。因此,针对重度颅脑损伤患者,在临床治疗的过程中需辅以营养支持。常用的方法为早期肠内营养支持,可为患者及时提供足够营养,但由于患者应激反应极为强烈,胃肠承受能力有限,可能加剧血糖波动水平,不利于患者的康复。早期低剂量肠内营养在患者胃肠可承受的范围内。本研究旨在探讨早期低剂量肠内营养对重症颅脑损伤患者的临床影响,现报道如下。
1 资料与方法
1.1 临床资料 选取2015 年4 月至2019 年12 月本院收治的100例急性重症颅脑损伤患者,根据术后营养支持剂量的不同分为对照组和观察组,每组50 例。对照组男27 例,女23 例;年龄34~52 岁,平均(44.56±5.37)岁;致伤原因:打击致伤 16 例,高处坠落 18 例,车祸 16 例。观察组男 28 例,女22 例;年龄36~52 岁,平均(44.94±5.41)岁;致伤原因:打击致伤19 例,高处坠落17 例,车祸14 例。两组临床资料比较差异无统计学意义,具有可比性。所有患者均对本研究知情同意并自愿签署知情同意书。本研究已通过医院伦理委员会审核批准。
纳入标准:符合重症颅脑损伤临床诊断标准并经影像学检查确诊;发病时间<24 h,且存活时间>30 d;年龄18~65岁;入院前未出现休克症状。排除标准:中途要求转院退出研究;合并消化道疾病;未进行消化道手术治疗;严重营养不良;临床资料不完整。
1.2 方法 两组入院后均行常规治疗,包括控制颅内压、保护脑神经、给予甘露醇脱水及清除自由基等治疗,术后24 h内置入鼻胃管,采用鼻饲营养胃管注食方式给予肠内营养支持,肠内营养液选用瑞先(费森尤斯卡比华瑞制药有限公司,国药准字H20040188),营养液温度38 ℃左右。对照组采用早期足量肠内营养支持:每天热量供给30~35 kcal/kg,蛋白质1.5~1.8 g/kg,连续治疗1周。观察组采用早期低剂量肠内营养支持:每天热量供给16~20 kcal/kg,蛋白质1.2~1.6 g/kg,连续治疗1周。
1.3 观察指标及评价标准 ①比较两组血糖值、胰岛素总用量。使用血糖检测仪分别检测两组血糖,每4 小时检测1次,并根据血糖检测结果调整胰岛素用量,比较血糖值>7.8 mmol/L 的频次、胰岛素总用量。②比较两组炎性反应、肠屏障功能。分别于两组治疗前、治疗后1周采用酶联免疫吸附法检测炎性反应指标[白细胞介素-6(IL-6)、C反应蛋白(CRP)及肿瘤坏死因子-α(TNF-α)],通过肠道屏障功能分析系统检测肠屏障功能指标[D-乳酸、血浆二胺氧化酶(DAO)及血浆内毒素(ET)水平]。
1.4 统计学方法 采用SPSS 22.0统计学软件分析数据,计量资料以“”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组血糖值、胰岛素总用量比较 观察组血糖值>7.8 mmol/L 频次、胰岛素总用量均低于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组血糖值、胰岛素总用量比较
2.2 两组炎性反应、肠屏障功能比较 治疗前,两组IL-6、CRP、TNF-α、D-乳酸、DAO、ET 水平比较差异无统计学意义;治疗后1周,观察组IL-6、CRP、TNF-α、D-乳酸、DAO、ET水平均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组炎性反应、肠屏障功能比较()
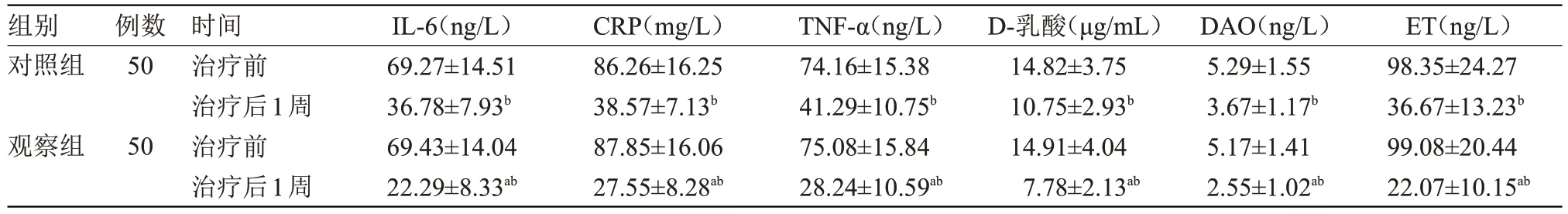
表2 两组炎性反应、肠屏障功能比较()
注:IL-6,白细胞介素-6;CRP,C反应蛋白;TNF-α,肿瘤坏死因子;DAO,血浆二胺氧化酶;ET,血浆内毒素。与对照组比较,aP<0.05;与本组治疗前比较,bP<0.05
组别对照组ET(ng/L)98.35±24.27 36.67±13.23b 99.08±20.44 22.07±10.15ab例数50观察组50时间治疗前治疗后1周治疗前治疗后1周IL-6(ng/L)69.27±14.51 36.78±7.93b 69.43±14.04 22.29±8.33ab CRP(mg/L)86.26±16.25 38.57±7.13b 87.85±16.06 27.55±8.28ab TNF-α(ng/L)74.16±15.38 41.29±10.75b 75.08±15.84 28.24±10.59ab D-乳酸(μg/mL)14.82±3.75 10.75±2.93b 14.91±4.04 7.78±2.13ab DAO(ng/L)5.29±1.55 3.67±1.17b 5.17±1.41 2.55±1.02ab
3 讨论
罹患重症颅脑损伤的患者易在受伤后短时间内出现神经内分泌紊乱情况,从而导致体内糖、蛋白质等营养物质严重缺乏,若患者此时无法进食或进食量不足,其肠壁黏膜血流会发生改变,出现低灌注情况,导致毛细血管通透性增加,肠道易遭受细菌或毒素侵入,使身体免疫力下降及生理功能逐渐减退[2]。因此,若不及时给予重症颅脑损伤患者所需营养,会造成机体严重损伤,最终导致全身炎症反应,严重影响患者的治疗与预后。虽然重症颅脑损伤在一定程度上影响患者的胃肠蠕动与吸收功能,但由于患者的肠道仍能进行较为正常的蠕动,因而患者仍可通过肠道吸收获取和补充能量[3]。在目前的临床治疗中,早期肠内营养支持已作为必不可少的治疗辅助手段之一。一方面,早期肠内营养支持可通过鼻饲营养胃管注食的方式将营养物质输送至患者的胃肠道中,进而刺激肠道蠕动,促进胃肠功能恢复;另一方面,早期营养支持既能促进患者胃肠黏膜的血液循环,又能有效改善胃肠黏膜细胞结构,进而促进黏膜免疫屏障形成,有利于降低肠源性感染[4-5]。但由于重症颅脑损伤患者在创伤性应激的情况下会造成其体内血糖过高,而足量的早期长期营养支持则易对患者的肠胃造成过度刺激,进而加剧患者血糖水平波动,严重影响患者的治疗[6]。因此,选择合适的肠内营养支持模式具有重要意义。
针对重症颅脑损伤患者实施早期低剂量肠内营养支持,能为患者提供所需的营养物质,加上剂量相对较小,在患者胃肠可承受范围内,减少对患者胃肠道造成的刺激,进而降低血糖水平,使血糖水平尽可能控制在7.8 mmol/L 内,且能减少胰岛素的使用量[7]。此外,实施早期低剂量肠内营养支持还能改善患者肠黏膜上皮细胞的修复能力,增强患者肠黏膜屏障功能,而良好的肠黏膜屏障功能有助于提高患者抵抗细菌或毒素侵袭能力,增强患者自身免疫功能,进而在一定程度上抑制胃肠内细菌或毒素的生成与移位,有利于缓解机体的炎症反应[8]。IL-6与TNF-α 均属于促炎递质,在临床上可用于反映感染程度;作为一种急性期反应蛋白,CRP常用于评估感染及应激反应水平,当人体发生感染或出现损伤后,该因子会在血液中大量合成[9]。D-乳酸可用于评估患者肠道通透性及肠黏膜损伤程度,DAO 是一种具有高度活性的肠黏膜抗氧化酶,其水平高低可用于评估肠黏膜修复能力,而ET水平不仅是评估肠黏膜屏障的关键指标,还可指示毒性程度[10]。本研究结果显示,观察组血糖值>7.8 mmol/L频次、胰岛素总用量均低于对照组,差异有统计学意义(P<0.05);治疗后1周,观察组IL-6、CRP、TNF-α、D-乳酸、DAO、ET 水平均低于对照组,差异有统计学意义(P<0.05),与上述研究结果一致。
综上所述,重症颅脑损伤患者给予早期低剂量肠内营养支持治疗不仅有助于控制血糖水平,减少胰岛素的使用量,还有助于恢复并增强肠黏膜屏障功能及缓解炎症反应,值得临床推广应用。

