狐源沙门氏菌的致病性及耐药性试验
刘勃兴,赵安奇,张雪佳,王利丽,吴同垒,冯 岭,史秋梅*,张志强*
(1.河北科技师范学院河北省预防兽医学重点实验室,河北秦皇岛 066004;2.乐亭县农业农村局,河北唐山 063000)
我国毛皮动物饲养最早可追溯至1956年,并经过数十年的发展已成为世界毛皮动物第一饲养大国[1]。但随着养殖规模和数量的扩大,毛皮动物相关疾病的报道也逐渐增多,尤其是细菌性疾病,严重制约我国毛皮动物养殖业的健康发展[2]。狐沙门氏菌病又称狐副伤寒,是由致病性沙门氏菌感染引起的一种急性或慢性传染病,临床症状可见发热、下痢、败血症、母畜流产等,并常侵害幼畜致死[3-5]。沙门氏菌的毒力强弱与毒力基因密切关,有研究表明沙门氏菌的致病力是由众多毒力基因共同作用的结果,而这些毒力基因存在于菌毛、毒力岛和毒力质粒等[6-8]。国内外沙门氏菌病主要通过抗生素类药物治疗,但由于耐药菌株的出现,部分抗生素类药物的治疗效果欠佳,因此,亟需对致病性沙门氏菌的耐药性进行研究调查,筛选对当地流行菌株具有最佳抗菌效果的药物指导临床用药。
本试验从秦皇岛地区分离的23株狐源沙门氏菌的致病性和耐药性进行研究,旨在为秦皇岛地区狐源沙门氏菌的致病机制研究奠定基础,为临床用药提供参考。
1 材料与方法
1.1 材料
1.1.1试验用菌株 23株狐源沙门氏菌(编号HLS1~23),从秦皇岛地区病死银狐和蓝狐肝脏、心脏、脾脏等实质脏器分离,经细菌培养、革兰氏染色、生化试验和16S rDNA序列分析等试验鉴为沙门氏菌。
1.1.2 实验动物 昆明小鼠,体重20 g±2 g,购自北京维通利华实验动物有限公司。
1.1.3 主要试剂 HE琼脂培养基,青岛海博生物公司产品;药敏纸片,杭州天和微生物科技股份有限公司产品;DNA Marker DL 2 000,中科瑞泰科技有限公司产品;2×TaqMaster Mix、细菌DNA基因组提取试剂盒,康为世纪生物科技有限公司产品。
1.1.4 主要仪器 PCR仪(C1000 TOUCH),美国伯乐公司产品;超净工作台(YT-CJ-1D),北京亚泰科隆仪器技术有限公司产品;隔水式培养箱(GSP-9080MBE),上海博讯医疗生物仪器股份有限公司产品;倒置荧光显微镜(IX73),奥林巴斯公司产品;琼脂糖水平电泳仪(DYCP-31DN),北京六一生物科技有限公司产品;50 L全自动高压蒸汽灭菌锅(GI54DWS),致微(厦门)仪器有限公司产品;自动化微生物鉴定系统(ATB),法国梅里埃公司产品。
1.1.5 引物合成 参照文献[8-9]合成沙门氏菌毒力基因引物,由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 菌液的制备 将冻存的23株沙门氏菌分别接种于HE琼脂培养基,置37℃恒温培养箱培养12 h。挑取有黑色中心且菌落为蓝绿色的单菌落接种于LB培养基,在37℃、180 r/min的恒温摇床培养过夜,次日以1∶100比例转接至LB培养基培养至对数期后备用。
1.2.2 沙门氏菌的致病性试验 参照文献[10]方法,以昆明系小鼠为动物模型进行致病性试验。将1.2.1中制备的菌液以3 000 r/min离心5 min,弃掉上清,用无菌PBS重悬菌泥并调整浓度至1.0×107CFU/mL。试验设置23组试验组,每株狐源沙门氏菌为1个试验组,每组5只小鼠,每只小鼠腹腔注射0.1 mL调整浓度后的菌液。设置对照组1组,每只小鼠注射0.1 mL无菌的PBS缓冲液,其余试验条件与试验组相同。注射后观察并记录小鼠发病及死亡情况,剖检死亡的小鼠并分离其肝脏、脾脏、心脏等实质器官细菌。
1.2.3 沙门氏菌的毒力基因检测 以1.2.2中提取的23株沙门氏菌DNA为模板进行PCR检测。反应体系:模板、上游引物、下游引物各1 μL,2 ×TaqMaster Mix 10μL,ddH2O 7μL。PCR结束后用10 g/L琼脂糖凝胶跑胶验证,用紫外凝胶成像系统观察。
1.2.4 沙门氏菌的药物敏感性试验 药物敏感性试验采取KB法,试验操作以及判定标准按照美国临床和试验室标准协会标准。试验的抗菌药物有:β内酰胺类药物氨苄西林、头孢曲松和阿莫西林;氨基糖苷类药物阿米卡星、新霉素和卡那霉素;四环素类药物多西环素和土霉素;氟喹诺酮类药物环丙沙星和恩诺沙星;氯霉素类药物氟苯尼考;大环内酯类药物替米考星;磺胺类药物磺胺间甲氧嘧啶、磺胺二甲氧嘧啶、复方新诺明。该7类15种抗菌药物是兽医临床使用频率较高的药物。
PCR模板的制备,参照细菌DNA基因组提取试剂盒说明书分别提取23株狐源沙门氏菌的DNA,置-20℃冰箱备用(表1)。

表1 沙门氏菌毒力基因引物
2 结果
2.1 沙门氏菌的致病性试验
分离的狐源沙门氏菌感染小鼠后,小鼠出现精神沉郁、肌肉痉挛的神经症状,个别小鼠出现腹泻、粪便稀软不成型、呼吸急促、深而沉等症状。24 h后出现死亡,持续观察2周,死亡率为20%~100%(表2)。对照组小鼠状态良好,无明显病征,无死亡。分离试验组死亡小鼠的肝脏、心脏、脾脏等实质脏器细菌,经鉴定为沙门氏菌,生化鉴定指标与分感染菌株基本一致。

表2 23株分离菌的毒力基因检测结果与小鼠死亡情况
2.2 沙门氏菌的毒力基因检测
结果见图1。沙门氏菌的毒力基因检测结果显示,除菌株HLS6和HSL10,其余狐源沙门氏菌分别检出出2个~8个毒力基因。毒力基因sseC和sseL未检出,其余基因检出率为4.35%~65.22%,其中spvA、hisJ和stn基因检出率较高。

图1 23株分离菌各毒力基因检测
2.3 沙门氏菌的药物敏感性试验
结果见图2和图3。药物敏感性试验结果显示,分离的狐源沙门氏菌分别对6种~15种抗菌药物表现耐药,对6种抗菌药物表现耐药菌株1株,占比4.35%;对7种抗菌药物表现耐药菌株1株,占比4.35%;对8种抗菌药物表现耐药菌株1株,占比4.35%;对10种抗菌药物表现耐药菌株2株,占比8.70%;对11种抗菌药物表现耐药菌株3株,占比13.04%;对12种抗菌药物表现耐药菌株2株,占比8.70%;对13种抗菌药物表现耐药菌株4株,占比17.39%;对14种抗菌药物表现耐药菌株6株,占比26.09%;对15种抗菌药物表现耐药菌株3株,占比13.04%。15种抗菌药物中,分离的沙门氏菌对土霉素、替米考星和复方新诺明耐药率高达100%,对阿米卡星敏感率最高,为30.43%(7/23)。

图2 23株分离菌的耐药情况
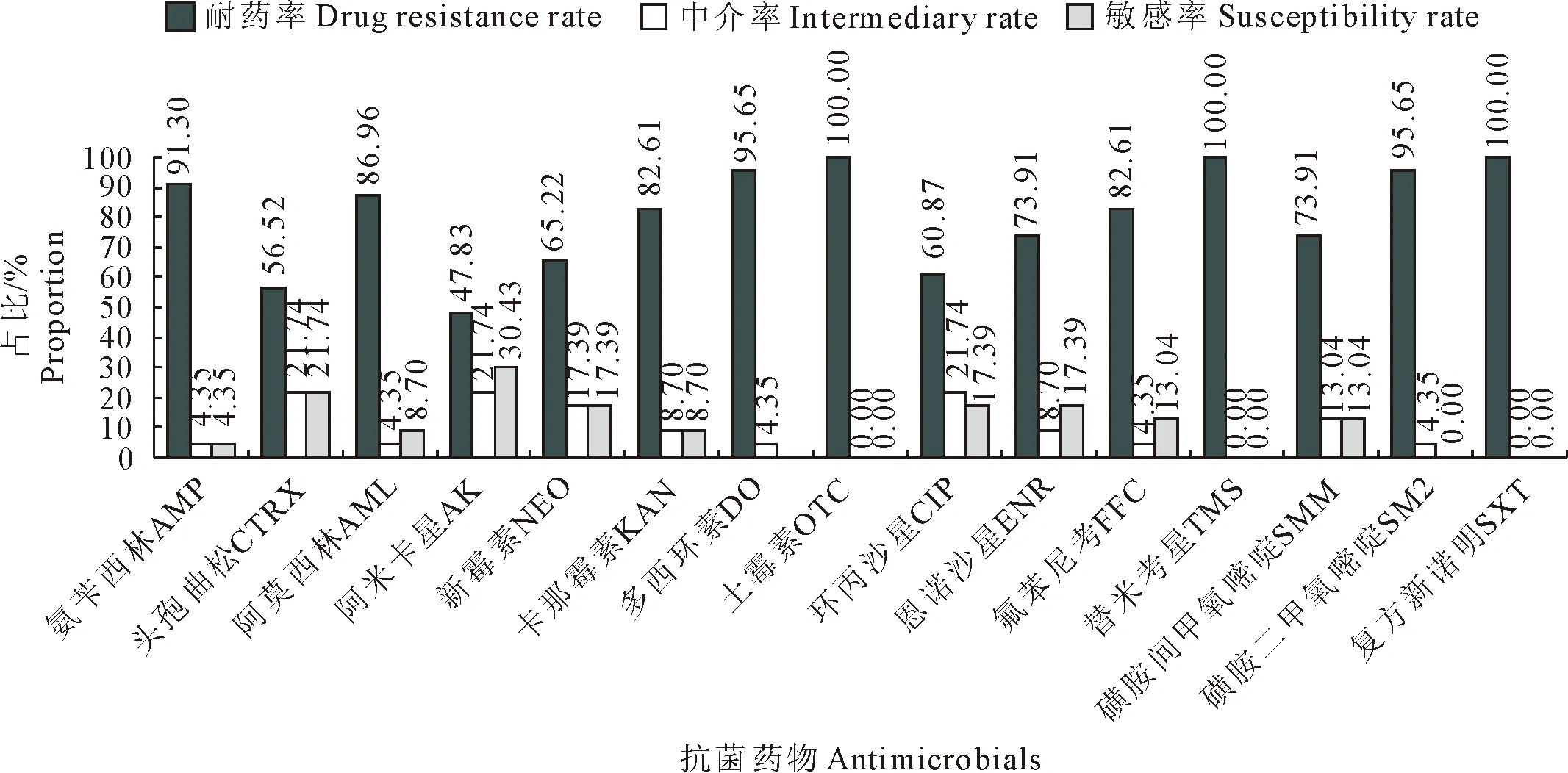
图3 23株分离菌的药物敏感性试验结果
3 讨论
沙门氏菌(Salmonella)是一种重要的人畜共患病源,可感染多种家禽家畜发病,同时也是重要的人食源性菌[11-12]。由于我国毛皮动物养殖业发展相对较晚,因此,狐源沙门氏菌相关的报道及研究较少,沙门氏菌的致病力在临床诊治狐相关疾病过程中经常不引起重视。本研究通过小鼠致病性发现,秦皇岛地区狐源沙门氏菌均具有一定的致病力,可致小鼠死亡,且不同菌株的致病力不同,揭示了沙门氏菌是引起狐发病的重要病原。
为了解试验的23株狐源沙门氏菌的毒力基因携带情况,本文采用PCR方法检测了19种沙门氏菌的毒力基因。结果显示,SPI2毒力岛的分泌系统效应蛋白基因sseC和sseL基因未检出,其余基因均有检出,毒力质粒的效应基因spvA、组氨酸转运操纵子hisJ和肠毒素stn基因检出率较高。在某些沙门氏菌存在一条约50 kb~90 kb的质粒,该质粒与沙门氏菌的毒力密切线管,被称为沙门氏菌毒力质粒(Salmonellaplasmid virulence,SPV)[9,13]。毒力质粒存在一段高度保守的spv基因(大小约为8 kb),由spvA、spvB、spvC、spvD和orfE基因构成,spv基因与细沙门氏菌的黏附、定植及血清抗生等毒力表现型密切相关[14-15]。hisJ基因常用于沙门氏菌的检测[16]。stn肠毒素基因是鼠伤寒沙门氏菌感染机制中重要的毒力因子,有报道非鼠伤寒沙门氏菌也存在stn基因,该基因可诱发小鼠腔体分泌反应,并且与细菌的耐药性存在一定的关系[14,17]。spvA、hisJ和stn基因检出率较高说明在秦皇岛地区狐源沙门氏菌该3个毒力基因在分子水平较为流行,为进一步对狐源沙门氏菌致病机制研究提供数据参考。
有研究报道,人和动物源沙门氏菌的耐药性呈上升趋势,并且人源沙门氏菌和动物源沙门氏菌存在一定的相关性[18-20]。本研究中23株沙门氏菌均具有多重耐药性,其中对14种抗菌药物耐药菌株占比最大,15种抗菌药物中阿米卡星敏感率最高,但敏感率仅为30.43%(7/23),耐药情况十分严重。孙娜等[21]分离的狐源沙门氏菌同样出现多重耐药现象,结合本研究结果,表明狐源沙门氏菌的耐药情况不容乐观。致病性沙门氏菌的多重耐药性给临床治疗带来巨大挑战,并对人类和其他动物的公共卫生安全造成威胁。针对狐源沙门氏菌耐药现状,建议在临床治疗时可先通过药敏试验筛选出抗菌效果最佳的药物,制定合理的给药方案,采用联合用药等方法缓解致病菌耐药问题,同时定期对地方流行致病菌株耐药情况进行调查分析以指导临床用药。
本文对从秦皇岛地区分离的23株狐源沙门氏菌进行研究,发现分离菌株均具有一定的致病力,并且具有严重的耐药性。研究结果为该地区狐沙门氏菌病的防治以及沙门氏菌的致病和耐药机制的研究奠定了基础。

