一株猪流行性腹泻病毒的分离鉴定及其致病性研究
黄文强,张志刚,郑 玲,辛雪梅,彭大新
(1.扬州大学兽医学院,江苏扬州 225000;2.上海东方希望集团上海畜牧有限公司,上海 200000)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种高致死性、接触性传染病[1-3],其发病特征以呕吐、腹泻、脱水、电解质紊乱为主,各种年龄阶段和不同品种的猪群都有易感性,且对哺乳仔猪、架子猪或育肥猪的危害更大[4],尤其是哺乳仔猪受害最为严重,发病率高达100%,病死率为30%~80%[5]。
PEDV的形态是典型的冠状病毒形态[6],形态学呈现多形性,近似于球形,病毒的外部有囊膜,囊膜上有纤突,纤突之间的间距较大,并且排列比较规范,呈花瓣样放射状,纤突的长度约为20 nm左右,PEDV粒子的大小为95 nm~190 nm,平均直径为130 nm。核酸为线性单股正链RNA[7],其表面具有3种结构蛋白,即纤突蛋白(S)、膜蛋白(M)和包膜蛋白(E)[8]。其中M蛋白位于PEDV的囊膜表面,是囊膜上含量最多的蛋白,在不同的PEDV毒株之间具有相对保守性,常常使用其作为建立PEDV的RT-PCR方法和流行病学的研究工具的靶基因[9]。
该病从2010年开始严重暴发流行,原有疫苗保护效果较差,提示可能存在变异株[10-13]。近年来PED流行范围不断扩大,呈现地方流行性,是严重威胁我国和全球生猪养殖的重要疫病。为了进一步研究该病原的致病性特征,加强对PED的防控,本研究从江苏省某猪场发生疫情的5日龄仔猪粪便和肠道中分离1株PEDV,以期为PEDV的致病机理研究和疫苗研制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料与细胞 无菌采集江苏某猪场5日龄腹泻仔猪的小肠及内容物,置-80℃冰箱保存备用。Vero细胞为中国兽医药品监察所保存。
1.1.2 主要试剂 RNA提取试剂盒、DNA提取试剂盒、胶回收试剂盒、PremixTaqTMTaKaRaTaqTMVersion 2.0)、PrimeScriptTaqTMⅡ1st Strand cDNA Synthesis Kit、DL 2 000 DNA Marker,宝生物工程(大连)有限公司产品;MEM培养基、胎牛血清、双抗(青霉素、链霉素),Hyclone公司产品;胰酶,Gibco公司产品。
1.1.3 引物设计 根据GenBank中AF353511.1序列设计扩增PEDV M基因的引物,PEDV-F/R分别为5′-AACGGTTCTATTCCCGTTGATG-3′和5′-TAAATGAAGCACTTTCTCACTATA-3′,预期扩增长度为663 bp。猪瘟病毒(CSFV)[14]、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)[15]、猪传染性胃肠炎病毒(TEGV)、猪轮状病毒(PRV)[16]引物序列参考已发表论文中的引物序列;所有引物由苏州金唯智生物科技有限公司合成。
1.1.4 主要仪器 生物安全柜,MVE公司产品;酶联免疫检测仪,Bioteck公司产品;CO2培养箱,NVAIRE公司产品;倒置荧光显微镜,Olympus公司产品;-80℃超低温冰箱、PCR仪,美国Thermo Fisher公司产品;凝胶成像仪,美国Bio-Rad公司产品。
1.2 方法
1.2.1 病料处理 将病料加入5倍体积含双抗(青霉素100 IU/mL,链霉素100 μg/mL,pH7.2)的PBS溶液(pH7.2)研磨,反复冻融3次,8 000 r/min离心10 min,无菌吸取上清液,用0.22 μm滤器过滤后置-80℃冰箱保存备用。
1.2.2 RT-PCR检测 取1.2.1处理过的病料上清,根据TaKaRa公司RNA/DNA提取试剂盒说明书,进行病毒RNA/DNA的提取,将提取出来的RNA用反转录试剂盒反转录为cDNA。对提取出的cDNA和DNA进行猪瘟病毒、猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪细小病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒的PCR鉴定,检测体系和条件按常规检测方法操作。
1.2.3 病毒分离 复苏Vero细胞,将长成单层致密的Vero细胞弃去培养液,用MEM洗3遍后按10%的接毒量加入处理好且PEDV检测结果为阳性,其他病毒检测结果为阴性的病料上清,37℃吸附1 h后,加入终浓度为10 μg/mL胰酶的维持液[10],置于培养箱中培养72 h后盲传,同时设不加病料上清的终浓度为10 μg/mL胰酶维持液的Vero细胞作为健康对照。当观察到细胞病变后,采集培养液上清,连续传代2次。
1.2.4 病毒含量的测定 用MEM培养基将毒种做10倍系列稀释,取10-5、10-6、10-7、10-84个稀释度,分别接种已长成良好单层的Vero细胞96孔细胞培养板,每个稀释度接种6孔,100 μL/孔,置37℃作用1 h,弃液,加入MEM培养基,100 μL/孔,同时设正常细胞对照,置37℃、体积分数为5%的CO2培养箱中培养7 d,每日观察并记录细胞病变(CPE),按Reed-Muench法计算TCID50,距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)。
1.2.5 M基因序列分析 取1 μL的TaKaRa随机引物、1 μL dNTP Mixture (10 mmol/L each),加入8 μL总RNA中,置于65℃金属浴5 min后,冰上迅速冷却。于上述变性后反应液中加入5×buffer 4 μL,Prime Script Ⅱ RTase (200 U/μL)反转录酶1 μL,RNA酶抑制剂0.5 μL,RNase Freed dH2O 4.5 μL总体积20 μL。反应条件:42℃反转录1 h,95℃ 5 min后,冰上冷却。
取上述2 μL cDNA作为模板进行RT-PCR,反应按如下体系在PCR管中进行,2×PremixTaq25 μL,引物PEDV-F、PEDV- R各1 μL,灭菌水21 μL,总体积50 μL。反应条件为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,共30个循环;最后 72℃延伸10 min。
将电泳结果为阳性的PCR产物,按照TaKaRa公司的胶回收试剂盒说明书进行PCR产物纯化,纯化后由苏州金唯智生物科技有限公司测序。利用DNA Star软件进行分析,使用Mega 7软件对NJ方法对核苷酸序列进行遗传进行分析。
1.2.6 动物回归试验 将10头7日龄仔猪随机分为感染组(n=5)和对照组(n=5)。感染组每头仔猪口服2 mL含量为106.0TCID50/mL的病毒;对照组每头仔猪口服相同体积的PBS。接种后每日观察仔猪临床表现并记录,对出现严重腹泻或垂死的仔猪给予安乐死。
1.2.7 半数致死量试验 将18头7日龄仔猪随机分为4组,第1、2、3组为试验组,每组5头猪;试验组分别口服接种2 mL,病毒含量依次为104.5、105.5、106.5TCID50/mL的F6代分离株。第4组为对照组,3头猪,每头仔猪口服相同体积的细胞培养液。接种后每日观察仔猪临床表现并记录,连续观察10 d。试验结束时,统计各组仔猪的死亡率,按照Reed-Muench法计算其半数致死量(LD50)。
2 结果
2.1 腹泻病原RT-PCR检测
将提取的DNA及RNA进行7种病毒(PCV2、CSFV、PRRSV、PPV、TEGV、PEDV、RV)的PCR检测,其中1份DNA/RNA样品成功扩增出长度约为663 bp的目的片段(图1)。将PCR产物进行纯化后,送至苏州金唯智生物科技有限公司测序,测序结果表明,与GenBank上PEDV M基因同源性高达99%以上。
2.2 病毒分离
PEDV阳性病料接种Vero细胞后,盲传到F4代,出现明显病变,主要表现为细胞表面粗糙,颗粒增多,有多核细胞,并可见空斑样小区,细胞脱落等病变特征(图2A)。而对照细胞保持致密的单层,呈长梭形,轮廓清晰,细胞脱落极少(图2B)。将分离株命名为PEDV JS14株。将PEDV JS14株连续传代至F6代,细胞病变比较稳定,对分离得到的F4代~F6代PEDV JS14株的病毒含量进行测定,并使用Reed-Muench方法进行计算,结果表明,F4代病毒含量为105.5TCID50/mL,F5代病毒含量为106.0TCID50/mL,F6代病毒含量为106.5TCID50/mL。

M.DNA 标准DL 2 000;1、3、5、7、9、11、13.分别PPV、CSFV、PRRSV、RV、TEGV、PCV2和PEDV的阳性对照;2、4、6、8、10、12、14.分别是以病料为DNA/cDNA进行PPV、CSFV、PRRSV、RV、TEGV、PCV2和PEDV的核酸扩增结果
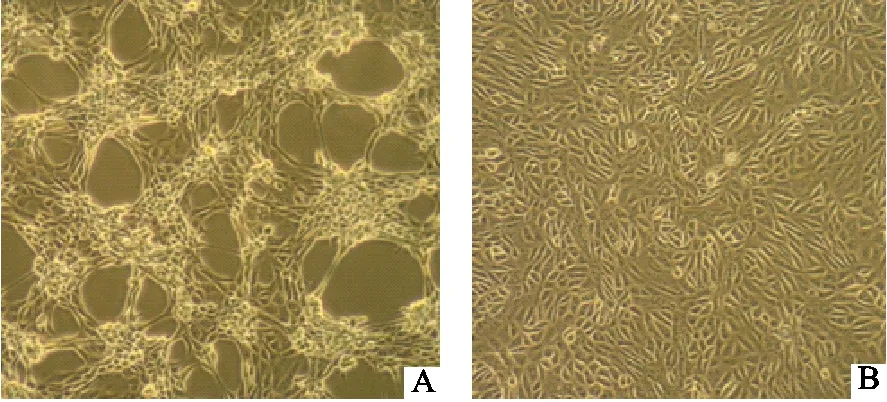
A.接毒后的细胞;B.正常Vero细胞A.Vero cells after inoculation;B.Normal Vero cells
2.3 分离毒株M基因序列分析
对F0代~F8代细胞培养物提取核酸进行RT-PCR扩增,产物大小与预期一致(图3)。回收PCR产物,送往苏州金唯智生物科技有限公司测序。将获得的JS14株M基因序列与国内外具有代表性的19株PEDV毒株进行同源性比对分析,发现其与KF272920.1同源性最高,达到99.9%(图4)。M基因遗传进化分析表明,JS14株与美国分离毒株KF272920.1属于同一分支,具有较近的亲缘关系,而与经典毒株CV777存在一定进化距离(图5)。

图4 PEDV M基因序列同源性比对

图5 PEDV M基因遗传进化分析
2.4 动物回归试验
试验组5头7日龄仔猪口服接种JS14株F6代10 h后,均出现厌食、呕吐、腹泻等症状;30 h后症状加重,4头仔猪死亡;42 h后剩余1头仔猪出现水样粪便、内有凝乳样白色和淡黄色块状物,被毛粗糙,仔猪消瘦明显等症状。试验期间,对照组仔猪未出现上述临床症状。剖检病死猪发现,小肠扩张,部分肠壁变薄呈透明状有出血点,肠系膜充血显示(图6A~图6D)。试验结果表明,JS14分离株接种仔猪后,可引起PED典型的临床症状,结合RT-PCR、细胞病变观察结果,最终确定该分离毒株为PEDV强毒株。
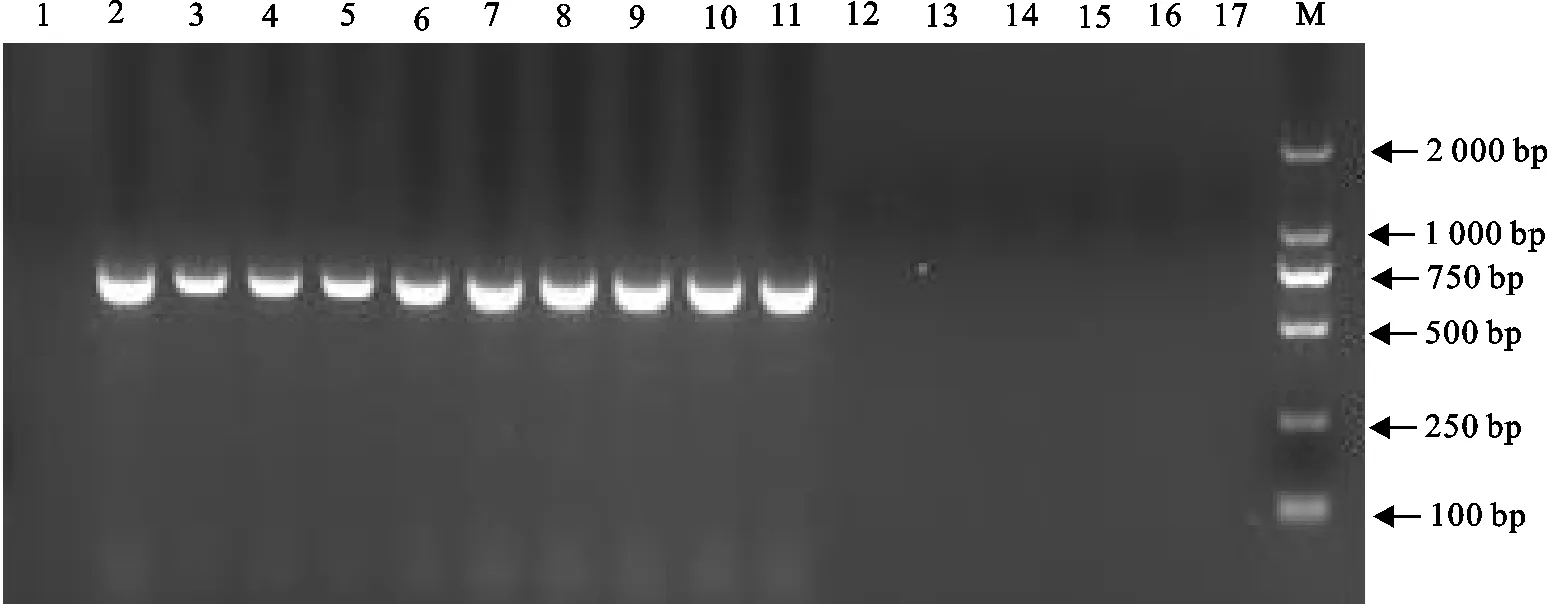
M.DNA 标准DL 2 000;1.阴性对照;2.阳性对照;3~11.分别为F0~F8的细胞培养物的核酸;12~17.分别为F8代细胞培养物的PPV、CSFV、PRRSV、RV、TEGV、PCV2鉴定
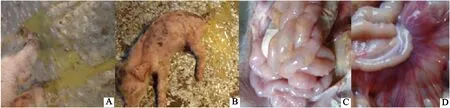
A.淡黄色呕吐物;B.淡黄色水样粪便;C.小肠部分肠壁变薄呈透明状有出血点;D.肠系膜充血
2.5 半数致死量
将PEDV JS41株F6代病毒液口服接种7日龄人工哺乳仔猪,观察期内,不同病毒滴度(106.5、105.5、104.5TCID50/mL)的试验组均出现典型临床症状,主要表现为呕吐、腹泻、水样粪便等症状。接种滴度为106.5TCID50/mL的5头仔猪全部死亡,发病率为100%,病死率为100%。接种滴度为105.5TCID50/mL的5头仔猪中,有4头死亡,发病率为100%,病死率为80%。接种滴度为104.5TCID50/mL的5头仔猪中,有1头死亡,发病率为60%,病死率为20%(表1)。Reed-Muench法计算结果表明,其半数致死量为105.0TCID50/mL。

表1 JS14株感染7日龄仔猪发病率及死亡率
3 讨论
本试验通过对发病猪场10日龄内腹泻仔猪的粪便和病死猪小肠内容物进行PEDV病原的RT-PCR检测,同时对该阳性病料进行了外源病毒检测(PCV2、PRRSV、CSFV、TEGV、RV、PPV)筛选出一份PEDV结果呈阳性,其他病毒检测结果为阴性的样品。将该阳性病料接种Vero细胞,进行PEDV的初步分离工作。PEDV分离方面,我国报道较早的是李树根等[17]采用添加胰酶的细胞维持液成功地将分离的PEDV适应于Vero,并筛选出了最佳的胰酶用量。本试验通过在维持液中加入10 μg/mL胰酶,成功的分离到了可在Vero细胞系上产生稳定细胞病变的PEDV JS14株,该毒株在盲传第4代时出现病变,提示病毒已经适应了Vero细胞,将PEDV JS14株连续传代至F6代,细胞病变比较稳定,其病毒含量达到106.5TCID50/mL。与之前分离的毒株相比,其病毒滴度高于早年间发现的毒株,例如:PEDV-HZ(病毒滴度为105.7TCID50/mL)、PEDV SD201604株(病毒滴度为103.5TCID50/mL)[18-19]。
本试验对PEDV JS14株致病性进行了初步研究,在攻毒10 h后,5头仔猪均出现厌食、呕吐、腹泻等症状;攻毒30 h后,3头仔猪死亡;攻毒42 h后,剩余2头仔猪出现水样粪便、内有凝乳样白色和淡黄色块状物,被毛粗糙,仔猪消瘦明显等症状,而对照组仔猪未出现上述临床症状。与PEDV TX株相比[20],试验动物出现典型症状时间早,病程长,发病症状严重,说明本研究分离的毒株,病毒含量高,致病性强。M基因的遗传进化树显示与美国分离株KF272920.1同源性最高,可能与种猪引进的来源有关,需对其他基因进行序列分析来进一步验证。
综上所述,本研究成功分离到1株猪流行性腹泻病毒,将其命名为PEDV JS14株,并将JS14毒株在Vero细胞上连续传代培养。通过细胞病变、RT-PCR检测进行鉴定,动物回归试验证实为PEDV强毒株,为PEDV的生物学特性的进一步研究提供了参考。

