新城疫病毒LaSota株检测用国家核酸标准物质的研制
梅 力,高晓龙,王英超,高 敏,赵启祖,李 翠,宋彦军*,冯小宇*
(1.北京市动物疫病预防控制中心,北京大兴 102629;2.中国兽医药品监察所,北京海淀 100081)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)感染引起的一种急性、热性、败血性、高度接触性传染病。世界动物卫生组织(OIE)将ND列为必须报告的动物疫病,我国也将其列为一类动物疫病。疫苗所用毒株为LaSota株[1],对不同基因型的ND强毒流行株均产生完全的临床保护[2]。
发达国家对重要动物疫病控制进行了长期研究,逐渐统一了重大动物疫病预防疫苗、诊断制剂和试验技术的评价方法,建立了相关的标准物质。我国动物病原微生物检测标准物质的研究并不深入,特别是在核酸标准物质的研制方面才起步较晚[3]。目前,由于我国各级兽医检测实验室软硬件条件相差较大,诊断试剂种类繁多,标准物质的缺失导致我国在动物疫病检测方面缺乏一致性和可比性[4],制约了我国对动物疫病的有效防控。因此,研制出兽用检测相关标准物质,不仅可以提高全国不同类型兽医检测实验室的检测能力和技术水平,更为动物疫病净化和畜产品质量安全提供了有力保障。
1 材料与方法
1.1 材料
1.1.1 毒株和实验动物 新城疫病毒LaSota株,由本实验室保存;9日龄~11日龄SPF鸡胚,购自北京梅里亚维通实验动物技术有限公司。
1.1.2 主要试剂 病毒基因组DNA/RNA提取试剂盒,西安天隆科技有限公司产品;50 g/L蔗糖牛奶冻干保护剂,北京中海生物科技有限公司产品;One-step qPCR supermix ,Takara公司产品;One-Step RT-ddPCR Kit for Probes,伯乐公司产品;新城疫病毒通用型实时荧光RT-PCR检测试剂盒,世纪元亨公司产品;禽传染性喉气管炎荧光PCR检测试剂盒,北京亿森宝生物科技有限公司产品;鸡减蛋综合征病毒(EDSV)核酸检测试剂盒、鸡传染性法氏囊炎病毒(IBDV)核酸检测试剂盒,广州维伯鑫生物科技股份有限公司产品;引物和探针由英潍捷基公司合成。
1.1.3 主要仪器 自动孵化器(LYON RX2),Lion electric company产品;天隆全自动核酸提取仪(NP968-C),西安天隆科技有限公司产品;冻干机(EYELA FDU-1200),东京理化器械株式会社产品;微滴式数字PCR检测系统(QX100Droplet Generator、QX100Droplet Reader、QX100微滴式数字PCR仪)、CFX96 Touch荧光定量PCR仪,Bio-Rad公司产品。
1.2 方法
1.2.1 病毒培养及浓度测定 将本实验室保存的NDV LaSota毒株用PBS稀释1 000倍后接种9日龄SPF鸡胚,37℃孵育,观察鸡胚死亡情况,弃去24 h内死亡鸡胚,72 h后无菌采集鸡胚尿囊液,该尿囊液即为NDV LaSota株的病毒液。将收获的病毒培养液以4 500 r/min离心5 min,用0.22 μm滤膜进行过滤。将收集的病毒液65℃水浴2 h灭活,并进行灭活检验。
1.2.2 病毒的冻干 将病毒液与冻干保护剂1∶1等体积充分混匀,每瓶1 mL分装于冻干瓶内,放入超低温冰箱内预冻24 h,保证预冻为固体状态,按照EYELA FDU-1200冻干机操作说明进行冻干,冻干结束后取出冻干瓶,压好胶塞并加铝盖加固密封,最后置于-20℃±2℃环境中保存。
1.2.3 特性检验
1.2.3.1 物理性状检验 NDV LaSota株核酸标准物质应呈白色均一粉末。
1.2.3.2 病毒灭活检验 将NDV LaSota株核酸标准物质解冻后,接种于9日龄SPF鸡胚,连续观察3 d后收获培养物,盲传至少3代,观察鸡胚死亡情况,判定标物物质是否已经灭活。
1.2.3.3 支原体检验 将NDV LaSota株核酸标准物质解冻后,利用支原体培养方式检测是否存在支原体污染。
1.2.3.4 其他病毒检验 制备NDV LaSota株核酸标准物质过程中,对H9N2亚型禽流感病毒、禽传染性支气管炎病毒、禽传染性喉气管炎病毒、鸡减蛋综合征病毒、禽腺病毒4型和鸡传染性法氏囊病病毒共6种其他病毒进行检验,对以上病毒进行检验时依据了国标检测方法,对没有标准参考的病毒则使用商品化试剂盒或参考公开发表文献方法进行检验[5]。
1.2.3.5 冻干标准物质的水分检验 取NDV LaSota株核酸标准物质5瓶,依据《中华人民共和国兽药典》2015年版三部附录《剩余水分测定》,按照其规程操作,进行水分测定[6]。
1.2.4 均匀性评估 随机抽取核酸标准物质15瓶,每瓶检测3次,采用数字PCR方法对NDV LaSota株核酸标准物质的核酸含量进行检测,通过SPSS 23.0对数据进行分析,采用单因素方差分析(F检验)进行均匀性检验。
1.2.5 稳定性评估 本研究采用数字PCR方法考察了NDV LaSota株核酸检测标准物质的短期稳定性和长期稳定性。
1.2.5.1 短期稳定性 标准物质的短期稳定性与样品运输过程中的外部因素有关。按如下方式进行短期稳定性的抽样评估,将标准物质分别置于4℃、25℃、60℃条件下,按指定周期进行检验,提取核酸后使用数字PCR方法进行检测,每次抽取样品3瓶,每瓶重复检测3次,通过SPSS 23.0对数据进行分析,使用配对t检验对标准物质的短期稳定性进行评估。
1.2.5.2 长期稳定性 标准物质的长期稳定性与贮存条件有关。按如下方式进行长期稳定性的抽样评估,对-20℃±2℃条件下保存的标准物质,于第1、2、4、6、8、11个月,随机抽取3瓶,提取核酸后使用数字PCR方法进行检测,每瓶样品重复检测3次,计算均值,对长期稳定性进行评估。
1.2.6 开瓶稳定性 本研究通过开瓶稳定性试验来考察本标准物质开瓶后的稳定性。抽取标准物质3瓶,分为第1次~第5次开瓶检测,每瓶每次做3个复孔,以第1次开瓶的检测数据为对照组,用数字PCR方法进行检测,通过SPSS 23.0对数据进行分析,使用配对t检验方法分析本标准物质开瓶后的稳定性。
1.2.7 标准物质的定值 NDV LaSota株核酸标准物质定值按照JJF1343-2012标准要求,通过多个实验室协作定值,本次参加定值的实验室数目为8个。8家实验室均具有一定的技术权威性,在使用数字PCR方法测定标准物质特性方面具有必备条件以及同等的技术能力和经验。
定值方案如下:8家实验室对核酸标准物质各进行8次检验得到8组定值数据,对组内数据进行可疑值检验、对组间数据进行等精度检验。在组内数据无可疑值、组间数据等精度的条件下,利用t检验方法评价各组数据平均值的显著性,将数据合并后利用正态分布分析数据的正态性,在符合正态分布的情况下,可用多个平均值的算数平均值表示该标准物质的标准值。
1.2.8 不确定度的评定 标准物质定值结果的不确定度由均匀性引入的不确定度、稳定性引入的不确定度以及标准物质定值过程引入的不确定度组成。
1.2.8.1 均匀性引入的不确定度的评定 均匀性引入的相对标准不确定度由标准物质均匀性产生的标准偏差sb和标准物质的标准值计算。
1.2.8.2 稳定性引入的不确定度的评定 稳定性引入的相对标准不确定度由标准物质存储在-20℃条件下11个月的长期稳定性的不确定度来计算。
1.2.8.3 定值过程引入的不确定度的评定 定值过程引入的不确定度的评定包括不确定度的A类评定和不确定度的B类评定。不确定度的A类评定:通过测量数据的标准偏差、测量次数及所要求的置信水平按统计学计算方法进行。不确定度的B类评定:本标准物质的不确定度B类评定包含4部分,第1部分是天平称量引入的不确定度;第2部分是稀释引入的不确定度,主要为移液器引入的不确定度;第3部分是检测仪器引入的不确定度,主要为数字PCR仪引入的不确定度;第4部分是核酸回收率引入的不确定度。由这4部分不确定度合成最终的B类不不确定度。
将均匀性评估、稳定性评估引入的不确定度和定值引入的不确定度按照平方和开方的方法叠加得到合成标准不确定度,记为UCRM。该合成标准不确定度乘以因子(该因子称为包含因子,记为k)得出的不确定度称为扩展不确定度或总不确定度,记为U。
1.2.9 定值结果的表示 NDV LaSota株核酸标准物质的定值结果由本标准物质的标准值除以核酸回收率后,±扩展不确定度来表示。
1.2.10 临床试用评价 随机抽取NDV LaSota株核酸标准物质15瓶,送至3家试用单位(北京中科基因技术有限公司、北京市昌平区动物疫病预防控制中心、北京市大兴区动物疾病控制中心)进行检测,每家试用单位检测5瓶。试用单位在检测日常临床样本时,将试用的NDV LaSota株核酸标准物质和临床样本同时提取核酸,严格按照检测试剂的说明书将标准物质和临床样本一同进行荧光定量PCR检测,每次检测1瓶标准物质,每瓶重复检测2次,记录试验结果并分析数据。
2 结果
2.1 标准物质的制备
将NDV LaSota毒株稀释后接种9日龄SPF鸡胚获得的鸡胚尿囊液即为病毒培养液,将其与冻干保护剂等体积混匀、分装后放入冻干机进行冻干,即为制备的NDV LaSota株核酸标准物质。该标准物质性状为白色均一粉末;病毒灭活检验显示该标准物质不能引起鸡胚病变,说明已灭活彻底;支原体培养检验显示无支原体生长;其他病毒检验显示H9N2亚型禽流感病毒、禽传染性支气管炎病毒、禽传染性喉气管炎病毒、鸡减蛋综合征病毒、禽腺病毒4型和鸡传染性法氏囊病病毒6种病毒检验均为阴性,如表1;水分检验显示该冻干标准物质水分含量小于3.0%,水分含量合格,如表2。

表1 其他病毒检验

表2 NDV LaSota株核酸标准物质冻干品水分测定结果
2.2 均匀性评估结果
随机抽取核酸标准物质15瓶,每瓶检测3次,采用数字PCR方法对标准物质的核酸含量进行检测,通过SPASS23.0软件对数据进行分析,采用单因素方差分析(F检验)对数据进行均匀性检验,根据自由度(v1,v2)及给定的显著性水平α,可由表查临界值的F值,经计算F

表3 均匀性分析结果
2.3 稳定性评估结果
2.3.1 短期稳定性评估结果 将NDV LaSota株核酸标准物质在4、25、60℃条件下的检测结果与存放在-80℃条件下的检测结果分别进行t检验分析,如表4所示。4℃存放4周的检测值与对照组标准物质的检测值不存在显著性差异,可认为本标准物质在4℃环境下可稳定4周;25℃存放7 d时P>0.05,即在25℃环境下存放1周的检测值与对照组标准物质的检测值不存在显著性差异,存放14 d时出现显著性差异,可认为本标准物质在25℃环境下可稳定1周;60℃存放7 d的t检验结果与对照组标准物质的检测值存在显著性差异,可认为本标准物质不能置于60℃环境下。

表4 短期稳定性t检验结果
2.3.2 长期稳定性评估结果 对-20℃±2℃条件下保存的标准物质,于第1、2、4、6、8、11个月,随机抽取3瓶进行数字PCR检测,每瓶样品重复检测3次,试验数据如表5所示,计算均值,进行稳定性分析。

表5 -20℃条件下NDV核酸标准物质拷贝数
根据数据所得:
T(0.95,5)查表得:2.57。
T(0.95,3)*s(β1)=1.48E+03
对NDV LaSota株核酸标准物质在-20℃贮存条件下稳定性结果进行分析,结果β1小于T(0.95,3)*s(β1),故认为斜率无显著差异(P>0.05),未观测到不稳定性,能满足实际测量的需要。可认为本标准物质在-20℃环境下可稳定11个月。
2.3.3 开瓶稳定性评估 抽取NDV核酸标准物质3管共开瓶5次进行开瓶稳定性评估,以第1次开瓶的检测数据为对照组,用数字PCR方法进行检测。根据配对t检验的结果显示(表6),第2次、第3次、第4次、第5次的检测结果均与第1次的检测结果无显著性差异(P>0.05),说明本标准物质开瓶5次是稳定的。
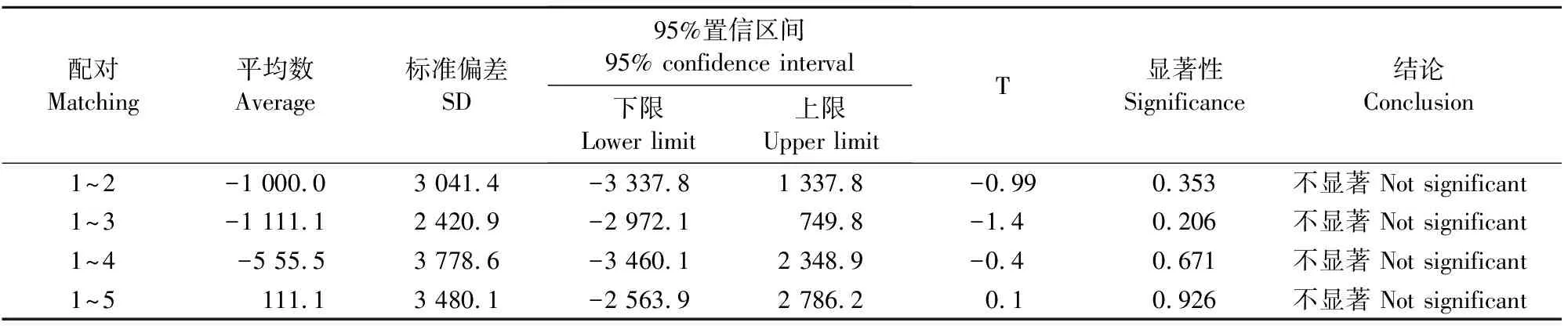
表6 开瓶稳定性T检验结果
2.4 标准物质的定值结果
由8家具备同等实验能力和条件的实验室协助完成本标准物质的定值工作。经过数据检验和分析,各组测量数据是等精度数据,并且组间平均值无显著性差异,故测量结果可以用算术平均值表示,除以核酸回收率92%,最终确定NDV LaSota株核酸标准物质的标准值为1.7E+05 copies/mg。
2.5 不确定度的评定
2.5.1 均匀性引入的不确定度 均匀性引入的相对标准不确定度由标准物质均匀性产生的标准偏差sbb和标准物质的标准值计算。此标准物质均匀性引入的不确定度为:ubb=sbb=4.3E+03 copies/mg,相对标准不确定度urel(bb)=0.026。
2.5.2 稳定性引入的不确定度 稳定性引入的相对标准不确定度由标准物质存储在-20℃条件下11个月的长期稳定性的不确定度来计算。此标准物质存储在-20℃条件下11个月的长期稳定性的不确定度为:us=6.34E+03 copies/mg,相对标准不确定度urel(s)=0.039。
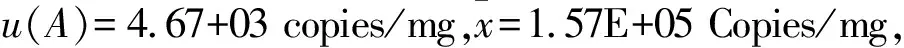

2.6 定值结果的表示
NDV LaSota株核酸标准物质的定值结果表示为1.7×105copies/mg±0.3×105copies/mg。
2.7 临床试用评价
试用单位在检测日常临床样本时,将试用的NDV LaSota株核酸标准物质和临床样本同时提取核酸,严格按照检测试剂的说明书将标准物质和临床样本一同进行荧光定量PCR检测,每次检测1瓶标准物质,每瓶重复检测2次,记录试验结果并分析试验数据。
委托3家单位对制备的NDV LaSota株核酸标准物质进行了试用性评价,试验结果表明本标准物质的均匀性、稳定性良好,量值的准确度高,与临床样本互通性好,具备可靠的临床应用价值。
3 讨论
目前,在国家标准物质资源共享平台可查询到的动物病毒核酸标准物质主要集中于猪繁殖与呼吸综合征病毒欧洲株、美洲变异株和美洲经典株,猪瘟病毒、牛病毒性腹泻病毒和猪塞内卡病毒的核酸标准物质,未涉及禽类病毒。
本研究通过提取灭活的新城疫病毒LaSota株全病毒核酸,利用稳定的冻干工艺进行冻干,并对其均匀性、稳定性开展了严格评估,成功制备出了新城疫病毒核酸标准物质,经专家评定和认可,获得了国家二级标准物质证书。与体外转录病毒的单个基因序列开展标准品研究相比,能够更大限度的接近并还原真实病毒的RT-PCR反应过程,作为检测用标准物质更具有代表性和可靠性。经过进一步的工艺完善和临床试用,将为实验室核酸检测的质量控制和疫病防控提供有力保障。
我国的标准物质管理办法规定标准物质的定值结果一般表示为标准值±总不确定度[1]。本研究中标准物质的不确定度由以下几部分组成,即均匀性引入的不确定度、稳定性引入的不确定度和标准物质的定值过程引入的不确定度,对这3类不确定度开展了明确的评定,保证了标准物质的定值结果符合国家计量技术规范的相关要求[7]。
标准物质的制备和定值过程中使用了数字PCR技术[8],数字PCR的技术原理是利用数字PCR系统核心的微滴化技术,微滴发生器将每个样品分成20 000个均匀的纳升级微滴,其中每个微滴或不含待检核酸靶分子,或者含有1个至数个待检核酸靶分子,每个微滴都作为一个独立的PCR反应器。扩增完毕后采用微滴分析仪逐个对每个微滴进行检测,有荧光信号的微滴判读为1,没有荧光信号的微滴判读为0,最终根据泊松分布原理以及阳性微滴的比例,分析软件可计算给出待检靶分子的浓度或拷贝数。与传统的荧光定量PCR相比,数字PCR具有更好的精确度和灵敏度,已被广泛地应用于疾病检测、转基因成分检测、食品安全等领域[9-11]。如今在标准物质的制备和定值过程中,数字PCR技术也在逐渐取代荧光定量方法,从而充分保证了制备的标准物质的准确性和技术权威性[12]。

