含缬酪肽蛋白促进IBV的胞内运输
袁 晓,王 欢,丁 铲,廖 瑛
(中国农业科学院上海兽医研究所,上海 200241)
VCP(Valosin-containing protein),即含缬酪肽蛋白,是三磷酸腺苷酶超家族中的一员,在不同物种中具有高度的同源性[1-2]。VCP参与蛋白降解、膜融合、DNA修复与复制、调控细胞周期,激活NF-κB信号通路等生理活动,并具有抗细胞凋亡、启动转录因子及参与细胞内吞等作用[3]。已有文献报道,VCP与内吞小体复合物相结合,在膜融合和囊泡转运过程中发挥着重要作用[4]。干扰VCP的表达导致内吞小体体积增大,不能成熟[5]。
禽传染性支气管炎(avian infectious bronchitis,IB)是鸡群的急性、高度接触性的传染性疾病,由禽传染性支气管炎病毒(Infectious bronchitis virus,IBV)感染引起,属于禽类的四大病毒性疾病之一,给养禽业带来了巨大的经济损失[6-7]。研究发现,IBV发生感染和进入宿主细胞时,依赖网格蛋白内吞方式进入细胞,依次通过早期内体、晚期内体、溶酶体,在酸性环境中发生膜融合,释放病毒基因组进入细胞质[8]。因此,内体的成熟在IBV的感染中起到重要的作用。已有研究表明:干扰VCP的表达,导致入胞的IBV滞留在早期内体,不利于IBV的复制和增殖[4]。本研究通过干扰或外源表达VCP,检测IBV的基因组复制水平和蛋白表达水平,并检测VCP的亚细胞位置,进一步证实VCP在IBV感染和增殖中发挥的作用。
1 材料与方法
1.1 病毒、细胞和试剂IBV(Beaudette株)由华南农业大学刘定祥实验室赠予;Vero细胞和HeLa细胞由本实验室保存;siRNA购自吉玛生物公司;VCP抗体和β-actin抗体购自CST公司;IBV-N蛋白抗体由刘定祥实验室赠予;Rab5、Rab7、LAMP1抗体购自CST公司;FuGENE转染试剂购自Promega公司;Lipofectamine 2000购自赛默飞公司;GFP-VCP质粒由本实验室构建。
1.2 siRNA干扰和病毒感染将Vero细胞计数,并按照5×105/孔的细胞数接种至6孔板。siRNA的转染按照Lipofectamine 2000说明书进行操作。48 h后,接种IBV(MOI=1),感染后12 h收取样品,通过Western blot检测病毒蛋白的表达水平,荧光定量RT-PCR检测病毒RNA的复制水平。siVCP-F:5'-AAGUAGGGUAUGAUGACAUUG-3',siVCP-R:5'-CAAUGUCAU- CAUACCCUACUU-3'。
1.3 GFP-VCP的构建对VCP(GenBank登录号:AB232593.1)全基因进行克隆。PCR产物经测序正确后,将其连接至真核表达载体pEGFP-N1中,获得重组表达质粒pEGFP-N1-VCP。VCP-F:5'-CC CAAGCTTGCCACCATGATTCGGCTCTTCTCGGCT-3';VCP-R:5'-CGGGGTACCCGAGCGGTGGCAAGCG AC-3'。
1.4 质粒转染和病毒感染将Vero细胞计数,并按照5×105/孔的细胞数接种至6孔板。GFP-VCP质粒的转染按照FuGENE的说明书进行操作。转染后36 h接种病毒(MOI=1),感染后12 h收取样品,通过Western blot检测病毒蛋白的表达水平,荧光定量RT-PCR检测病毒RNA的复制水平。
1.5 SDS-PAGE和Western blot将蛋白样品12 000 ×g离心10 min,取10 μL上样,80 V恒压电泳30 min后,120 V恒压电泳100 min。将蛋白胶与海绵、滤纸、PVDF膜按照“胶正膜负”的方式排成转印用的“三明治结构”,250 mA恒流转印90 min。5%脱脂乳室温封闭PVDF膜2 h,依次孵育一抗和二抗各1 h,分别用TBST清洗3遍。将PVDF膜在ECL发光显色液中孵育20 s,在全自动化学发光图像分析系统(上海天能公司)上检测蛋白表达信号。
1.6 RNA抽提和荧光定量RT-PCR往6孔板的每孔中加入1 mL TRIzol试剂,室温静置5 min,待细胞完全裂解后,将裂解液转移至无RNA酶EP管中;向EP管中加入200 µL氯仿,震荡15 s,室温静置5~10 min;4℃、12 000 ×g离心15 min,将上层水相转移到新的无RNA酶EP管中,再加入等量异丙醇,-20℃沉淀RNA 1 h或者更长时间;4℃、12 000 ×g离心20 min,弃去上清液;加入1 mL的75%乙醇,4℃、12 000 ×g离心10 min,弃去上清液;在超净台中,风干RNA沉淀物,加入30 µL的DEPC水,使其充分溶解,然后用微量核酸蛋白测定仪NanoDrop 2000c分光光度计测定RNA浓度。
根据测定的RNA浓度,取2 µg RNA,用DEPC水补足至33.5 µL,加入2 µL引物18T,或病毒基因特异性引物R-gRNA(+),或病毒基因特异性引物R-gRNA(-),70℃水浴10 min,再迅速转移至冰上3~5 min。按照表1所示的50 µL反转录体系加缓冲液、dNTP、RNA酶抑制剂和反转录酶置于42℃反转录2 h。将RNA反转为cDNA后,置于75℃灭活5 min,储存于-20℃,备用。反转录体系为:2 µg DEPC水和RNA,2 µL的18T随机引物特异性引物R-gRNA(+)或R-gRNA(-),10 µL的5×反转录缓冲液,2 µL的dNTP,1 µL的RNA酶抑制剂。以cDNA为模板,采用SYBR Green染料法进行PCR测定。按荧光定量RT-PCR反应体系,在实时定量PCR仪器设置如下反应程序:94℃预变性3 min,94℃变性15 s,60℃退火15 s,72℃延伸20 s,共40个循环。通过溶解曲线分析,采用2-ΔΔCT法计算目的基因RNA相对表达量,内参基因采用β-actin,引物序列见表1。

表1 RT-PCR引物序列Table 1 RT-PCR primer sequence
1.7 间接免疫荧光实验以pEGFP-N1-VCP质粒转染Vero细胞24 h,以1 MOI IBV感染细胞。分别在感染后0 h、1 h、2 h,每孔加入1 mL新鲜配制的5%多聚甲醛,室温固定10 min,预冷的TBST清洗3遍;每孔加入1 mL含有5%BSA的TBST溶液,37℃封闭30 min,TBST清洗3遍;分别孵育Rab5、Rab7和LAMP1抗体1 h,TBST清洗3遍,然后避光孵育带有荧光二抗1 h,TBST清洗3遍,孵育DAPI稀释液5 min左右,TBST清洗3遍。取出盖玻片倒扣在滴有抗荧光淬灭封片剂的载玻片上,避光风干过夜后放4℃保存,通过蔡司激光共聚焦显微镜避光观察和成像。
2 结果
2.1 干扰VCP的表达不利于病毒的增殖转染siRNA干扰VCP的表达,36 h后接种IBV。感染12 h后收取细胞样品,通过Western blot检测VCP的干扰效果和IBV N蛋白的表达。与sic对照组相比较,siVCP成功地干扰了VCP的表达;病毒蛋白IBV-N的表达水平在干扰VCP的细胞中略有减少(图1A),揭示干扰VCP的表达,不利于IBV的增殖。进一步检测IBV RNA水平,发现病毒的正链RNA和负链RNA在干扰VCP的细胞中均有下降(图B)。以上结果证实VCP能够促进病毒的复制。
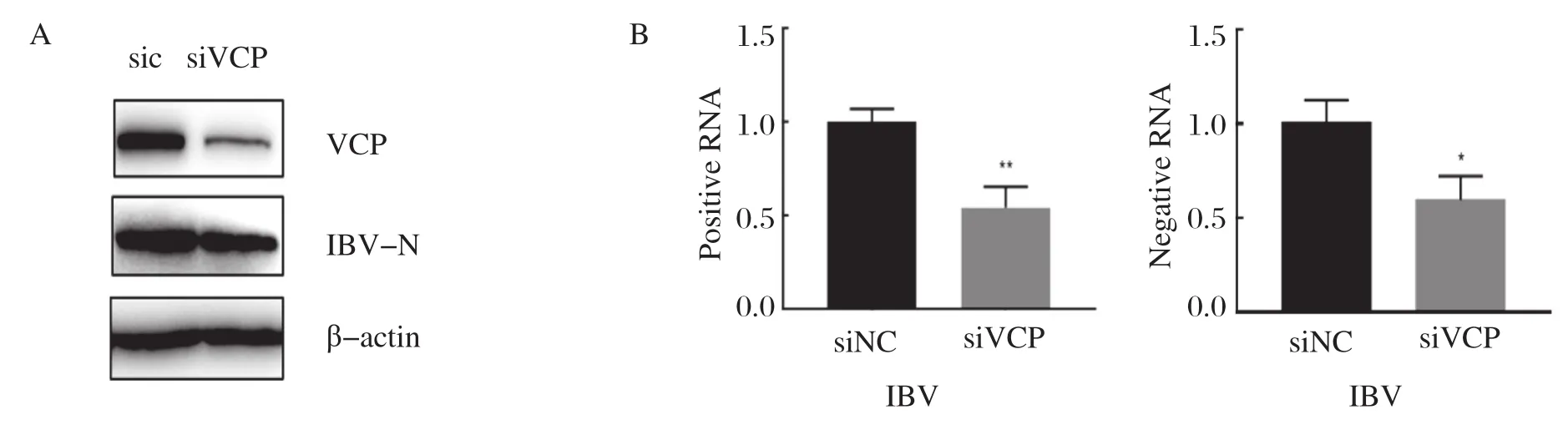
图1 干扰VCP对IBV增殖的影响Fig.1 siVCP affect the IBV replication
2.2 外源表达VCP促进IBV增殖以GFP-VCP转染Vero细胞,24 h后以1 MOI IBV感染细胞,12 h后收取样品,检测病毒N蛋白的表达水平和基因组RNA复制水平。与表达GFP的对照组相比较,外源表达GFP-VCP明显促进IBV-N蛋白的表达和病毒基因组RNA复制(图2A、2B),证实VCP有助于病毒的复制和增殖。在感染后2 h检测进入细胞的病毒基因组,则发现病毒的内吞不受VCP表达水平的影响,说明VCP在病毒内吞后促进病毒的感染(图2C)。
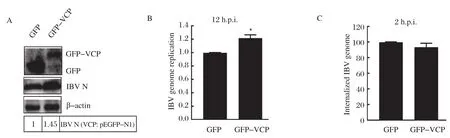
图2 过表达GFP-VCP对IBV感染的影响Fig.2 Overexpression of the GFP-VCP affect the IBV infection
2.3 GFP-VCP与内体标志物Rab5发生共定位IBV发生网格蛋白依赖型内吞后,通过细胞的内体系统进行运输,依次通过早期内体、晚期内体,到达溶酶体[8]。已有报道表明,敲除VCP后导致IBV病毒粒子滞留在早期内体[4]。为了探究VCP在病毒的胞内运输中发挥作用,我们检测了GFP-VCP在病毒入胞过程中的亚细胞定位。以GFP-VCP转染Vero细胞,24 h后以1 MOI的IBV感染细胞,分别在0 h、1 h和2 h收取细胞进行间接免疫荧光实验,检测GFP-VCP跟早期内体标志物Rab5、晚期内体标志物Rab7、溶酶体标志物LAMP1的共定位。结果可知,在感染后0、1、2 h,VCP均与早期内体标志物Rab5共定位,不跟晚期内体标志物Rab7或溶酶体标志物LAMP1共定位(图3)。以上结果说明:在病毒感染过程中,VCP定位于早期内体,可能参与早期内体的成熟,因而促进IBV从早期内体运输到晚期内体。
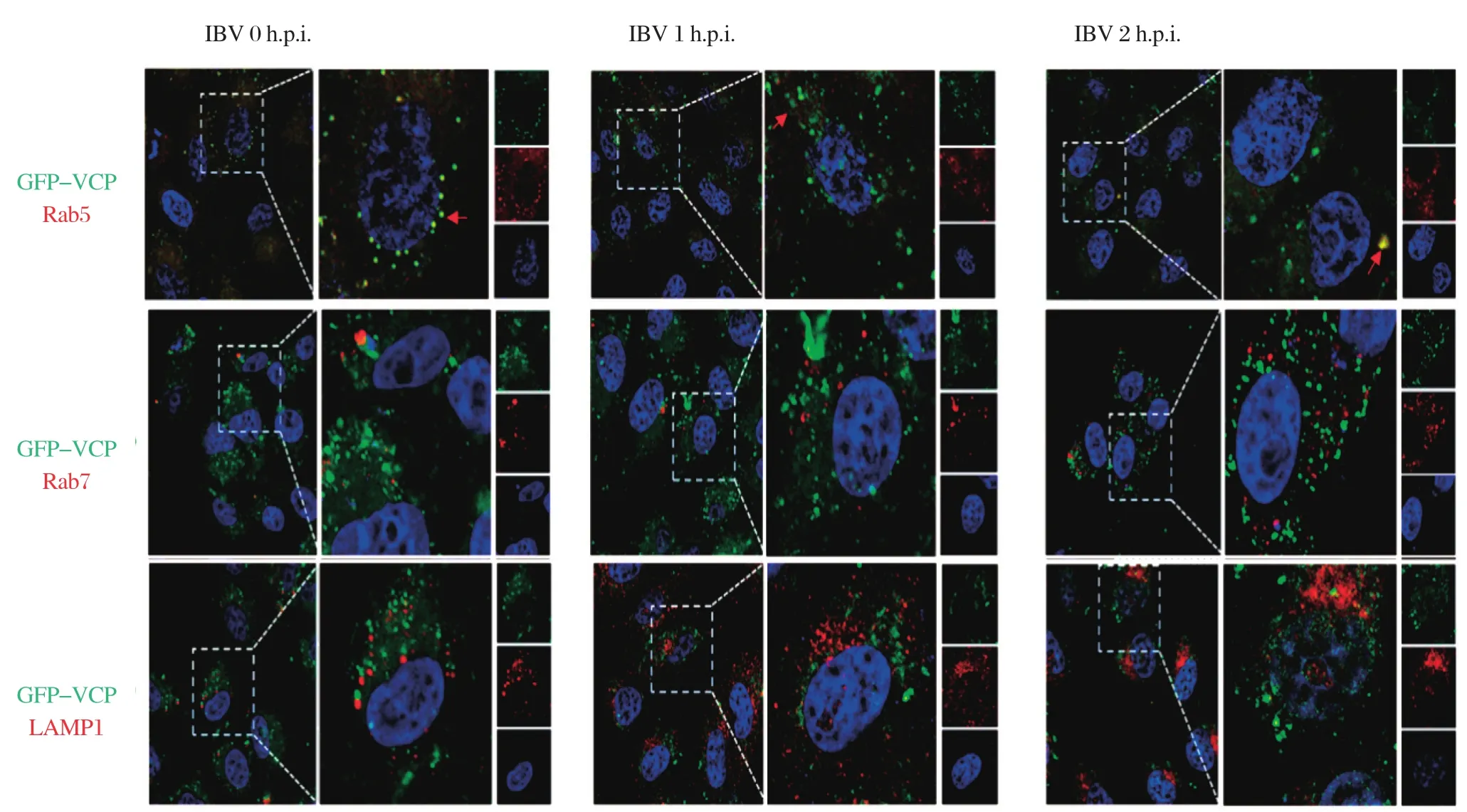
图3 GFP-VCP过表达时,与早期内体的定位关系Fig.3 Location between the early endosome and GFP-VCP
3 讨论
VCP能够形成同源六聚体,参与内质网相关的蛋白降解、线粒体相关的蛋白降解和细胞自噬[9],阻止错误折叠蛋白的累积;在细胞压力解除时,VCP参与应激颗粒小体的解聚和恢复mRNA翻译;在胞内运输系统参与膜融合,促进早期内体的成熟,参与胞内运输。由此可见,VCP是个多功能蛋白。本研究发现:干扰VCP的表达,明显抑制IBV的复制和增殖;过表达VCP蛋白,则促进IBV的增殖,但对IBV的内吞没有明显影响。因此,初步判断VCP在病毒被细胞内吞后发挥作用。进一步实验发现:VCP蛋白在IBV感染过程中定位于早期内体,揭示VCP有可能参与早期内体的成熟,对于依赖早期内体运输的IBV起着促进胞内运输作用,进一步证实了之前的研究结果[4]。VCP是否对依赖于早期内体运输的病毒均有促进作用,还有待于进一步证实。
除了通过促进胞内运输系统的成熟,VCP还有可能通过其他方式促进病毒增殖。例如,VCP促进应激颗粒小体的解聚,能够恢复病毒mRNA的翻译[10];VCP通过促进RIG-I的降解,负向调控干扰素的表达[11]。前人研究表明,VCP在多种病毒的感染中发挥重要作用:例如,在辛德比斯病毒感染中,VCP能够调控其受体NRAMP2的胞内运输,促进病毒的入胞[12];在西尼罗河病毒感染过程中,VCP参与病毒生命周期的早期感染步骤和基因组复制过程[13];在脊髓灰质炎病毒的感染过程中,VCP有可能参与病毒的释放途径。因此,VCP可能在不同病毒的生活周期发挥作用,影响病毒的增殖。

