副猪嗜血杆菌荧光定量PCR的建立和临床应用
庞琳琳 ,赵秋华 ,王 欣 ,张俊杰 ,郭 爽 ,李蓓蓓 ,刘 珂 ,邵东华 ,邱亚峰 ,马志永 ,袁万哲,魏建超
(1.河北农业大学动物医学院,保定 071001;2.中国农业科学院上海兽医研究所,上海 200241;3.上海市闵行区动物疫病预防控制中心,上海 201109)
副猪嗜血杆菌(Heamophilus parasuis,Hps)是一种多形态依赖NAD的革兰氏阴性球菌,属于巴斯德科(Pastteurellacea)嗜血杆菌属(Heamophillus)[1]。Hps是上呼吸道的常在菌,也是一种条件致病菌,可引起全身性的疾病,即以纤维性多浆膜炎、关节炎和脑膜炎或急性肺炎和急性败血症为特征的Gläserser病[2-3]。迄今为止,已经分离出15种不同血清型Hps。有文献报道,血清型1、5、10、12、13和14型为强毒株,腹腔感染Hps仔猪4 d内能引起死亡;血清型2、4、15型为中等毒力菌株,接种SPF猪可以引起多发性浆膜炎,但不会出现死亡;而其他的血清型归为无毒力性菌株,感染Hps仔猪时并未出现相关的临床症状[4-6]。目前Hps呈全球性分布;血清型4型在巴西最普遍,其次是血清型5、14、13和2型[7];而在中国血清型4型和5型最为流行,其次为5、12和13型[8-10],给我国养猪业带来了巨大的经济损伤。
近年来,Hps在国内广泛流行,死亡率可高达50%。因此,Hps的早期诊断诊断方法的应用尤为重要。细菌性疾病传统的检测方法是细菌的分离培养,但此法具有耗时较长,工作量较大等缺点。目前,用于检测Hps主要方法有血清学和分子学两种[11];其中血清学方法最基本的原理为抗原抗体结合,但在Hps的感染早期机体内的抗体水平较低,应用此法不易检测[12-13];在临床上一般使用常规PCR和荧光定量PCR的分子学检测方法,但常规PCR不仅不能对病料中的细菌进行定量检测还极易出现假阳性[14-15];荧光定量PCR不仅操作简单,还具有敏感性高、特异性好和稳定性强等优点[16-17]。本研究根据GenBank上副猪嗜血杆菌不同血清型的基因保守区设计引物,建立用于检测血液、鼻拭子、组织等样本的SYBR Green Ⅱ荧光定量PCR方法;检测了此方法的敏感性、特异性、重复性,并与细菌分离培养法、普通PCR法进行了比较,以期实现Hps的快速诊断和定量分析,并为Hps的隐形感染和持续带菌猪的诊断提供一定的技术支持
1 材料和方法
1.1 菌株W2-Hps由中国农业科学院上海兽医研究所猪呼吸道团队2016年从疑似患Hps病的动物的心包积液和关节中分离纯化得到,经16S rRNA基因组测序及PCR血清血鉴定后为13型Hps。
1.2 主要试剂pMD18-T载体和大肠杆菌DH5α感受态细胞、SYBR Green Ex Taq Ⅱ及DNA胶回收试剂盒均购自宝生物工程大连有限公司;DL2000 DNA marker及质粒抽提试剂盒均购自天根生化科技(上海)有限公司;2× Taq PCR Master Mix购自天根生化科技有限公司;Agarose购自元升生物科技(上海)有限公司。
1.3 引物的设计与合成参照GenBank中Hps全基因组中特异性保守序列,利用Primer Premier 5.0软件设计1对引物,Hps-qF:5'-ACAACCTGCAAGTAC TTATCGGGAT-3',Hps-qR:5'-TAGCCTCCTGTCTGAT ATTCCCACG-3',扩增片段的长度为275 bp。所有引物由上海桑尼生物有限公司合成。
1.4 标准品的制备采用细菌基因组提取试剂盒提取副猪嗜血杆菌Hps-W2株基因组DNA作为PCR模板,应用设计的引物扩增目的片段,PCR反应体系(50 µL)为:Hps-qF/R(10 µmol/L)各2 µL,2×Taq PCR Master Mix 25 µL,基因组DNA4 µL,ddH2O补足50 µL。反应程序:95℃预变性5 min;95℃变性1 min,58℃退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10 min。将PCR产物进行琼脂糖凝胶电泳检测,确定目的片段后,用胶回收试剂盒回收目的片段并与pMD18-T载体连接构建重组质粒,提取重组质粒送上海桑尼生物科技有限公司测序,经测序正确的阳性重组质粒pMD-Hps作为标准品,测定其浓度并置于-80℃保存备用。
1.5 反应体系和循环条件的优化通过对引物浓度、退火温度、反应时间等进行筛选优化,综合考虑Ct值、荧光强度、曲线平滑度、重复性,确定荧光定量PCR最佳的反应条件。
1.6 标准曲线和熔解曲线的建立以10倍比稀释的重组质粒p M D-H p s为标准品,浓度为1.0×107~1.0×101copies/μL,进行荧光定量PCR,绘制标准曲线和熔解曲线。
1.7 敏感性试验将上述10倍倍比稀释的pMD-Hps质粒标准品同时进行Hps荧光定量PCR和普通PCR检测,并对结果进行比较分析,以确定其检测下限。
1.8 特异性试验采用细菌基因组提取试剂盒提取血清4、12、13型的Hps、大肠杆菌、葡萄球菌、多杀巴氏杆菌、支气管波氏杆菌、胸膜性肺炎放线杆菌和猪肺炎支原体的基因组DNA作为模板,同时用TSB作为阴性对照,进行Hps荧光定量PCR检测,并根据扩增曲线和Ct值判断其特异性。
1.9 重复性试验选取浓度为1×108~1×102copies/μL Hps重组质粒标准品为模板,按照上述建立的SYBR Green Ⅱ实时荧光定量PCR的反应条件和体系,分别进行组内和组间重复性试验,对稀释的每个拷贝数进行3个平行重复试验,计算其变异系数(CV),验证其稳定性。
1.10 临床样品检测应用收集80份疑似副猪嗜血杆菌病症状的猪临床样品,包括鼻拭子、肺脏、心血、关节液和心包积液,分别用细菌分离培养、常规PCR和荧光定量PCR方法进行检测与比较。
2 结果
2.1 标准品的制备应用针对Hps的特异性引物,以Hps-W2株基因组DNA为模板进行PCR扩增。在1%琼脂糖凝胶中电泳,可见一条275 bp的目的条带,大小与预期相符(图1)。回收目的基因片段并将其连接到pMD-18T载体构建重组质粒pMD-Hps,重组质粒的测序结果与GenBank数据库中Hps参考毒株一致。扩增上述阳性菌株并提取重组质粒pMD-Hps,紫外分光光度计测定其浓度为344 ng/μL,换算成拷贝数为0.107 ×1012copies/μL,然后稀释至1.0×1010copies/μL备用。

图1 Hps目的基因的扩增与重组质粒pMD-Hps的鉴定Fig.1 PCR amplifications for Hps fragment and identification of recombinant plasmid pMD-Hps
2.2 优化后的反应体系和循环条件采用矩阵法优选引物的最佳工作浓度和用量。结果表明,引物Hps-qF/R(10 μmol/L)各0.8 μL对模板的检测可获得较小的Ct值(见表1)。最佳反应体系(20 μL)为:DNA 2 μL,2×SYBR Green premix Ex Taq Ⅱ Mix 10 μL,ROX Reference Dye(50×)0.4 μL,Hps-qF/R各0.8 μL,DEPC水6 μL。最佳反应程序:98℃预变性30 s;98℃变性5 s,60℃退火31 s,共40个循环。

表1 Hps荧光定量PCR组内、组间重复性分析Table 1 The result of intra assay and inter assay for Hps fluorescent quantitative PCR
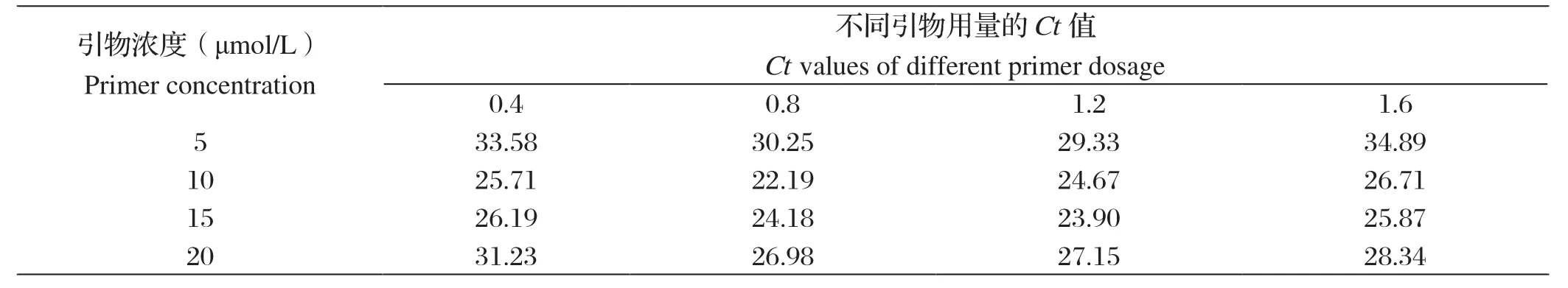
表1 用矩阵法优选引物的最佳工作浓度和用量Table 1 The optimal working concentration and dosage of primers were optimized by matrix method
2.3 标准曲线和熔解曲线的建立反应体系和条件优化后进行荧光定量PCR,以标准品拷贝数对数为X轴,以Ct值为Y轴建立标准曲线,线性回归方程分别为y=-3.4379x+35.056(R2=0.9931),扩增效率为100%;熔解曲线峰值单一,未出现特异性扩增(图2)。

图2 Hps荧光定量PCR标准曲线和熔解曲线Fig.2 The standard curve and dissolution curve of Hps fluorescent quantitative PCR
2.4 敏感性试验通过两种方法的比较发现,Hps荧光定量PCR检测极限为10 copies/µL,比本实验室建立的普通PCR高两个数量级(图3)。

图3 Hps荧光定量PCR和普通PCR的敏感性比较Fig.3 The Sensitivity of Hps fluorescent quantitative PCR and convention PCR
2.5 特异性试验通过对上述的常见的猪呼吸道病原菌基因组DNA进行荧光定量PCR扩增,结果表明,只有血清4型、12型、13型的Hps出现单一、特异性的“S”形曲线,而其他菌株和阴性对照没有检测出阳性峰值信号(图4)。

图4 Hp s荧光定量PCR的特异性分析Fig.4 The specificity of Hps fluorescent quantitative PCR
2.6 重复性试验Hps荧光定量PCR组间和组内重复试验的Ct值和变异系数(CV)见表4,对检测结果进行统计学分析显示,该方法组内变异系数为0.06%~2.4%,组间变异系数为1.9%~3.9%,其变异系数均小于4%,表明建立方法具有较好的稳定性和重复性。
2.7 临床样品检测结果对80份疑似副猪嗜血杆菌病症状的猪临床样品进行细菌分离培养、常规PCR和荧光定量PCR检测。试验结果如表2所示,细菌分离培养方法的阳性率为16.3%(13/80);常规PCR检测方法的阳性率为38.8%(31/80);荧光PCR检测方法的阳性率为62.5%(50/80)。由以上结果可知,本研究建立的副猪嗜血杆菌荧光定量PCR比常规PCR敏感,且灵敏度明显高于细菌分离方法。
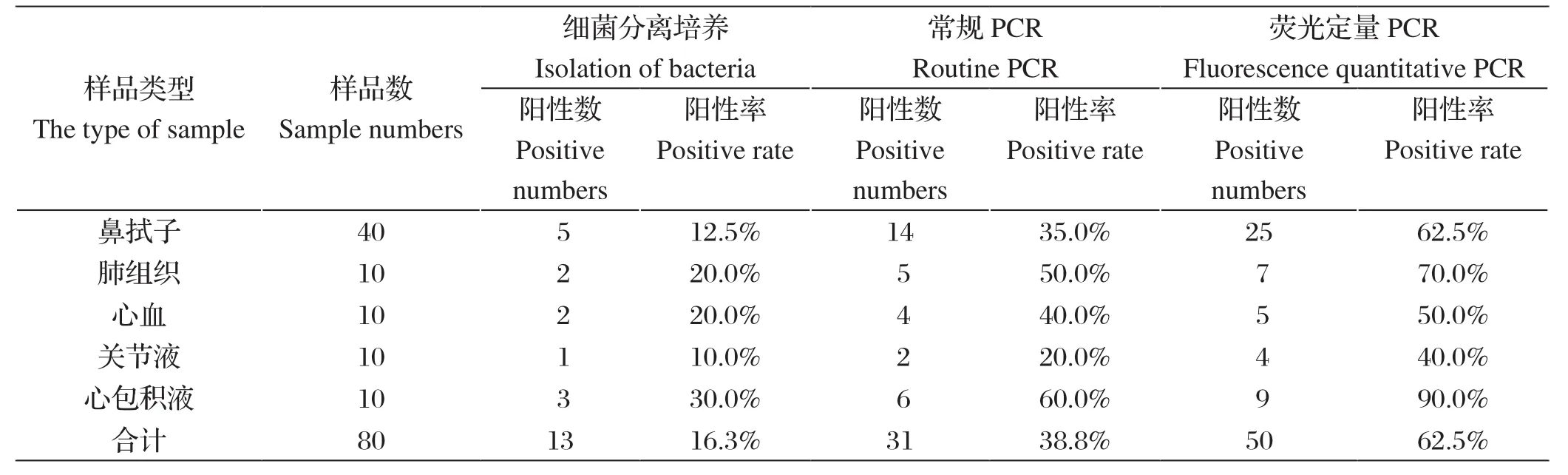
表2 三种Hps检测方法的比较Table 2 Comparison among three detection methods of Hps
3 讨论
Hps血清型很多,各血清型之间的毒力不同[18-19];其中4型、5型、12型、13型和15型毒力较强,且在我国血清型4、5型和13型较为流行,给养猪业带来了巨大的经济损失[20-23]。因此,建立良好的Hps感染早期的分子检测方法尤为重要。目前,荧光定量PCR方法被广泛应用于临床样本的检测,此方法具有敏感性高、特异性好和稳定性强等优点。本文应用荧光定量PCR染料法建立了快速检测Hps的方法。
荧光定量PCR染料法主要是以SYBR Green为染料,在PCR扩增过程中将此染料镶嵌到基因组中的方法,与双链DNA结合后,其荧光强度可大大增强。SYBR Green荧光染料不嵌入双链中的染料分子不发射荧光,嵌入DNA双链后发射荧光,同步PCR产物的增加与荧光信号的增强。本研究应用SYBR Green Ⅱ法建立了用于检测Hps的定量PCR法,此方法的灵敏度高、特异性好和稳定性强;且能够定量检测样本中Hps的载量。在临床上,一般应用普通PCR或细菌分离的方法测定组织中是否有细菌的存在;但在菌体感染早期组织中的菌量少,普通PCR的灵敏性有限,可能会出现假阴性结果,不能及时发现细菌的感染;应用细菌分离的方法进行确定是否有Hps感染时,因Hps生长缓慢,耗时较长,且Hps血清型众多[13,24],临床上存在大量的Hps不能分离培养,因此出现假阴性结果的可能性较大。相较于其他检测方法荧光定量PCR法更加灵敏,是普通PCR的100倍,可提高临床样品检测中的阳性检出率。

