APAP 急性肝损伤小鼠肝脏组织转录组RNA-seq 及相关信号通路分析
马春丽,王 利,王羚鸿,董 超,潘海婷,包玉龙
(内蒙古医科大学基础医学院,内蒙古 呼和浩特 010110)
对乙酰氨基酚(acetaminophen,APAP)是广泛使用的非处方镇痛药和退热药的常见成分[1]。 尽管APAP 给药剂量(4 g/d)对健康成人是安全的,但当剂量超过10~12 g/d 时,APAP 可能导致急性肝衰竭(acute liver failure,ALF)[2]。APAP 过量是导致ALF 的主要原因, 在美国占所有ALF 的46%,在欧洲占40%~70%[3]。此外,慢性肝病患者或儿童对APAP 治疗剂量的反应可发展为一系列临床相关肝病, 使得有意或无意的APAP 过量成为西方国家药物诱导肝损伤(DILI)最常见的原因[4]。近年来,对乙酰氨基酚肝毒性的分子机制得到了广泛研究,但对APAP 诱导的ALF 的具体分子机制尚不清楚[5-6]。 该研究建立了APAP 诱导的急性肝损伤小鼠模型, 并对损伤后第2 天的损伤肝脏组织转录组进行RNA-seq, 试图探究在急性肝损伤发生发展过程中相关基因和信号通路。
1 材料与方法
1.1 实验动物
雄性C57BL/6J 小鼠6 只, 随机分为2 组,每组3 只,分别为正常小鼠组(对照)、APAP 急性肝损伤小鼠损伤后第2 天模型组。 实验用小鼠购于北京维通利华实验动物技术有限公司。
1.2 试验材料
APAP(Sigma,美国),Trizol RNA 提取试剂盒(Invitrogen,美国),NEBNextUltraTMRNA 文库制备试剂盒(BioLabs,英国),UltraPure 琼脂糖(Invitrogen,美国)等。
1.3 试验方法
1.3.1 动物模型建立 选择6 周龄雄性C57BL/6J野生型小鼠经过1 周适应环境的饲养, 模型组腹膜内注射200 mg/kg APAP 溶液,建立急性肝损伤模型。 建模后第2 天,对小鼠进行异氟烷麻醉,解剖肝脏。 解剖前,小鼠停止进食12 h,自由饮水。
1.3.2 组织RNA 提取 小鼠肝脏组织在液氮中研碎。 按照TRIzol RNA 提取试剂盒说明书,提取RNA,-20 ℃冰箱保存备用。为监测RNA 降解和污染,进行1%琼脂糖凝胶电泳。 使用NanoPhotometer分光光度计 (I MPLEN,CA,USA) 和QubitRNA Assay Kit in Qubit2.0 Flurometer(Life Technologies,CA,USA)分别检测RNA 的纯度和浓度。使用RNA Nano 6000 Assay Kit in Bioanalyzer 2100系统(Agilent Technologies,CA,USA)评估RNA 完整性。
1.3.3 转录组测序文库建立 使用3 μg RNA 作为模板,按照NEBNext UltraTMRNA 文库制备试剂盒构建用于Illumina系统的cDNA 文库。用随机六聚体引物、M-MuLV 逆转录酶 (RNase H-)和DNA 聚合酶Ⅰ、RNase H 分别合成第一链和第二链cDNA,并进行纯化。 然后采用AMPure XP 系统(Beckman Coulter, 美国), 优先选择长度为150~200 bp 的cDNA 片段, 使用3 μL USER 酶(NEB,美国)将cDNA 进行切割,将adapters 连接到DNA片段的平滑末端,进行PCR。构建正常小鼠肝脏组织转录组样本和APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组样本的2 个cDNA 文库。 将cDNA 文库保存在干冰中,送至北京诺禾致源基因生物有限公司利用Illumina Hiseq 平台进行转录组测序。
1.3.4 生物信息学分析 得到测序读数的原始读长(Raw reads),经过Raw reads 过滤、测序错误率检查(Q20 和Q30)后,使用TopHat 2.0.9 将clean reads 与参考基因组进行比对,分别分析外显子区和内含子区的定位率和总定位率。 使用HTSeq 0.6.1 计算每个基因的定位率。 使用RPKM(Reads Per Kilobase per Million mapped reads), 即每百万reads 中来自某基因每千碱基长度的reads 数,估计基因表达水平。使用DESeq R 包(1.10.0)分析具有生物学重复的差异基因的表达,以P<0.05 为显著差异。 利用KOBAS 软件确定KEGG(京都基因和基因组百科全书) 信号通路中差异表达基因的静态富集。
2 结果
2.1 转录组测序数据质量控制与过滤结果
表1 包含了APAP 急性肝损伤小鼠损伤后第2 天和正常小鼠肝脏组织转录组参数, 包括原始读长(raw reads)、可用读长(clean reads)及可用读长与参考基因组的定位率。 从表1 可以看出,在APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组 (共3 个样品, 样品名称分别为AP2_1、AP2_2、AP2_3) 中共得到原始读长193 132 256条,正常小鼠肝脏组织转录组(共3 个样品,样品名称分别为C1、C2、C3) 中共得到的原始读长177 777 906 条。 在APAP 急性肝损伤小鼠损伤后第2 天肝脏组织和正常小鼠肝脏组织转录组中,经过过滤筛选的可用读长分别为185 223 780 条和170 601 288 条。 APAP 急性肝损伤小鼠损伤后第2 天肝脏组织和正常小鼠肝脏组织转录组的质量值≥20 的碱基占比(Q20)、质量值≥30 的碱基占比(Q30)、外显子定位率、内含子定位率和总定位率的平均值分别为97.78%、93.75%、95.99%、2.14%和95.50%(见表1)。
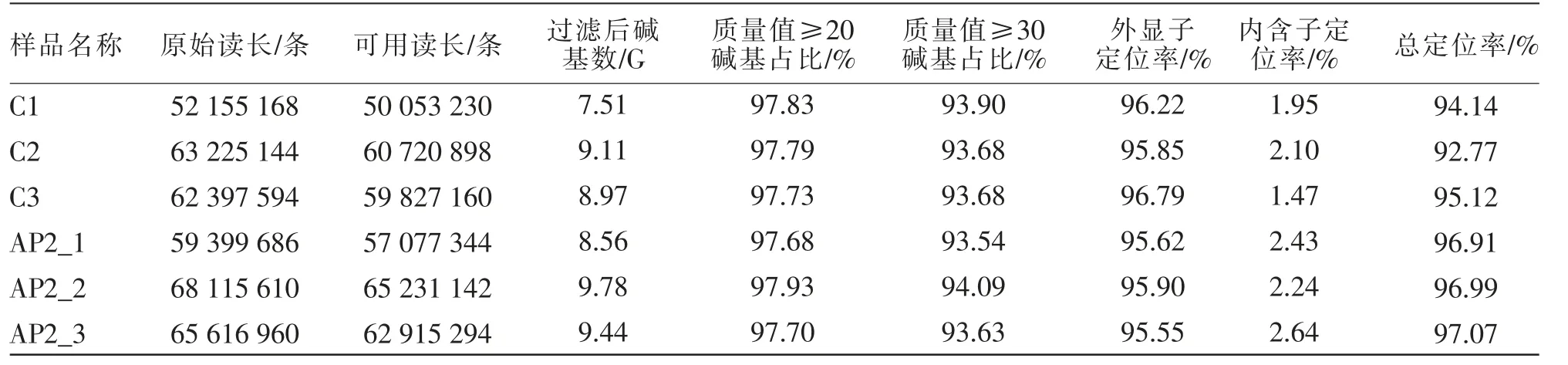
表1 小鼠肝脏组织转录组测序数据质量控制与过滤结果
2.2 差异表达基因的鉴定与分析
对正常小鼠、APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组分别进行测序、组装、分析和注释,使用DESeq R 包确定DEGs。 对肝脏组织转录组数据进行分析, 结果显示,APAP 急性肝损伤小鼠损伤后第2 天与正常小鼠肝脏组织转录组相比,共有7 270 个DEGs,包括3 707 个显著上调表达基因和3 563 个显著下调表达基因,P<0.05,FDR<0.01(见图1)。
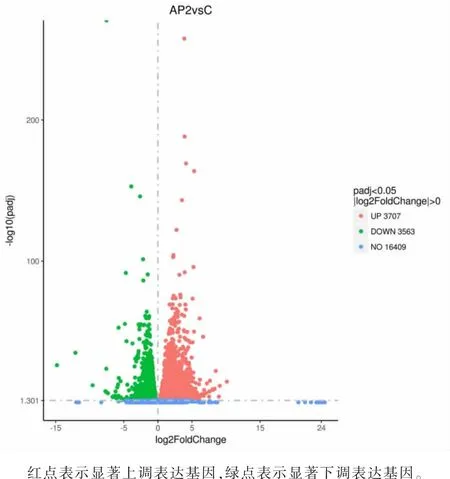
图1 APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组差异表达基因火山图
在所有显著上调表达基因中,Col3a1 基因在肝损伤组织中的表达水平最高 (7 611.243 RPKM),是正常小鼠肝脏组织表达量的10 倍, 其次是Apoa4 基 因, 再 次 是Lcn2、Col1a2、Col1a1 和Anxa2 基因。这些DEGs 在肝损伤组织中相对表达水平高于4 000,在正常肝脏组织中的相对表达水平低于600。 表2、表3 列出了APAP 急性肝损伤小鼠损伤后第2 天显著上调、显著下调表达基因中前20 个基因的名称、基因ID、表达变化量、显著性等信息。 显著上调表达基因中表达量变化最大的是Col1a1 基因(log2FoldChange 为5.324 9)和Gsta1 基因(log2FoldChange 为5.239 1),上调表达约40 倍, 其次是S100a6 基因 (log2FoldChange 为5.090 7),上调表达约34 倍,再次是Col1a2、Ccr2、Lgals3、Anxa2 基因,这些基因表达量在10 倍以上(见表2)。
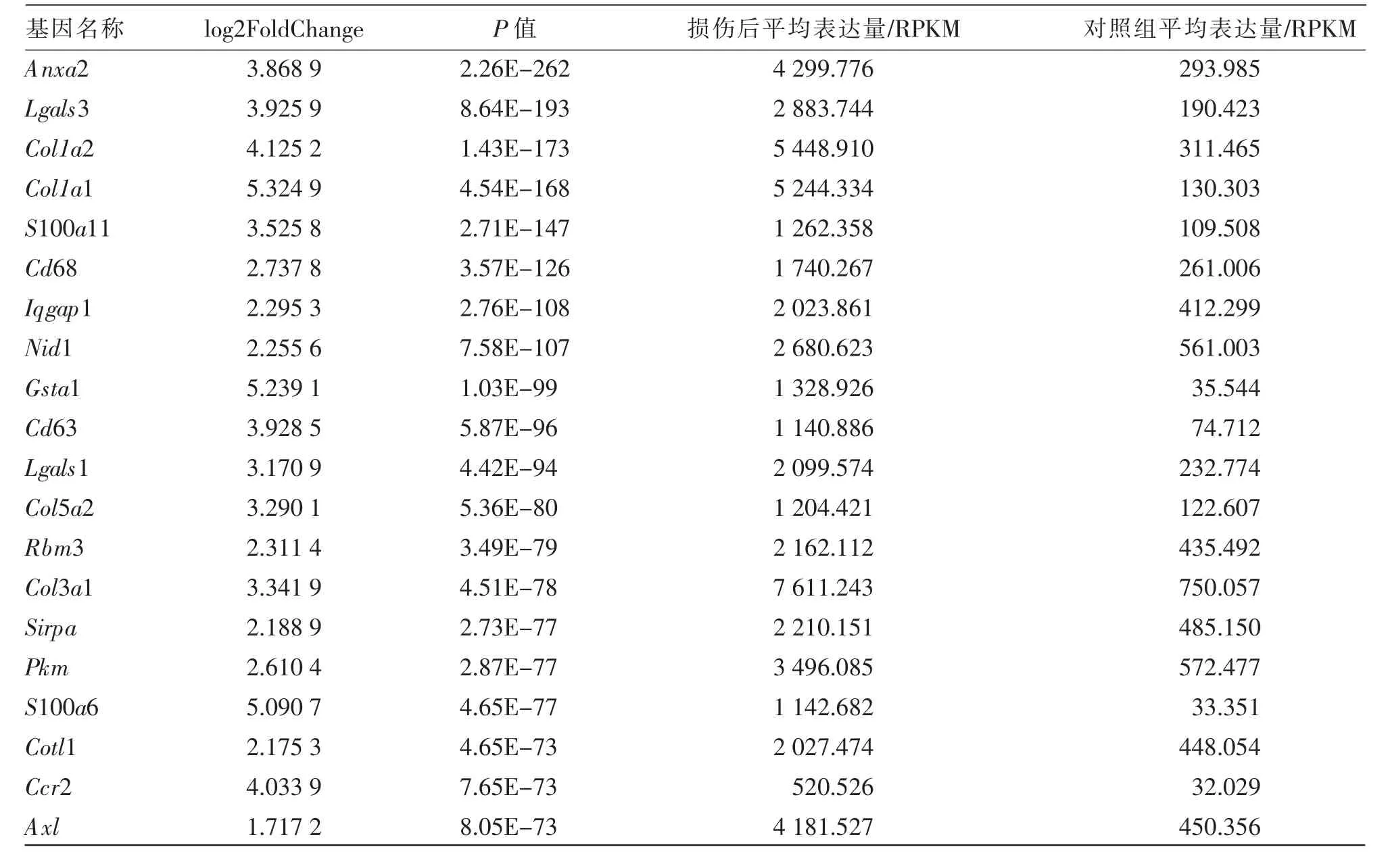
表2 APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中前20 个显著上调表达基因
显著下调表达基因中,差异表达量位于前10的 基 因 是Slc1a2、Glul、Acaa1b、Aldh3a2、Hsd3b5、Aadac、Mup3、Cyp8b1、Ces1f 和Gch1, 这些基因被下调表达2.4~184 倍。其中Slc1a2 和Hsd3b5 基因在小鼠肝损伤组织中的表达分别是正常小鼠肝脏组织的-184 倍和-26 倍(见表3)。

表3 APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中前20 个显著下调表达基因
2.3 KEGG 通路富集分析
KEGG 是系统分析基因功能的数据库, 将基因组信息与功能信息联系起来。 为鉴定APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中重要的KEGG 通路, 该研究对DEGs 进行KEGG 富集分析。 分析结果显示,APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组共有2 515 个DEGs在316 个不同的KEGG 通路中富集。 同时注释了119 条显著富集DEGs 的KEGG 通路 (50 条下调基因富集通路和69 条上调基因富集通路)。APAP急性肝损伤小鼠损伤后第2 天肝脏组织转录组显著上调表达基因富集的信号通路主要是趋化因子信号通路、B 细胞受体信号通路、NOD 样受体信号通路、ECM 受体相互作用信号通路等免疫和炎症相关信号通路(见图2A),显著下调表达基因富集的信号通路主要是氧化磷酸化、脂肪酸降解、脂肪酸代谢、碳代谢等合成代谢信号通路(见图2B)。
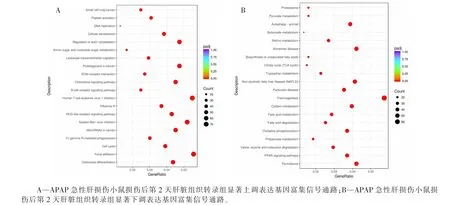
图2 APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中显著上调和下调表达基因富集信号通路
3 讨论
该研究采用二代测序技术对APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中DEGs 和富集信号通路进行了比较分析,通过转录组测序,在APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中得到7 270 个DEGs。 有研究证实,在APAP 急性肝损伤肝脏组织转录组中CCL2、CCR2、CCL5、Cx3cr1 等 基 因 上 调 表 达,Cyp2c29、LRH1、HNF4α、PPARα 和RXRα 等基因下调表达[7-8]。 该研究得到的转录组数据显示,CCL2、CCR2、CCL5、Cx3cr1 基因在APAP 急性肝损伤小鼠损伤后第2天肝脏组织转录组表达量分别上调16 倍、16 倍、2.27 倍 和31 倍, 而Cyp2c29、LRH1、HNF4α 和RXRα 基因表达量分别下调4.56 倍、1.5 倍、1.76倍和1.4 倍,这一结果与前人研究结果一致[9-12]。另外, 在该研究中也得到了在APAP 急性肝损伤组织转录组中差异表达的基因, 如血小板因子4(PF4)、S100a6、Gsta1、Cotl1 等,这些基因在急性肝损伤组织转录组中的作用有待进一步探讨。
该研究通过KEGG 分析发现,APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组共有2 515 个DEGs 在316 个不同的KEGG 通路中富集。 Wang 等[13]的研究中,对APAP 肝损伤模型小鼠在损伤6 h 时的组织进行转录组测序分析的结果显示,炎症相关通路(包括NF-κB、MAPK、TNF、IL-17 信号通路)显著上调。 而该研究中APAP 急性肝损伤小鼠在损伤后第2 天的肝脏组织转录组中NF-κB、MAPK、TNF、IL-17 信号通路也出现显著上调的结果。 在APAP 急性肝损伤小鼠损伤后第2 天肝脏组织转录组中的上调表达基因主要富集在趋化因子信号通路和ECM 受体交互作用信号通路,且在趋化因子信号通路和ECM 受体交互作用信号通路中的关键基因Col1a2、Col1a1 等胶原蛋白基因的表达量均上调10 倍以上;Ccr2、Dock2、Cx3cr1 和Adcy7 等 基 因 分 别 上 调16、4、32、4 倍,因此,在小鼠APAP 急性肝损伤的急性损伤期中,与炎症相关的趋化因子信号通路和ECM受体交互作用信号通路可能发挥重要作用, 但其相互作用机制有待进一步验证。
4 结论
该研究通过对APAP 急性肝损伤小鼠肝脏组织和正常小鼠肝脏组织转录组进行RNA-seq 测序,并对数据进行生物信息学分析发现,在APAP诱导的急性肝损伤过程中主要涉及免疫、 炎症相关信号通路和合成代谢信号通路, 趋化因子信号通路和ECM 受体交互作用信号通路可能是参与APAP 急性肝损伤过程中急性损伤期中发挥主要作用的信号通路。

