免疫亲和柱净化-高效液相色谱法测定饲料中玉米赤霉烯酮的不确定度评定
华洵璐,张海涛,董曼佳,王红连,严艺琳
(江苏省苏微微生物研究有限公司,江苏 无锡 214063)
玉米赤霉烯酮(ZEN)又称F-2毒素,是一种2,4-二羟基苯甲酸内酯类化合物,分子式为C18H22O5,主要由镰刀菌属菌株(如禾谷镰刀菌F.graminearum)产生[1];其耐热性较强,主要污染玉米、小麦、大米、大麦、小米和燕麦等谷物[2-3]。玉米赤霉烯酮具有类雌激素作用,以雌性动物的生殖系统为靶器官,引起雌激素水平升高,产生雌激素亢进症,使繁殖机能出现异常[4];此外,玉米赤霉烯酮通过直接损伤免疫系统,导致动物抵抗力下降;通过氧化损伤,引起动物肝肾组织退行性变化,造成肝肾功能紊乱;通过损伤内分泌系统,导致动物内分泌紊乱,给养殖业带来巨大经济损失[5-6]。玉米赤霉烯酮还可通过食物链在人体中蓄积,给人类健康造成极大的危害[7]。我国《饲料卫生标准》GB 13078—2017明文规定,仔猪、母猪和其他猪的配合饲料,玉米赤霉烯酮含量分别不得超过150、100和250 μg/kg,犊牛、羔羊、泌乳期精料补充料和其他配合饲料不得超过500 μg/kg[8]。
玉米赤霉烯酮测定方法主要有酶联免疫吸附法(ELISA)[9]、胶体金法(GICT)[10]、色谱串联质谱法(LC-MS/MS)[11]和高效液相色谱法(HPLC)[12]。免疫亲和柱净化-高效液相色谱法是一种免疫亲和净化与色谱法相结合的测定技术,通过与抗体的特异性结合,达到快速、高效、专一地从样本中分离出待测物,该方法具有较高的准确度、灵敏度和良好的选择性、重现性,特别适合于饲料等复杂样本的精准测定,因而成为玉米赤霉烯酮检测的权威方法[13-14],并专门制定了该方法用于饲料中检测的国家标准[15]。然而,经检索国内文献,还未发现专门针对该方法用于玉米赤霉烯酮测定的不确定度分析报告。
为了推动免疫亲和柱净化-高效液相色谱法在饲料检测领域的应用,我们依据CNAS-GL 006—2019《化学分析中不确定度的评估指南》[16],以实验室随机抽取的饲料样品为研究对象,对国标方法GB/T 28716—2012《饲料中玉米赤霉烯酮的测定免疫亲和柱净化-高效液相色谱法》[15]开展不确定度分析,从样品提取、净化、色谱等操作到各个分量,系统全面地进行评定与合成,发现影响实验数据的最大因素,帮助检测人员关注检测的关键环节,提高检测结果的准确性和可靠性。
1 材料与方法
1.1 材料
样品来自于江苏省苏微微生物研究有限公司样品室保藏的动物饲料阳性样本(编号:SW-cp1112),为某单位送检的肉鸡后期配合饲料(按照饲料卫生标准规定,限量≤500 μg/kg);玉米赤霉烯酮免疫亲和柱,江苏省苏微微生物有限公司生产,产品编号SWIAC501;玉米赤霉烯酮标准物质溶液GBW(E)100301,质量浓度20.52 μg/ml,国家粮食局科学研究院。
甲醇、乙腈,均为HPLC级,北京百灵威科技有限公司;吐温-20、磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠、氢氧化钠,均为分析纯级,国药集团上海生化试剂公司;有机滤膜(孔径0.22 μm),上海安谱实验科技股份有限公司;934-AHTM型玻璃纤维滤纸(直径11 cm、无荧光特性),Whatman公司;试验用水符合GB/T 6682—2008中一级水要求[17]。
1.2 仪器设备和计量器具
LC-20AT型高效液相色谱仪(配有RF-20Axs荧光检测器),日本岛津公司;Sepax C18色谱柱(4.6 mm×150 mm,5 μm),美国赛芬科技公司;DFY-500型摇摆式粉碎机,温岭市林大机械有限公司;PL203型电子分析天平,梅特勒-托利多仪器(上海)有限公司;IKA/KS130型圆周式振荡器,艾卡仪器设备有限公司(IKA中国),MX-F型振荡器,大龙兴创实验仪器(北京)股份公司;H1850型台式高速离心机,湖南湘仪实验室仪器开发有限公司;FE28型台式pH计,梅特勒-托利多仪器(上海)有限公司。
50 ml玻璃量筒(最大容量允差±0.5 ml)、100 ml玻璃量筒(最大容量允差±1.0 ml)、1 000 ml玻璃量筒(最大容量允差±10.0 ml),BOMEX公司;200 μl微量移液器(最大容量允差±1.2 μl)、1 000 μl微量移液器(最大容量允差±5.0 μl)、5 000 μl微量移液器(最大容量允差±30 μl),Thermo公司。
1.3 测定步骤
1.3.1试剂配制
0.2 mol/L氢氧化钠溶液:称取8 g氢氧化钠,加水溶解,冷却后用水定容至1 000 ml。
样品提取液(80%乙腈-水溶液):将800 ml乙腈与200 ml水混合均匀。
PBS磷酸盐缓冲溶液(pH 7.4):称取8 g氯化钠、1.16 g磷酸氢二钾、0.2 g磷酸二氢钾与0.2 g氯化钾,用水溶解,并定容至1 000 ml,0.2 mol/L氢氧化钠溶液调节pH值至7.4。
0.1%吐温-PBS:量取100 ml上述PBS磷酸盐缓冲液(pH7.4),加入100 μl吐温-20,混合均匀。
流动相:量取460 ml乙腈至1 000 ml的容量瓶中,加入460 ml水和80 ml甲醇,混合均匀并通过0.45 μm滤膜,备用。
玉米赤霉烯酮标准中间液(2.052 μg/ml):用微量移液器准确移取1.0 ml玉米赤霉烯酮标准物质溶液(20.52 μg/ml),置于10 ml容量瓶中,用乙腈稀释定容至刻度,混合均匀。
玉米赤霉烯酮标准工作溶液:根据实际使用需求,用移液器分别准确吸取玉米赤霉烯酮标准中间液50、125、250、1 250和2 500 μl置于5个5 ml的容量瓶中,用流动相稀释定容至刻度,得到0.020 52、0.051 30、0.102 6 、0.513、1.026 μg/ml共5种不同浓度的玉米赤霉烯酮标准工作溶液。玉米赤霉烯酮标准工作液储藏在2~8℃冰箱内,可使用6个月。
1.3.2提取方法
将样品粉碎至全部通过40目分样筛,充分混合均匀。
准确称取粉碎后的样品40.0 g于250 ml具塞锥形瓶中,加入4.0 g氯化钠和100 ml样品提取液,置于振荡器上振荡提取30 min。提取液全部转移至离心管中,4 000 r/min离心5 min。准确移取上清液10 ml,加入40 ml PBS磷酸盐缓冲溶液(pH 7.4),振荡混合均匀。用0.2 mol/L氢氧化钠溶液调节pH值至7.0左右,经玻璃纤维滤纸过滤1~2次,即得样品制备液。
1.3.3净化方法
根据国标[15]中“7.2净化”的说明,本研究免疫亲和柱的使用按生产厂家——江苏省苏微微生物有限公司的说明执行:将玉米赤霉烯酮免疫亲和柱取出,平衡至室温;将20 ml注射器连接于免疫亲和柱的上堵头。用微量移液器准确移取10.0 ml样品制备液(相当于0.8 g样品),注入注射器中;将气孔架与免疫亲和柱的下堵头连接,调节压力使样液以2 s/滴速度缓慢通过柱体。由于饲料组成复杂且颜色较重,先用10 ml 0.1%吐温-PBS清洗柱子,再用10 ml 10%甲醇-水冲洗柱子,最后用10 ml水冲洗柱子(流速控制在不大于2 ~3 ml/min),弃去流出液。准确加入2.0 ml甲醇(HPLC级),依靠自然重力流速洗脱柱子。收集全部洗脱液于55℃氮气吹干,用2.0 ml流动相复溶,漩涡混匀后,用有机滤膜(孔径0.22 μm)过滤。收集滤液,即为待测样液,可直接进行高效液相色谱(HPLC)测定。
1.3.4液相色谱条件
色谱柱:SepaxC18(4.6 mm×150 mm,5 μm),流动相:乙腈∶水∶甲醇=46∶46∶8,流速:0.8 ml/min,进样量:20 μl,柱温:30℃,检测波长:激发波长274 nm;发射波长440 nm。
1.4 数据计算
1.4.1标准曲线绘制
由低浓度到高浓度,分别取玉米赤霉烯酮标准工作溶液20 μl,注入高效液相色谱仪,在上述色谱条件下测定峰面积。重复性条件下,计算3次测定值的算数平均值;以浓度为横坐标、峰面积平均值为纵坐标,绘制标准曲线,并拟合获得标准曲线回归方程。
1.4.2样液中毒素浓度的计算
取1.3.3节净化方法所得待测样液20 μl,注入高效液相色谱仪,在上述色谱条件下测定峰面积。将测得的峰面积值,代入标准曲线回归方程,计算出样液中毒素浓度。
1.5 数学模型
样品中玉米赤霉烯酮含量(C)的计算公式为[15]:
式中,C为样品中玉米赤霉烯酮含量,μg/kg;Pi为样液的峰面积;V为样品的总稀释体积,ml;Cst为标准工作溶液的浓度,μg/m;Vst为标准工作溶液的进样体积,μl;Pst为标准工作溶液的峰面积平均值;m为样品的称样量,g;Vi为样液的进样体积, μl。
1.6 不确定度分量的来源
根据上述1.3节测定步骤和1.4节数据计算,可以看出整个测定过程包含样品称量、样品提取、样品净化、标准液配制和标准曲线绘制,以及数据处理等,每一步都会引入误差。
对于实际测定,标准曲线的绘制、样品提取中的萃取、样品净化中的免疫反应和洗脱反应等操作引入的不确定度是难以量化的。因此,我们结合实际工作可以采用标准曲线拟合、回收率校正因子、重复性等,来对这些步骤的不确定度进行评定,即指A类评定[18],主要有:
(1)标准曲线拟合引入的相对不确定度Ust-r。
(2)回收率校正因子的相对不确定度Urec-r。
(3)重复性测定引入的相对不确定度Up-r。
在实际测定中,对于称量、量取、稀释、加样、读数和数据处理等引入的不确定度,可以通过天平、量筒、微量移液器和高效液相色谱仪等的误差,以及线性相关系数来评定,属B类评定[18],主要有:
(1)标准物质纯度引入的相对不确定度Ub-r。
(2)样品称量引入的相对不确定度Um-r。
(3)样品提取引入的相对不确定度Ud-r。
(4)样品净化引入的相对不确定度Ue-r。
(5)高效液相色谱实验操作引入的相对不确定度Uh-r。
(6)数据处理引入的相对不确定度Un-r。
2 结果与讨论
2.1 不确定度分量的量化与评定
2.1.1标准曲线拟合引入的相对不确定度Ust-r
对5个浓度的玉米赤霉烯酮标准工作溶液分别进行3次平行测定,共计3×5=15次(n=15),测定结果见表1。
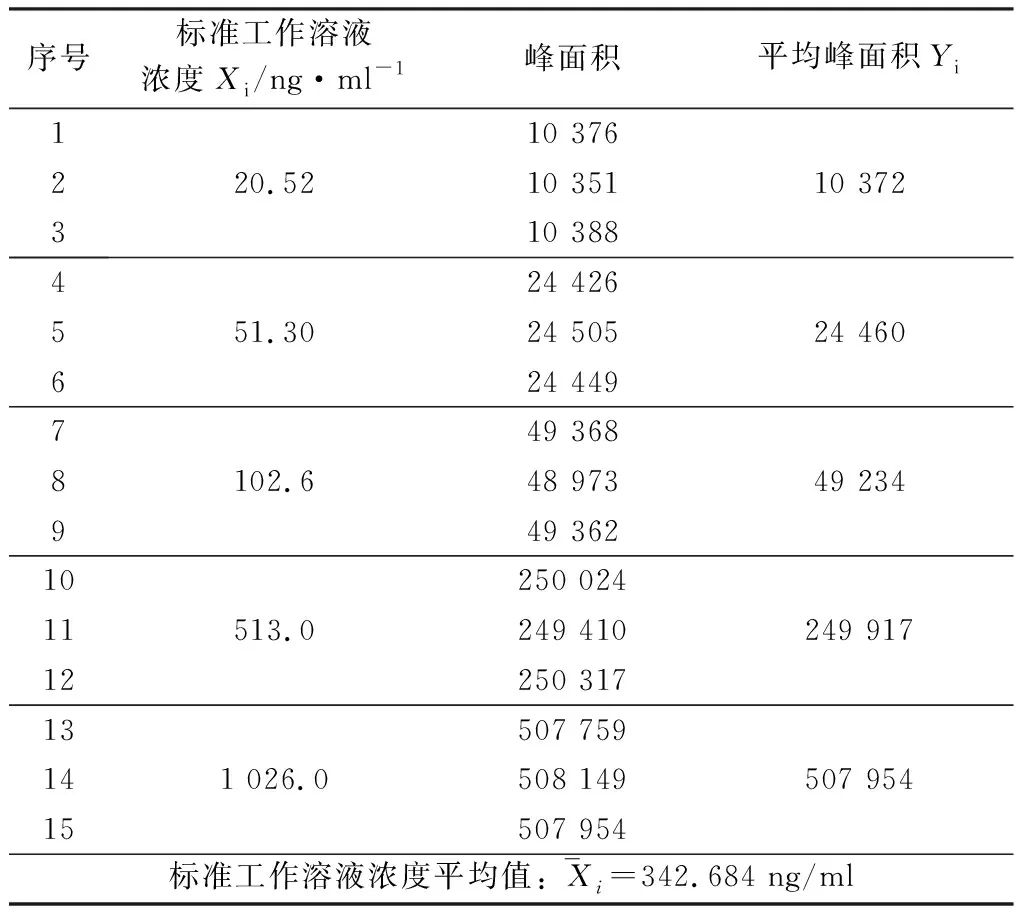
表1 玉米赤霉烯酮标准工作溶液各浓度的峰面积测定值(n=15)
以标准工作溶液各浓度为横坐标(X),峰面积平均值为纵坐标(Y),绘制标准曲线,见图1。
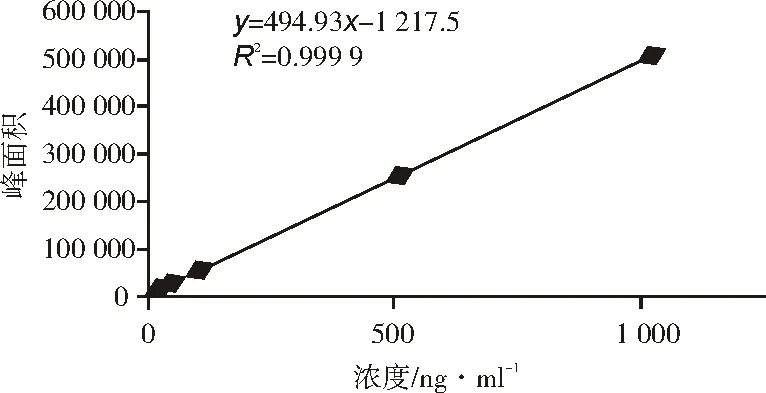
图1 标准曲线
由图1可知,拟合的标准曲线回归方程为Y=494.93X-1 217.6,线性相关系数R2=0.999 9。
根据表1和图1,则可按下式计算出标准曲线的标准偏差SR与偏差平方和SX:

=1 662.5
=2 226 789
称取同一粉碎后的样品5份,按照“1.3.2节提取方法”和“1.3.3节净化方法”制备成5份待测样液,进行高效液相色谱(HPLC)测定,每份样平行测定2次,共计2×5=10次(p=10)。根据测定的样液峰面积,采用标准曲线回归方程Y=494.93X-1 217.6,计算出样液浓度X样,结果见表2。

表2 样液测定结果(p=10)
综合上述,按下式计算出标准曲线拟合引入的不确定度为:

=1.406 8
则由标准工作曲线拟合引入的相对不确定度为:
Ust-r=UR/¯X样
=1.406 8÷203.34
=0.006 918 5
2.1.2回收率校正因子的相对不确定度Urec-r
称取同一粉碎后的样品3份,按250、500、750 μg/kg三个浓度水平加入玉米赤霉烯酮标准品,然后按照“1.3.2提取方法”和“1.3.3净化方法”制备成3份待测样液,进行高效液相色谱(HPLC)测定,每份样平行测定3次,共计3×3=9次(n=9)。根据测定的样液峰面积,采用“1.5数学模型”的公式,计算样品中玉米赤霉烯酮含量,再计算出加标回收率,结果见表3。
根据表3的结果,按照贝塞尔公式计算样品加标回收率的标准偏差为:

表3 加标回收率测定结果(n=9)
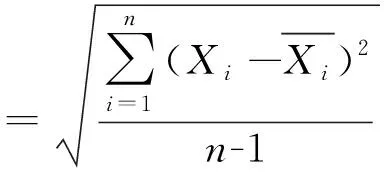
=4.331 8
综合上述,按下式计算出回收率校正因子引入的不确定度为:

=1.443 9
则由回收率校正因子引入的相对不确定度为:
Urec-r=Urec/¯Xi
=1.443 9÷97.52
=0.014 806
2.1.3重复性测定引入的相对不确定度Up-r
根据表2样液测定结果,采用“1.5节数学模型”的公式,计算样品中玉米赤霉烯酮含量(Ci),结果见表4。

表4 样品重复测定结果(p=10)
根据表4,按照贝塞尔公式计算出样品重复性测定的标准偏差SC:

=9.700 5
综合上述,按下式计算出重复性测定引入的不确定度为:
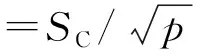
=3.067 6
则由重复性测定引入的相对不确定度为:
Up-r=Up/¯Ci
=3.067 6÷508.34
=0.006 034 5
2.1.4标准物质纯度引入的相对不确定度Ub-r
根据国家粮食局科学研究院提供的标准物质证书可知,玉米赤霉烯酮标准物质溶液GBW(E)100301的质量浓度为20.52 μg/ml,不确定度为0.25 μg/ml,则依据下式计算出标准物质纯度引入的相对不确定度为:
Ub-r=0.25÷20.52
=0.012 183
2.1.5样品称量引入的相对不确定度Um-r
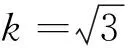
=0.002 886 7 g。
实际样品称取为40.0 g,则按下式计算出样品称量引入的相对不确定度为:
Um-r=Um/40.0
=0.002 886 7÷40.0
=0.000 072 167
2.1.6样品提取引入的相对不确定度Ud-r
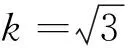
=0.000 577 35
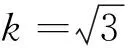
实际分别用量筒量取了200 ml水和800 ml乙腈试剂,则其相对不确定度分别为5.773 5÷200=0.0288 68和5.773 5÷800=0.007 216 9。
据此计算出配制样品提取液引入的相对不确定度为:
=0.029 756。
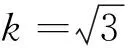
样品提取液中乙腈的体积膨胀系数为1.37×10-3/℃、水的膨胀系数为2.5×10-4/℃;鉴于乙腈∶水=8∶2(体积比),故样品提取液的膨胀系数为:
1.37×10-3×80%+2.5×10-4×20%=1.15×10-3/℃。
据此计算出量取提取液时引入的相对不确定度为:
=0.006 659 9。
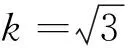
相对不确定度为上清液=0.288 67÷10=0.028 867、PBS磷酸盐缓冲溶液=0.288 67÷40=0.007 216 8。据此计算出稀释过程引入的相对不确定度为:
=0.029 755。
综合上述,可按下式计算出样品提取引入的相对不确定度为:

2.1.7样品净化引入的相对不确定度Ue-r
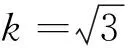
相对不确定度分别为:
17.321÷5 000=0.003 464 2。
据此计算出吸取10 ml样品制备液时引入的相对不确定度为:
=0.004 899 1

相对不确定度分别为:
2.886 8÷1 000=0.002 886 8。
据此计算出吸取2 ml洗脱液时引入的相对不确定度为:
=0.004 082 6
综合上述,可按下式计算出样品净化引入的相对不确定度为:
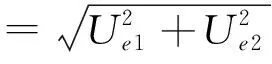
=0.006 377 2
2.1.8高效液相色谱实验操作引入的相对不确定度Uh-r

=0.010 970
2.1.9数据处理引入的相对不确定度Un-r
鉴于所测定的饲料中玉米赤霉烯酮含量总是在一段标准曲线内(20~410 ng/ml)呈线性关系,该段区间内曲线的线性相关系数就表征了该含量值的不确定度。根据本实验所得标准曲线的线性相关系数R2=0.999 9,则可计算出数据处理引入的相对不确定度为:
Un-r=1-0.999 9=0.000 1
2.2 相对合成不确定度Ur
将从2.1.1~2.1.9节各个不确定度分量及其评定结果,汇总列于表5。
因各不确定度分量相互独立,故将表5中的相对不确定度进行合成,则得到免疫亲和柱净化-高效液相色谱法测定饲料中玉米赤霉烯酮的相对合成不确定度为:

表5 不确定度分量及其评定结果汇总

=0.049 279
=4.927 9%
2.3 相对总不确定度(扩展不确定度)Ur(k)
按正态分布处理,取置信水平p=95%,包含因子k=2,则得到免疫亲和柱净化-高效液相色谱法测定饲料中玉米赤霉烯酮的总不确定度(扩展不确定度)为:
Ur(k)=k×Ur
=2×0.049 279
=0.098 558
=9.855 8%
2.4 测量不确定度报告
免疫亲和柱净化-高效液相色谱法测定饲料中玉米赤霉烯酮的结果可表示为:
C=508.34(1±0.098 558) μg/kg或C=508.34±50.10 μg/kg,置信水平p=95%。
3 结论
通过各种不确定度分量的分析,采用国标方法GB/T 28716—2012免疫亲和柱净化-高效液相色谱测定饲料中的玉米赤霉烯酮,其不确定度来源主要是样品提取、回收率校正因子、标准物质纯度和高效液相色谱实验操作,分别占比42.578 5%、14.795 7%、12.174 6%和10.962 4%,而样品称量、数据处理等导致的不确定度几乎可以忽略不计。因此,在实际测定工作中,应选择纯度较高的标准物质,尽量使用精密度高、误差小的实验仪器,实行精细化、标准化实验操作,提高各步骤的准确度和规范性,努力减小这些环节引入的不确定度。
采用国标方法GB/T 28716—2012免疫亲和柱净化-高效液相色谱测定饲料中玉米赤霉烯酮的结果为(508.34±50.10)μg/kg,即有95%的可能性在458.24~558.44 μg/kg范围内。根据国标GB 13078—2017《饲料卫生标准》的规定[8],饲料产品中其他配合饲料的玉米赤霉烯酮含量不得超过500 μg/kg,由此可判定本研究测定的肉鸡后期配合饲料样品为一个接近临界标准的阳性样本。本研究建立的评定方法对测定结果给出了一个较准确的波动范围,尤其在检测结果接近标准规定临界值时,可以降低误判风险。
倪永付等采用免疫亲和柱净化-高效液相色谱测定花生酱中黄曲霉毒素,影响测定不确定度的主要因素是检测重复性、加标回收率和标准工作液配制[19]。赵晶晶等采用免疫亲和层析净化超高效液相色谱法测定玉米中脱氧雪腐镰刀菌烯醇含量,其影响不确定度的因素主要是标准曲线拟合、标准系列工作液配制和测量重复性等[20]。研究结果与上述文献比较,可知标准品及其工作溶液配制是共同影响因素,而其他影响因素差异可能与样品、测定条件、测定步骤和仪器不同有关。
不确定度作为一种科学方法,是实验室工作的重要质量指标,测量结果的可用性很大程度上取决于不确定度的大小,因此不确定度的测定具有重要意义。本研究所建立的不确定度评定方法,为提高数据准确度、有效评价检测质量和正确使用检测数据提供了科学依据,可用于国标方法GB/T 28716—2012测定饲料中玉米赤霉烯酮[15]的不确定度评定。

