甘薯渣酶解制备高纯度结晶葡萄糖和可溶性膳食纤维的研究
石帅帅, 席 毅, 倪 贺, 吕镇城, 陈兆贵, 李海航*
(1. 华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室, 广州 510631; 2. 惠州学院生命科学学院, 惠州 516007)
甘薯(IpomoeabatatasLan)为旋花科的食药两用植物. 据联合国粮农组织(FAO)2015年的统计,中国的甘薯种植面积约为560万hm2,年产量约1亿t,分别占世界的70%和85%[1]. 甘薯除含有大量淀粉外,还含有丰富的营养物质,包括维生素、多酚、花色素苷、β-胡萝卜素、黄酮、粘液蛋白、去氢表雄酮,食用纤维等[2-6]. 甘薯具有多方面的药理功能,包括降血糖、降血脂、减肥、增强免疫力、抗肿瘤、抗菌性、抗氧化和抗突变等[7-12].
我国甘薯产量约50%用于加工生产淀粉,加工过程中会产生大量的废水和废渣. 这些废渣未被利用,造成巨大的资源浪费和环境污染[13]. 据报道,每生产1 t甘薯淀粉大约产生1.3 t甘薯渣. 甘薯渣中残留的淀粉含量可高达其干质量的61%[14],具有较高的利用价值. 近年来,对于甘薯渣资源的开发利用研究主要集中在制备膳食纤维、糖浆,或者用来发酵制备乙醇、氢气等[15-18].
本课题组研究和开发出了甘薯废水中全部生化成分的高效和高价值分离回收方法和工艺[3-5]. 本研究采用酶解法将甘薯渣中的淀粉完全水解成葡萄糖,并经过除杂和结晶得到超高纯度的药用级结晶葡萄糖,水解后的剩余物加入纤维素酶处理,可制备含可溶性膳食纤维较高的纤维制品,为甘薯渣的高价值利用提供了切实可行的方法.
1 材料与方法
1.1 材料、试剂和仪器设备
实验用甘薯品种为一点红(产地广东),购自广州白云区江南果蔬批发市场. 葡萄糖标品和糖化酶(10万U/g)购自上海源叶生物科技有限公司. 耐高温α-淀粉酶购自麦克林公司. 95%乙醇(食用级)购自广州成硕化玻有限公司. 乙腈为色谱级,购自Honeywell Burdick & Jackson (Muskegon, MI, USA);其他化学试剂均为分析纯或者生化试剂,购自广州化学试剂厂.
1.2 葡萄糖的定量分析
用高效液相色谱仪对葡萄糖进行定量分析. 检测器为示差折光检测器;液相色谱柱为Hpersil APS-2 NH2柱(4.6×250 mm, 5 μm);流动相为V(乙腈)∶V(水)=85∶15;流速0.75 mL/min;柱温25 ℃;进量为10 μL. 用不同质量浓度的超高纯结晶葡萄糖标准品(10、20、30、40、50 g/L)制作质量浓度和峰面积之间的定量标准曲线,根据样品的峰面积计算样品中葡萄糖的质量分数.
不同质量浓度的葡萄糖标准品溶液与其峰面积之间关系的线性回归方程为:y=75.797x-8.57,R2=0.999 9. 在此条件下,葡萄糖可与其它单糖类物质达到良好的基线分离,葡萄糖在10~50 g/L的范围内的质量浓度和峰面积之间有良好的线性关系.
1.3 酶解条件的优化
称取20 g新鲜的湿甘薯渣,加入1倍体积的水和一定量耐高温α-淀粉酶,加热液化一定时间后再加入糖化酶酶解一定时间,在室温下5 000 r/min离心10 min,取上清液得到酶解葡萄糖溶液,测定其葡萄糖的质量分数.
1.4 酶解葡萄糖的纯化
配制500 g/L的酶解葡萄糖溶液,分别加入1%、2%、3%、4%和5%的大孔树脂或聚酰胺,搅拌吸附3 h后离心,分离出溶液. 用紫外分光光度计在200~800 nm波长范围内扫描溶液的吸收光谱. 根据溶液的吸光强度分析溶液中杂质的脱除效果.
1.5 葡萄糖的结晶
配制不同质量浓度的酶解葡萄糖溶液,在65 ℃下加热30 min,加入少量的葡萄糖晶种,超声处理20 min后,在4 ℃下结晶. 结晶出的葡萄糖用少量95%乙醇洗去微量残留的杂质,在真空干燥箱中烘干.
1.6 酶解制备可溶性膳食纤维
取1 g水解后的残渣干粉,加入15 mL的0.05 mol/L柠檬酸缓冲液(pH 4),再加入纤维素酶,加热保温一段时间后8 000 r/min离心10 min,上清液加入4倍体积95%乙醇,沉淀过夜,离心分离. 沉淀即为可溶性膳食纤维.
所有实验至少重复3次,实验结果为3次重复的平均值,并计算标准差.
2 结果分析与讨论
2.1 α-淀粉酶酶解条件的优化
测定了α-淀粉酶添加量对酶解液中葡萄糖产生的影响. 酶添加量在10~50 U/g范围内(图1A),酶解的葡萄糖量随α-淀粉酶的增加而有所提高,但增加的幅度不大. 酶添加量为10、50 U/g时,酶解液中葡萄糖的质量浓度分别为59.1、68.2 g/L,其差异具有统计学意义,考虑到工业生产时酶的成本较高,选择α-淀粉酶的用量为20 U/g.
在60~90 ℃范围内,随着液化温度的增加,酶解液中的葡萄糖的质量浓度逐渐增加,从60 ℃时的56.5 g/L增加到90 ℃时65.5 g/L(图1B). 但当液化温度进一步升高到100 ℃时,酶解液中葡萄糖的质量浓度不再增加, 加热温度为60 ℃和90 ℃的差异具有统计学意义. 因此,选择90 ℃作为α-淀粉酶液化的最适温度.
在上述优化的α-淀粉酶添加量和90 ℃的酶解温度下,测定了酶解时间对葡萄糖产生量的影响(图1C). 当液化时间为30 min时,酶解液中葡萄糖的质量浓度为62.0 g/L,随着液化时间的延长,葡萄糖的质量浓度逐渐增大,当液化时间为60 min时,葡萄糖质量浓度达到65.8 g/L. 此后再延长液化时间,溶液中的葡萄糖质量浓度不再增加,表明淀粉已经完全被液化. 酶解60 min为α-淀粉酶液化的最佳时间.

图1 甘薯渣酶解制备葡萄糖的液化条件优化
2.2 糖化酶酶解条件的优化
研究和优化了糖化过程中糖化酶的加入量、酶解温度和酶解时间. 当糖化酶的加入量为100 U/g时(图2A),酶解液中葡萄糖的质量浓度为51.1 g/L,当糖化酶的加入量增加到200、300和400 U/g时,酶解液中葡萄糖的质量浓度变化不大,分别为52.3、53.8、54.0 g/L. 当糖化酶的加入量为500 U/g时,酶解液中葡萄糖的质量浓度有较大的提高,达到57.8 g/L. 糖化酶加入量为500 U/g,与其他组的差异具有统计学意义,考虑到大量生产时酶的成本较高,选择300 U/g作为糖化酶的用量.
测定了40~80 ℃的温度范围内糖化酶的糖化效果. 在40 ℃时(图2B),酶解液中葡萄糖的质量浓度为46.9 g/L. 随着温度的升高,酶解液中葡萄糖的质量浓度逐渐增加. 当糖化温度为60 ℃时,酶解液中葡萄糖的质量浓度达到最高(49.7 g/L). 此后,随着温度的升高,酶解液中葡萄糖的质量浓度则迅速降低,酶解温度为80 ℃时与其他组的差异具有统计学意义. 60 ℃为糖化酶处理的最佳温度.
当糖化时间为3 h(图2C),酶解液中葡萄糖的质量浓度为41.2 g/L,延长糖化时间到6、9、12 h时,酶解液中葡萄糖的质量浓度变化不大,约为43 g/L. 当糖化时间进一步延长到24 h时,酶解液中麦芽糖的质量浓度仍有少量的增加,至46.8 g/L. 加热3 h与24 h之间的差异具有统计学意义,考虑到工业生产时的效率,选择糖化酶的糖化时间为6 h. 如条件许可,糖化时间可延长至24 h.

图2 甘薯渣酶解制备葡萄糖的糖化条件优化
2.3 葡萄糖的纯化
水解后的糖溶液含有非糖类杂质,呈浅黄色. 因为糖类物质在紫外区没有吸收峰,可以通过紫外吸收光谱来检测溶液中非糖类物质的脱除效果. 实验测定和比较了在糖溶液中加入不同量的聚酰胺和大孔树脂对溶液中非糖类物质的吸附脱除效果(图3A、B). 大孔树脂吸附有紫外吸收的杂质的效果显著优于聚酰胺吸附效果. 大孔树脂在添加量为1%、2%、3%、4%和5%时都能显著降低水解液的紫外吸收,但随着大孔树脂用量的增加,葡萄糖的损失也逐渐增加. 综合考虑吸附除杂效果和葡萄糖的损失,选择在水解后的葡萄糖溶液中加入1%的大孔树脂,除去大部分非糖类杂质,此时葡萄糖的损失很少.
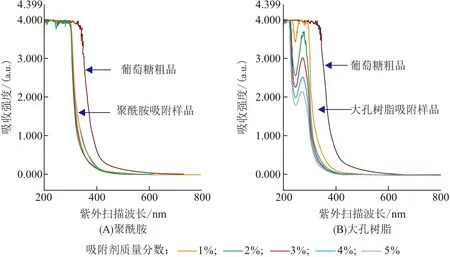
图3 聚酰胺和大孔树脂吸附除去酶解葡萄糖溶液杂质的效果
2.4 结晶制备超高纯度葡萄糖
实验测定了酶解葡萄糖溶液的质量分数、葡萄糖晶种的加入量和结晶时间对葡萄糖结晶效果的影响. 当酶解葡萄糖溶液的质量分数为60%时(图4A),结晶得到的葡萄糖纯度为97.6%,结晶回收率为56.3%. 随着葡萄糖浆质量分数的升高,结晶出的葡萄糖的纯度及回收率都有所增加,当葡萄糖质量分数为70%时,结晶得到的葡萄糖纯度为99.1%,回收率达到89.4%;当葡萄糖质量分数达到75%时,尽管结晶回收率提高至92.8%,但结晶出的葡萄糖纯度则下降到94.3%;当葡萄糖溶液的质量分数达到80%时,无法结晶出葡萄糖. 该结果表明,葡萄糖结晶的最佳糖质量分数为70%.
测定了葡萄糖晶种的加入量对其结晶效果的影响. 在晶种加入量为1%~5% 的范围内(图4B),随着晶种加入量的增加,结晶出的葡萄糖纯度和回收率没有显著的变化. 结晶出的葡萄糖纯度均达到99.0%,葡萄糖的回收率均为92.0%. 据此,确定在葡萄糖结晶时晶种的加入量为1%.
在12~96 h范围内(图4C),测定了结晶时间对葡萄糖结晶效果的影响. 当结晶时间为12 h时,结晶出的葡萄糖纯度为97.7%,葡萄糖的回收率为81.7%;随着结晶时间的延长,结晶出的葡萄糖纯度略有提高,回收率亦有显著的增加;当结晶时间为48 h时,得到的葡萄糖纯度为99.3%,糖的回收率达到91.1%;此后,继续延长结晶时间,结晶出的葡萄糖纯度和回收率均无显著变化. 因此,葡萄糖结晶的最佳时间为48 h.
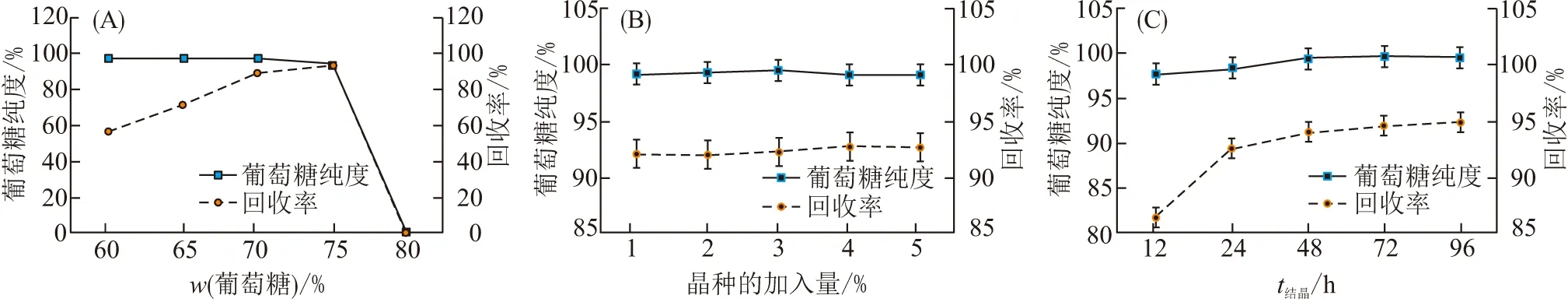
图4 葡萄糖结晶条件的优化
2.5 制备可溶性膳食纤维条件的优化
实验测定了纤维素酶加入量、溶液的pH值、加热温度和加热时间对制备高可溶性膳食纤维的影响(图5). 不加纤维素酶的样品中仅提取出2%的可溶性膳食纤维(图5A);随着纤维素酶加入量的增加,可溶性膳食纤维的得率增加;当纤维素酶加入量为150 U/g时,可溶性膳食纤维的得率达到7.1%;此后,再增加纤维素酶,可溶性膳食纤维的得率趋于不再增加. 因此,确定纤维素酶的最佳加入量为150 U/g.
测定了溶液的pH对可溶性膳食纤维含量的影响(图5B). 溶液的pH为4.0时,可溶性膳食纤维的得率为10%;随着溶液pH的升高,样品中可溶性膳食纤维的质量分数逐渐升高;pH为5.5时,可溶性膳食纤维的得率达到最高值20.5%;此后,继续升高pH,可溶性膳食纤维得率开始下降. 因此,确定溶液的最佳pH为5.5.
随着反应温度的升高,可溶性膳食纤维的得率先升高后降低(图5C). 当反应温度为40 ℃时,可溶性膳食纤维的得率达到最高的15.9%;此后,继续升高温度,可溶性膳食纤维的得率则逐渐降低. 因此,确定了酶解反应的最适温度为40 ℃.
随着酶解时间的延长,可溶性膳食纤维的得率逐渐增加(图5D),至180 min时,可溶性膳食纤维的得率达到最高的16.4%. 此后,继续延长酶解时间,可溶性膳食纤维的得率趋于稳定. 因此,确定酶解反应的最佳时间为180 min.

图5 可溶性膳食纤维制备条件的优化
实验确定利用水解后剩余的甘薯残渣酶解制备含可溶性膳食纤维的最佳条件为:甘薯残渣加入150 U/g的纤维素酶,在pH 5.5,反应温度40 ℃的条件下反应180 min,此时残渣中提取可溶性膳食纤维的得率由2%提高至20%.
3 讨论
甘薯是我国重要的农作物,产量占世界甘薯总产量的80%左右. 我国的甘薯约一半用于生产淀粉,每生产1 t的淀粉,约产生1.3 t的废弃甘薯渣. 甘薯渣中含有大量的淀粉、膳食纤维和少量的蛋白质,具有潜在的利用价值. 甘薯渣干质量中淀粉的质量分数平均约为40%,可用于制备糖类物质. 葡萄糖是能够直接被生物体吸收利用的一种糖类,是人体所需能量的主要来源. 葡萄糖在医药上不仅可以制成注射液,结晶葡萄糖还可以用来生产葡萄糖酸锌、葡萄糖酸钙等医用产品;在食品中是一种常用的食品添加剂. 膳食纤维是人体第七大营养素,在人体中发挥着重要的作用. 膳食纤维具有改善肠道菌群、降血压和降血脂等多种生理功能,膳食纤维在食品等方面有着广泛的应用.
孟悦等[16]以玉米粉为原料,通过高温酶解法进行液化,同时利用正交试验法对糖化工艺的各项参数进行了优化. 此时,经检测得到糖化液DE值为98.24%,DX值为98.16%. 吴允山等[17]以甘薯生产淀粉后的残渣为原料,加入耐高温α-淀粉酶、糖化酶以及纤维素酶对甘薯渣进行处理,然后分别对其进行保温和灭酶处理,对固液分离得到的溶液进行纯化,可以得到葡萄糖质量分数95%左右的糖浆. 最终得到的是葡萄糖浆,没有做进一步的纯化结晶,同时酶解制备葡萄糖后剩余的纤维素仍没有利用. 孙建等[19]利用超声波技术和纤维素酶共同处理甘薯渣,最终制备的样品中膳食纤维的得率为39.17%,其中可溶性膳食纤维的质量分数仅达到13.49%. 本研究仅利用耐高温的α-淀粉酶和糖化酶对甘薯渣中的淀粉进行完全水解,并将得到的葡萄糖溶液进行纯化结晶制备高纯度结晶葡萄糖. 对最终剩余的残渣检测发现,其中已经不含淀粉,表明甘薯渣中的淀粉完全水解. 剩余的物质仅含纤维素,可经过进一步的处理用于含可溶性膳食纤维较高的纤维素制品的开发. 本研究在制备高纯度结晶葡萄糖的同时,又对甘薯渣废弃资源进行深度的开发利用,既增加甘薯加工产业附加利润,又减少了甘薯加工生产过程中造成的资源浪费和环境污染.
4 结论
本研究建立和优化了甘薯渣酶解制备超高纯度结晶葡萄糖的方法和工艺. 新鲜甘薯渣加等量水混匀,先加入20 U/g的耐高温α-淀粉酶,在90 ℃下酶解液化60 min;然后加入300 U/g的糖化酶,60 ℃下酶解糖化6 h;甘薯渣中的淀粉可完全水解成葡萄糖,水解后的葡萄糖溶液加入1%的大孔树脂吸附除去杂质,将溶液的葡萄糖质量分数调节至70%,65 ℃加热30 min后,加入1%的葡萄糖晶种,在4 ℃结晶48 h;结晶出的葡萄糖用95%乙醇清洗微量残留杂质后,烘干,得到纯度为99.0%以上的医用级结晶葡萄糖;残渣加入150 U/g的纤维素酶,在pH 5.5、反应温度40 ℃的条件下反应180 min,残渣中提取可溶性膳食纤维的得率由2%提高至20%. 本研究为废弃甘薯渣的高效和高价值利用提供了可行的方案.

