分析干扰素、核苷酸类似物对慢性乙型肝炎患者外周血调节性T 细胞水平的影响
徐峰
CHB 是我国比较常见的肝脏疾病,抗病毒治疗是CHB 治疗的关键,核苷酸类似物以及干扰素都是当前我国使用的抗病毒治疗药物[1]。调节性T 细胞是一种诱导机体免疫耐受的T 细胞亚群,其对机体免疫反应具有抑制作用,这是一把双刃剑,一方面抑制免疫反应可减少过强的免疫反应引起的肝脏损伤从而保护肝脏,另一方面对人体通过免疫反应清除病毒不利,可引起病毒感染慢性化。而乙型肝炎病毒(HBV)由于基因组小、逆转录酶不能对错误的核苷酸进行修复等容易出现耐药病毒从而造成治疗效果降低,这对CHB 的治疗带来不利影响。本次研究主要探讨干扰素、核苷酸类似物对CHB 患者外周血调节性T 细胞水平的影响,为临床合理用药提供参考,报告如下。
1 资料与方法
1.1 一般资料 经本院伦理委员会批准后,纳入2018 年6 月~2020 年6 月 期间本院收治的CHB 患者40例,按照随机数字表法分为核苷组及干扰素组,每组20例。核苷组患者中男15例、女5例,年龄22~60 岁、平均年龄(32.56±9.84)岁;干扰素组患者中男16例、女4例,年龄20~60 岁、平均年龄(32.75±9.99)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者签署知情同意书后参与研究。纳入标准:①符合《慢性乙型肝炎防治指南(2019 年版)》[2]中关于CHB 的诊断标准;②18~60 岁,性别不限;③无治疗禁忌证;④参与研究前6 个月内未接受免疫调节或抗病毒治疗。排除标准:①合并脂肪肝、自身免疫性感染、其他类型肝炎;②合并艾滋病(AIDS);③妊娠、哺乳期妇女;④心脑血管、肝、肾、造血系统疾病;⑤精神疾病。
1.2 方法 给予所有患者保肝治疗,在此基础上,干扰素组患者给予重组人干扰素-α、聚乙二醇干扰素,聚乙二醇干扰素一般是两个剂型,135 μg/0.5 ml/支、180 μg/0.5 ml/支,1 支/周;核苷组给予核苷酸类似物,给予恩替卡韦500 mg,替诺福韦300 mg,替比夫定600 mg,阿德福韦酯10 mg,拉米夫定100 mg,均为1 片/次,1 次/d,口服。
1.3 观察指标 比较两组患者治疗前及治疗3、6、9、12 个月的调节性T 细胞水平。治疗前及治疗3、6、9、12 个月对患者随访,采集患者空腹静脉血2 ml,EDTA抗凝,将PE-CD127 抗体、FITC-CD25 抗体、PerCPCD 抗体加入试管中,将CD4、CD25 阴性对照剂加入阴性对照管中,混合均匀后35℃下保存15 min。试管中分别加入红细胞裂解液 2ml,混合均匀后35℃下保存10 min,1200 r/min 离心5 min 后去上清液,将PBS 液1 ml 分别加入试管中,对细胞进行洗涤,1200 rpm 离心5 min 后去上清液,每管中分别加入0.5 ml 磷酸缓冲盐溶液(PBS 液),制备呈悬液,采用流式细胞仪对调节性T 细胞进行检测,采用软件计算CD4+调节性T 细胞占比[3]。
1.4 统计学方法 采用SPSS23.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
治疗前及治疗后3 个月,两组CD4+调节性T 细胞水平比较,差异无统计学意义(P>0.05);治疗后6、9、12 个月,两组CD4+调节性T 细胞水平均低于治疗前,且干扰素组CD4+调节性T 细胞水平分别为(3.86±0.80)%、(3.28±1.01)%、(3.02±0.85)%,低于核苷组的(4.63±1.03)%、(4.46±0.93)%、(4.06±1.63)%,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗前后的CD4+ 调节性T 细胞比较(,%)
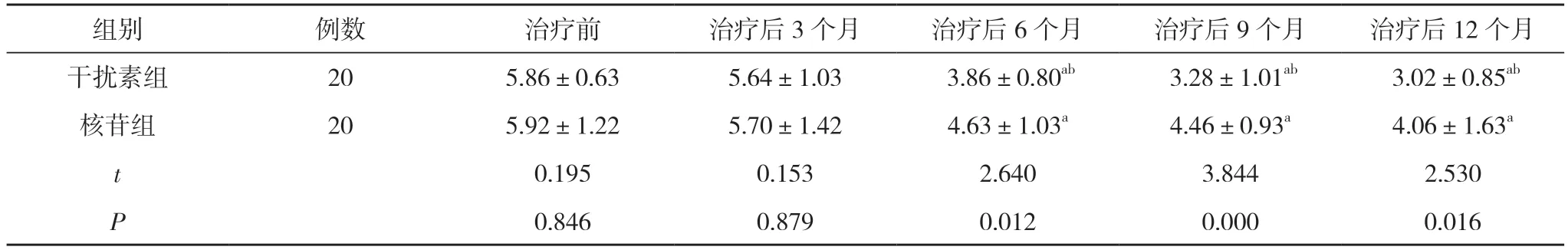
表1 两组治疗前后的CD4+ 调节性T 细胞比较(,%)
注:与本组治疗前比较,aP<0.05;与核苷组治疗后比较,bP<0.05
3 讨论
尽管当前乙型肝炎疫苗已经产生并应用30 年,但是HBV 慢性感染者的数量减少不明显反而逐渐增加,且慢性HBV 感染率降低不明显。坚持对CHB 患者进行抗病毒治疗,能持续抑制HBV 的复制,控制炎症从而控制肝炎进展,提高患者存活率。当前CHB 的治疗药物主要有2 类,分别为干扰素的两种剂型(聚乙二醇化、标准)以及核苷酸类似物(替诺福韦、阿德福韦、恩替卡韦、替比夫定、拉米夫定,共计5 种)[4]。前者可通过免疫调节、抗细胞增殖、抗肝脏纤维化以及抗病毒等机制来发挥治疗效果,但是治疗时程有限,且容易出现乙型肝炎e 抗原(HBeAg)血清转换,其应用不便且容易出现骨髓抑制、掉发以及发热等副反应,因此患者的用药依从性不高。后者对乙型肝炎病毒的脱氧核糖核酸(HBV-DNA)聚合酶的活性具有抑制作用,能够在短时间内降低患者的HBV-DNA 水平,相对而言更少出现副反应,用药也更加方便,因此更受到患者的欢迎。但是核苷酸类似物治疗CHB 患者需要长期坚持用药甚至终身用药,长时间用药的情况下患者会出现耐药性降低,且成本也会明显增加[5]。
耐药性的产生是CHB 治疗中必须重视的问题。HBV 基因组小,复制过程中基因组的变异概率较大,乙型肝炎病毒的逆转录酶不能对错误的核苷酸进行修复,因此随着治疗时间的延长,HBV 的选择适应性增强最终产生耐受病毒。核苷酸类似物非常容易引起HBV 出现耐药性,此类药物尽管抑制HBV 的复制机制不同,但是都是针对病毒的逆转录酶,不能彻底清除病毒,细胞外乙型肝炎病毒DNA(cccDNA)、乙型肝炎表面抗原(HBsAg)的减少幅度并不明显。HBV 逆转录聚合酶某些区域位点突变后可引起逆转录酶空间结构变化而造成拉夫米定失活[6]。调节性T 细胞属于异质性T 细胞,其各种免疫反应中均有所表达,其对适应性以及先天性免疫系统进行调节,从而发挥维持外周免疫耐受的作用、调节自身免疫性疾病的免疫力等作用。调节性T 细胞在维持静息状态下的外周耐受中具有重要作用,其对重建自身耐受以及抑制正在进行的免疫反应也非常重要。HBV 感染后并不直接破坏干细胞,而是激活细胞免疫系统介导肝脏损害,免疫系统激活后病毒自身也被清除。HBV 感染的结局取决于宿主的免疫反应,当免疫应答比较低时,患者产生慢性感染而连续损坏肝脏。CHB 中,调节性T 细胞对过度的免疫应答具有抑制作用,这能减少肝组织受到的损伤;除此之外其对宿主对病毒的免疫应答也具有抑制作用,这可引起宿主对病毒的清除受到影响,引起病毒慢性感染。当前研究认为调节性T 细胞水平与CHB 的慢性化病程存在密切关系,调节性T 细胞在抗病毒治疗的过程以及抗病毒治疗的预后中均具有重要作用。研究证实出现HBeAg 血清转换的应答者的调节性T 细胞相对频率较低。CD4+CD25high 调节性T 细胞被发现对Th 细胞反应以及HBV 特异性的细胞毒性T 淋巴细胞(CTL)反应具有抑制作用,这被认为是引起乙肝免疫耐受的原因之一。周观林等[7]发现,免疫清除期CHB患者的调节性T 细胞水平随着纤维化、炎症程度的增高而增高,该研究证实随着肝脏炎症的加剧,调节性T细胞可活化增殖对过强的免疫反应发挥抑制作用从而保护宿主,减少人体免疫反应造成的病理损伤。本次研究发现,治疗后6、9、12 个月,两组CD4+调节性T 细胞水平均低于治疗前,且干扰素组CD4+调节性T细胞水平分别为(3.860.80)%、(3.281.01)%、(3.020.85)%,低于核苷组的(4.631.03)%、(4.460.93)%、(4.061.63)%,差异有统计学意义(P<0.05)。提示干扰素、核苷酸类似物治疗CHB 都可以抑制肝脏的纤维化以及炎症,且干扰素相对于核苷酸类似物抑制纤维化、炎症的作用更加明显。由此推测干扰素治疗CHB 后期由于其具备免疫调节功能能进一步修复细胞的免疫功能[8]。
综上所述,给予CHB 患者有效的抗病毒治疗可抑制抗原生成以及病毒辅助,减少调节性T 细胞,恢复免疫应答。干扰素对CHB 患者外周血调节性T 细胞水平造成的影响大于核苷酸类似物,其远期免疫调节作用可能更强。

