构误教学策略在化学复习课中的实践
金水德

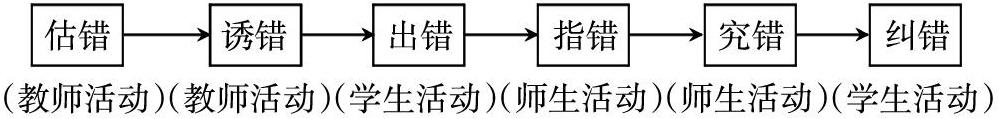

[摘 要] 构误教学是一种区别于传统教学逻辑的教学实施方法,教师以逆向思维的逻辑方式切入复习课的教学,在学生易错处设置“陷阱”,构建易错误的环节。带领学生发现错误并究错析错,实现自主纠错。提高了复习课中知识系统巩固的效率,增强学生的学习积极性和参与度,更好地完成教学目标。
[关 键 词] 错误;教学策略;复习课
[中图分类号] G712 [文献标志码] A [文章编号] 2096-0603(2021)12-0202-02
复习课是以系统知识的整合、提升和综合运用来进行设计的一种课型,需要教师注重知识的综合性,并且着眼于深化和提高。如何在新课改的理念指引下上好高中化学复习课,一直是一线教师探究的课题之一。在传统的化学复习教学中,老师往往采用正面教学,注重向学生介绍正确的方法、途径及实验操作步骤。教师讲解很细致,分析很透彻,但学生往往是“当时一听就懂,过后一做就错”。
因此围绕教学内容中的重难点,预估学生将会出现的错误,精心设计一些具有针对性的“错误陷阱”,诱使学生显现误区和薄弱环节。与学生共同剖析错因,纠正错误,以此加深对化学基础知识的理解和记忆,避免常见性错误的发生。因此,将构建错误法应用于化学复习教学中,可以大大提高复习课堂的实效性。
一、构误教学策略在复习课中的基本模式
下面以化学平衡常数K的复习为例阐明尝试构误教学策略的基本模式。
(一)传统复习法的教学设计
其中几个设问如下:
1.其中c代表什么?K值与反应物的起始浓度有无关系?若无关,与什么有关?
2.平衡常数与反应进行的程度有无关系?
3.给出K有关的综合题(如某年的高考题)让学生做,然后分析。
(二)构误教学策略在复习课中的实践
构误教学的基本模式是如下六步教学法。无论是新课教学还是复习课教学都可以运用构误教学法,以下是以此进行化学平衡常数复习的案例。
1.预先估错
在化学平衡常数教学时,根据以往的经验,学生对平衡常数K以下方面存在错误:
(1)固体物质的浓度是个常数,K表达式中不列入。设计成选项A(见下述的“2.引诱出错”,下同)。
(2)K中的浓度学生常错当成物质的量,即使知道是浓度,但认为浓度之比约了后就是物质的量之比。设计成选项B。
(3)K值与反应物的起始浓度无关系,只跟温度有关。设计成选项C和D。
(4)化学平衡和反应速率混淆。设计成选项E。
(5)K值与相应的化学方程式对应。设计成选项F。
2.引诱出错
教师要创设问题情境,设计错误“陷阱”,诱导学生出错。把化学平衡常数K以上五方面的易错点,即化学平衡常数K的重难点,分别设计成以下A~F的选项。
在300℃下,在容积为2L的容器中放入12g C和2mol H2O,进行
下列说法正确的是( )
A.K=c(CO)*c2(H2)/c(C)*c2(H2O)
B.K=0.4*0.82/1.22
C.若起始时加入2mol CO2、3mol H2,K值比原来的K大
D.温度升至400℃,K值增大
E.K值越大,表示速率越快
F.1/2C(s)+H2O(g)?葑1/2CO2(g)+H2(g),K值与原来的K相同
3.出错析错
教师必须尽可能地把学生的错误充分暴露出来,不留隐患。当学生出错时,教师不要急于说明正确答案,而是要给予学生自主纠错的机会和空间,让其认真思考、验算,教师则走到学生中,观察学生的答题情况。
4.究因纠错
留出一些时间让选错的思考自己错在哪儿。如:错选“A”的同学回答错因是方程式中“C”是固体没注意;错选“B”的同学回答错因是常数K公式中代表各物质的物质的量浓度,而不是物质的量,没除以体积;错选“E”的同学回答K值大小表示可逆反应的程度,而不是速度。
通过对上述易错点辨别和错因的探究,让学生自己将其他几个错误选项改成正确选项,并且让学生总结出平衡常数K的正确理解(即注意点)。例如:c为平衡浓度,固体、无机反应中的水不列入K式中;同一反应,K值与起始浓度无关。只与温度有关,吸热反应,T升,K增,放热反应,T升,K减,等等。
构误教学策略实施中,教师为学生挖好化学平衡常数K的N个“陷阱”,有意识地让学生进行“尝试错误”的活动,引发学生的认知冲突,促使学生主动地对化学平衡常数K的这几个错误进行反思,从而更加正确理解化学平衡常数K的这个概念,准确掌握化学平衡常数K。
此教学策略的核心步骤就是教师有针对性地挖好“陷阱”。那么,这个“陷阱”怎么挖?
二、復习课中错误陷阱的设计策略
要挖好复习课中的“陷阱”,首先要分析学生的错误,并以此原因为切入点,设置陷阱。从思维的角度看学生的错误,具体表现形式有:(1)求异思维弱,相似概念、相似物质不善于对比。(2)思维定式,不灵活,想当然。(3)审题不仔细,遗漏、忽视条件。(4)思维片面,以偏概全,公式和规律扩大化,盲目求同。
(一)创设相似情境,诱使思维定式
在教学中,我们发现学生常受思维定式的影响,面对新的问题情境,缺乏求异意识,喜欢生搬硬套、张冠李戴。因此,我们应该抓住学生常受干扰的那些思维定式的消极影响造成的错误,巧设陷阱,将问题情况和条件稍做变化,编拟一些“形似神异”的题目,让学生练习,从中发现错误、剖析错误,及时转向。
例1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5NA
B.500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),转移的电子为3NA
C.7.8g Na2S和Na2O2的混合物中含有的阴、阳离子总数是0.3 NA
D.常温常压下,7.8g苯含有0.6 NA的碳碳单键
A项的“定式”是体积与分子数互算时,注意常见的易错点标况和气态,没想到两者要反应;B项的“定式”是1个N2失6个电子,没考虑到反应是可逆的;D项利用质量和个数换算公式计算,没去想苯的结构的特殊性。
(二)增加和分散条件,促发审题不严等状况
当用一个条件解决一个问题时,学生出错率很低,多个条件解决一个问题,学生出错率就大大提高了,特别是文字比较多的题目,文字很長,读后忘前。因为好多同学审题不严、粗心大意,思维不够严密。针对这种普遍的典型错误,教师有意识地设置陷阱,增加已知条件,把条件加以分散,引导学生进行错解辨析,养成他们耐心细致的审题习惯。
例2.在无色透明酸性溶液中能大量共存的离子组是( )
A.Fe2+、Ag+、NO3-、Cl- B.Cu2+、NH4+、NO3-、Cl-
C.Ba2+、K+、ClO-、Cl-D.Zn2+、Na+、NO3-、SO42-
如果没注意题干的前置条件,无色和酸性,只注意选项中的四个离子,就会错选。通过此题的错误尝试,学生在解答离子共存问题时会自觉抓住以下几个要点:(1)颜色问题,要记住一些典型离子的颜色。(2)离子不能大量共存的几个主要原因,特别是溶液的酸碱性问题和氧化还原性问题是很容易出错的。
(三)设置隐含条件,诱使失察
有些同学由于洞察力不够强,思维敏锐性较弱,对那些已知条件明明是已给定的但比较隐蔽时,常常视若无睹。针对这种错因,教师在设计问题时故意将条件加以隐含,学生经过指错析错,才明白原来是自己审题不严所致。
例3.若以wl和w2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水小)( )
A.wl=w2 B.wl=2w2- C.wl
本题的“陷阱”在于氨水的密度与浓度关系的判断,一般认为,浓度越大,密度越大,然而,氨水的密度却是浓度越大密度越小。正因为条件给得较隐蔽,好多同学根本没看到。
(四)抽取前置条件,诱使盲目求同
化学公式和定律往往有前提条件的,如阿佛加得罗定律,这个规律的前提条件就是要在在同温同压下,而且适用对象是气体,离开了这两个前提,这个定律不成立,而学生做题时往往忘记了这点。
例4.等质量的O2和O3,下列说法正确的是( )
A.分子数之比1 ∶ 1 B.原子数之比1 ∶ 1
C.体积之比3 ∶ 2 D.密度之比2 ∶ 3
有些同学多选了C、D,就是掉入本题的陷阱,忽视了阿伏加德罗定律的前提条件“同温同压”。
化学中一些规律和方法的使用有时具有反例,而有些同学思考问题比较片面,无限求同。因此,针对这种错因,教师故意抽取前置条件,挖掘陷阱,故意把某公式、定律、规律扩大化。通过构误教学,提高学生警惕性。
通过一系列的教学实践,我们不难发现:在复习课中讲解相关知识点之前,教师通过精心设置的错误“陷阱”,可以促使学生尝试“错误”,发现错误,探究原因,自己想明白自己错在哪儿,增强错误的免疫力。同时,学生在纠错中更好地巩固了知识点,提高了解题能力。在“误中悟”,极大地提高了化学复习课中知识系统巩固的效率,也通过增强学生的学习积极性和参与度,更好地完成了复习课的教学目标,起到了明显的效果。
参考文献:
[1]舒玉红.尝试错误教学法在化学教学中的应用[J].渭南师范学院学报,2004年增刊(增总第11期).
[2]胡永萍.桑代克教育心理学思想述评[J].江西教育学院学报,1997(CS):5658.
编辑 栗国花

