有柄石韦不同部位有效成分及抗氧化活性的比较分析
吴飘 宁珊 张凤媛 黄荣韶 李良波 姜学松
摘 要:以有柄石韦(Pyrrosia petiolosa)为材料,制备有柄石韦叶柄、营养叶、孢子葉、孢子囊和去孢子叶5个部位的70%乙醇提取物和水提取物,测定其绿原酸(Chl)、芒果苷(Man)、咖啡酸(Caf)、芦丁(Rut)、总黄酮(TF)和总酚(TP)的含量以及抗氧化活性。结果表明:有柄石韦不同部位有效成分含量和抗氧化活性均有显著性差异(P < 0.05);去孢子叶的总黄酮和总酚含量最高,分别为(129.46 ± 4.03)mg/g和(47.85 ± 2.98)mg/g,与营养叶的含量相似;有柄石韦各部位醇提物的抗氧化活性均高于水提物;各部位抗氧化活性强弱顺序为:营养叶>去孢子叶>孢子叶>叶柄>孢子囊;去孢子叶和营养叶的绿原酸和芦丁含量较高;营养叶的芒果苷和咖啡酸含量最高,显著高于其他4个部位(P < 0.05);有柄石韦不同部位的ABTS+自由基清除能力、DPPH自由基清除能力及总抗氧化能力均与其有效成分含量呈正相关(r = 0.69~0.98)。综合分析得知,有柄石韦营养叶的有效成分较多,具有较强的抗氧化活性,本研究结果可为石韦药材的开发利用提供科学依据。
关键词:有柄石韦;总黄酮;总酚;抗氧化活性
中图分类号:R284.1 文献标识码:A
Comparative Analysis of the Active Component and Antioxidant Activity of Different Parts of Pyrrosia petiolosa
WU Piao1, NING Shan1, ZHANG Fengyuan1, HUANG Rongshao1,2*, LI Liangbo1,2*, JIANG Xuesong3
1. College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China; 2. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning, Guangxi 530200, China; 3. Jiangxi Hongxing Pharmaceutical Co., Ltd, Fuzhou, Jiangxi 331800, China
Abstract: The 70% ethanol extraction and water extraction solution were prepared from petioles, trophophylls, sporophylls, sporangia and sporophylls without sporangia of Pyrrosia petiolosa. The active ingredients and antioxidant activity in the extraction , including chlorogenic acid (Chl), mangiferin (Man), caffeic acid (Caf), rutin (Rut), total flavonoids (TF), total phenols (TP) were assayed. There were significant differences among the five parts for active ingredients and antioxidant activity (P<0.05). TF and TP in sporophylls without sporangia were the highest, (129.46±4.03)mg/g and (47.85±2.98)mg/g respectively, which was similar to trophophylls. The antioxidant activity of ethanol extraction was higher than that of water extraction in each part. The antioxidant activity of each part was trophophylls > sporophylls without sporangia > sporophylls > petiole > sporangia. Chl and Rut in sporophylls without sporangia and trophophylls were higher. Man and Caf acid in trophophylls were the highest, which was significantly higher than that of the other four parts (P<0.05). Besides, the ABTS+ free radical scavenging capacity, DPPH free radical scavenging abilities and total antioxidant capacity of different parts of P. petiolosa were positively correlated with active components (r=0.69~0.98). According to the comprehensive analysis, trophophylls had more effective components and stronger antioxidant activity. The study could provide scientific basis for the development and utilization of Pyrrosia.
Keywords: Pyrrosia petiolosa; total flavonoids; total phenols; antioxidant activity
DOI: 10.3969/j.issn.1000-2561.2021.07.033
自由基对人体健康影响极大,可损害机体的组织和细胞,引起衰老,诱发癌症、动脉粥样硬化等多种疾病[1]。凡能够干扰自由基连锁反应的引发或扩散过程、抑制自由基反应过程的任何一种物质,均称为自由基清除剂或抗氧化剂[2]。抗氧化剂可以修复自由基导致的重要生物大分子损伤,适当补充外源性抗氧化剂可以平衡体内自由基,预防疾病[3]。因此,人们开始在自然资源中寻找有效的抗氧化剂。蕨类植物有丰富的生物活性成分,如黄酮类、多酚、萜类和生物碱等,黄酮类和多酚广泛存在于植物的各个部位,具有较强的抗氧化性[4]。
石韦首载于《神农本草经》,为庐山石韦、石韦或有柄石韦的干燥叶,主要化学成分为多糖、黄酮类、三萜类、挥发油类和多酚类等,其药理作用包括利尿通淋、清肺止咳、凉血止血等,临床主要用于治疗肾炎、肺热喘咳和止血等[5-6]。有柄石韦[Pyrrosia petiolosa (Christ) Ching],为石韦属多年生草本植物,其总黄酮和多酚类含量较为丰富,主要活性成分有芦丁、芒果苷、绿原酸、咖啡酸等,药用价值较高[7-8]。在水质偏硬的地区,泌尿系统结石病较为常见,有柄石韦为治疗该疾病的常用民族药,是“结石通片”和“复方石韦片”等中成药的主要原料[9]。有柄石韦以整个干燥叶入药,包括了叶柄、营养叶、孢子叶、孢子囊等组织部位。目前国内外对于石韦的研究主要集中在石韦属的种质差异、化学成分和药理活性等方面,但叶片不同组织部位的成分差异及活性等研究尚未见报道[10-13]。本文对有柄石韦叶柄、营养叶、孢子叶、孢子囊和去孢子叶等5个组织部位的有效成分含量和抗氧化活性进行研究,并分析了其相关性,旨在为石韦药材的开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 有柄石韦采自贵州省安顺市(10541 N, 262 E),经广西中医药大学黄荣韶教授鉴定。
1.1.2 主要試剂 植物类黄酮试剂盒(货号:G0118W 微板法96样)、植物总酚试剂盒(货号:G0117W 微板法96样)、DPPH自由基清除能力试剂盒(货号:G0128W 微板法96样)、ABTS自由基清除能力试剂盒(货号:G0127W 微板法96样)、总抗氧化能力(FRAP法)试剂盒(货号:G0115W 微板法96样)均购自苏州格锐思生物科技有限公司;绿原酸、咖啡酸、芒果苷、芦丁标准品均购自北京索莱宝科技有限公司;甲醇、无水乙醇、磷酸等试剂为分析纯;甲醇、乙腈为色谱纯;水为超纯水。
1.1.3 仪器与设备 E2695高效液相色谱仪(美国Waters公司)、1530酶标仪(美国赛默飞世尔科技公司)、3K15高速冷冻离心机(德国Sigma公司)、BSA224S-CW电子分析天平(德国Sartorius公司)、KQ-500DE数控超声波清洗器(昆山市超声仪器有限公司)、HH-6数显恒温水浴锅(常州市金坛友联仪器研究所)、Helzbad Hei-VAP旋转蒸发仪(德国Heidolph公司)、7310039离心浓缩冻干机(美国Labconco公司)。
1.2 方法
1.2.1 有柄石韦不同部位醇提物和水提物的制备 提取物制备参考Hee等[14]的方法,将有柄石韦样品分成5个部位:叶柄、营养叶、孢子叶、孢子囊和去孢子叶(刮去孢子囊的孢子叶)。材料干燥、粉碎,过40目筛,分别称取2份约2 g粉末,其中一份在室温下、70%乙醇、料液比为1 : 20(g/mL)条件下,浸泡48 h提取,得叶柄醇提物(YE)、营养叶醇提物(PE)、孢子叶醇提物(SE)、孢子囊醇提物(FE)和去孢子叶醇提物(QE);另一份在90 ℃热水、料液比为1 : 20条件下,浸泡4 h提取,得叶柄水提物(YH)、营养叶水提物(PH)、孢子叶水提物(SH)、孢子囊水提物(FH)和去孢子叶水提物(QH)。提取液超声45 min,9000 r/min离心5 min过滤,滤渣加溶剂清洗3次,整合提取液,40 ℃浓缩,离心浓缩冻干机干燥,重复3次,干样称重计算提取率,?20 ℃储存。
1.2.2 总黄酮含量的测定 总黄酮含量采用NaNO2-Al (NO3)3-NaOH显色法[15],按照试剂盒说明书方法进行测定。取50 ?L提取液(0.5 mg/mL)于96孔板中,加入15 ?L NaNO2溶液混匀,放置6 min后加入30 ?L Al(NO3)3溶液摇匀,放置6 min后加入105 ?L氢氧化钠溶液混匀,25 ℃静置15 min,采用酶标仪测定510 nm处吸光值,以空白试剂为参比。使用芦丁标准溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL)按照前面描述的程序制备标准曲线。标准曲线方程为:y=1.0843x ? 0.0158,R2 = 0.9991。结果以芦丁当量表示(mg/g)。
1.2.3 总酚含量的测定 采用福林酚法测定总酚含量[16],按照试剂盒说明书的方法进行测定。移取10 ?L提取液(0.5 mg/mL)于96孔板中,加入50 ?L Folin-Ciocalteu 试剂混匀,25 ℃避光静置2 min,加入50 ?L碳酸钠溶液和90 ?L蒸馏水混匀,室温下避光30 min,于760 nm处测定吸光值,以空白试剂为参比。使用没食子酸标准溶液(0、5、10、15、20、25 ?g/mL)按照前面描述的程序制备标准曲线。标准曲线方程为:y = 2.2843x + 0.004,R2 =0.9987。结果以没食子酸当量表示(mg/g)。
1.2.4 DPPH自由基清除能力的测定 按照试剂盒说明书的方法测定DPPH自由基清除能力,DPPH测定液现配现用。于试管中加150 ?L提取液(0.1 mg/mL)和150 ?L DPPH测定液,摇匀后25 ℃避光静置30 min,12 000 r/min室温离心5 min,取200 ?L至96孔板中,以无水乙醇为空白对照,使用酶标仪在517 nm处测定吸光度,再扣除样品溶液的吸光值。
式中,A0为空白对照组的吸光值;A1为样品溶液加测定液的吸光值;A2为样品溶液的吸光值。
1.2.5 ABTS+自由基清除能力的测定 按照试剂盒说明书的方法测定ABTS+自由基清除能力,ABTS+测定液现配现用。于96孔板中加入10 ?L提取液(0.5 mg/mL)和190 ?L ABTS+测定液,混匀后于25 ℃避光静置30 min,以无水乙醇为空白对照,使用酶标仪在734 nm处测定吸光值,再扣除样品溶液的吸光度。
式中,A0为空白对照组的吸光值;A1为样品溶液加测定液的吸光值;A2为样品溶液的吸光值。
1.2.6 总抗氧化能力的测定(FRAP法) 按照试剂盒说明书的方法测定总抗氧化能力,FRAP显色液现配现用。在无色96孔板中加入5 μL提取液(2.5 mg/mL),再加入25 μL提取溶剂,最后加入170 μL FRAP显色液混匀,室温条件下避光反应5 min,使用酶标仪在590 nm处测定吸光值。使用Trolox标准溶液(0、0.4、1.2、2.0、2.8、3.6 ?mol/mL)按照前面描述的程序制备标准曲线。标准曲线方程为:y = 0.073x ? 0.0514,R2=0.9909。结果以等量的水溶性维生素E表示(?mol/mL)。
1.2.7 有柄石韦不同部位4种有效成分含量的测定 4种有效成分含量的测定参考《中华人民共和国药典》[17],略改进。色谱条件:色谱柱为XBridge C18(4.6 mm×250 mm,5 μm),检测波长为300 nm,柱温25 ℃,流速1.0 mL/min,乙腈(A)?0.1%磷酸溶液(B)梯度洗脱。洗脱程序:0~5 min,10%~15% A;5~10 min,15%~16% A;10~16 min,16%~19% A;16~21 min,19%~26% A;21~26 min,26%~28% A。
對照品溶液的制备:取绿原酸、芒果苷、咖啡酸和芦丁对照品,分别用50%甲醇溶解成0.5 mg/mL的对照品溶液,过0.22 μm滤膜,备用。
供试品溶液的制备:5种样品在50 ℃烘干、粉碎,过40目筛,称取样品粉末0.2 g,加50%甲醇25 mL,超声45 min,过滤,用50%甲醇定容至25 mL,得到叶柄(YM)、营养叶(PM)、孢子叶(SM)、孢子囊(FM)和去孢子叶提取液(QM),过0.22 μm滤膜,备用。
方法学考察参考贾富娟等[18]并稍作改动。线性关系:分别取绿原酸、芒果苷、咖啡酸和芦丁对照品溶液混匀,得5种不同浓度的混合溶液,各取10 μL,注入高效液相色谱仪,平行进样3次,作线性回归方程。精密度实验:取混合对照品溶液重复进样6次,每次进样10 μL,测定各个对照品的峰面积,结果显示绿原酸、芒果苷、咖啡酸以及芦丁峰面积的相对标准偏差(RSD)分别为0.92%、1.09%、0.71%、1.67%,表明仪器精密度良好。稳定性实验:取混合对照品溶液,按色谱条件分别在0、2、4、8、16、24 h进样,最终测得绿原酸、芒果苷、咖啡酸和芦丁峰面积的RSD分别为2.27%、2.14%、1.07%、1.48%,表明该方法的稳定性良好。加样回收率实验:精密称取营养叶样品3份制得供试品溶液,加入绿原酸、芒果苷、咖啡酸和芦丁对照品适量,以50%甲醇定容至25 mL。按色谱条件测定,计算加样回收率,测得绿原酸、芒果苷、咖啡酸和芦丁峰的回收率分别为101.20%,100.74%、99.52%、98.03%;RSD分别为1.24%、1.48%、0.92%、2.15%。
按照色谱条件测定供试品溶液中4种指标成分的含量。
1.3 数据处理
每组实验均重复3次,结果以平均值±标准差表示,采用SPSS 23.0软件进行数据处理,数据平均值之间的差异通过单向方差分析(ANOVA)和邓肯多重比较检验进行评估,相关性分析采用Pearson法进行组分与活性的关联。
2 结果与分析
2.1 有柄石韦不同部位的提取率
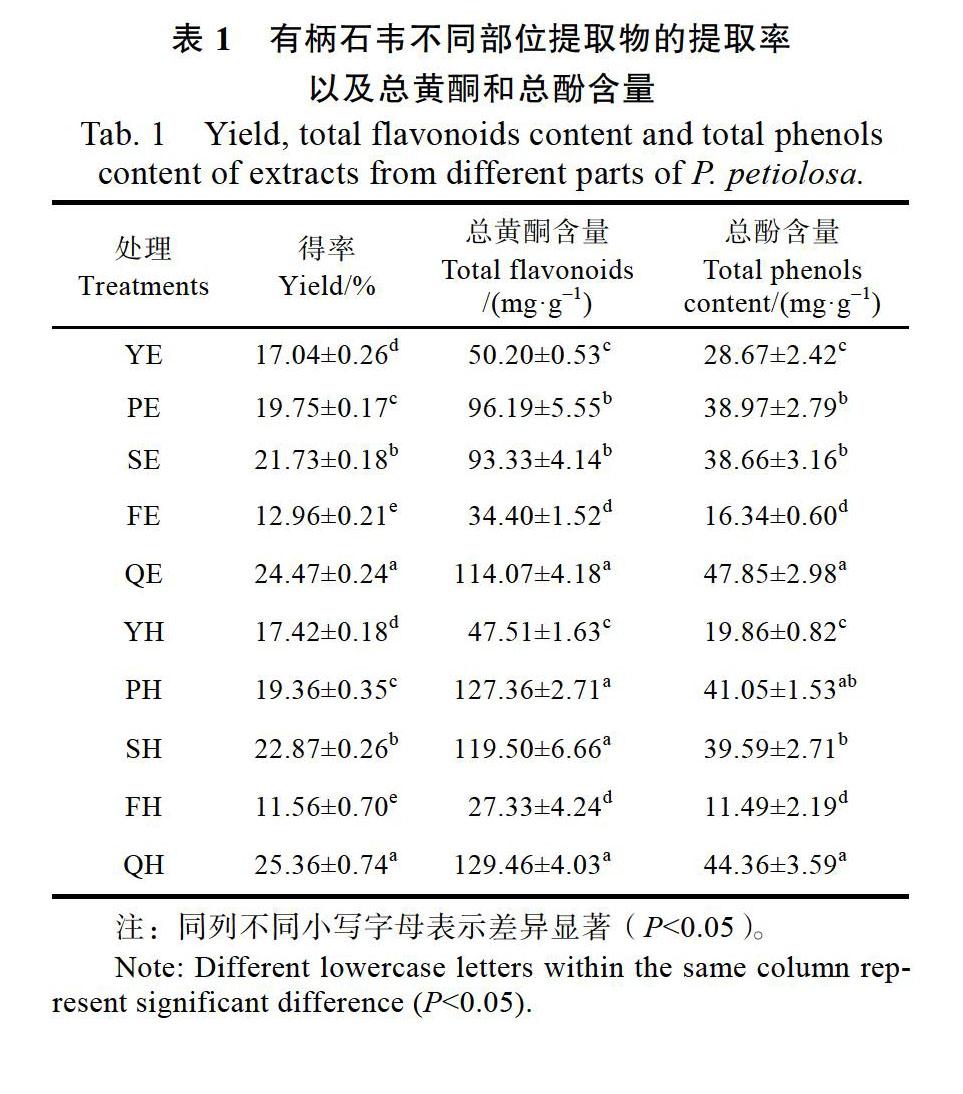
有柄石韦不同部位的提取率大小不同。由表1可以看出,去孢子叶水提物和醇提物的提取率最高,显著高于其他部位;其次是孢子叶,SH和SE显著高于PH和PE,孢子囊的提取率最低,FE和FH之间差异不显著。有柄石韦中不同部位的醇提取率和水提取率大小排列相同,均为去孢子叶>孢子叶>营养叶>叶柄>孢子囊。
2.2 有柄石韦不同部位总黄酮和总酚含量
由表1可知,有柄石韦不同部位的总黄酮和总酚含量差异较大。总黄酮含量较高的是QH、PH、SH和QE,显著高于其他提取液样品,FH的总黄酮含量最低,约为QH的1/5。总酚含量最高的是QE和QH,与PH的差异未达到显著性水平,但显著高于其他提取物;其次是PE、PH、SE、和SH,均显著高于YE和YH;FE和FH的总酚含量最低,约为QE的1/3。
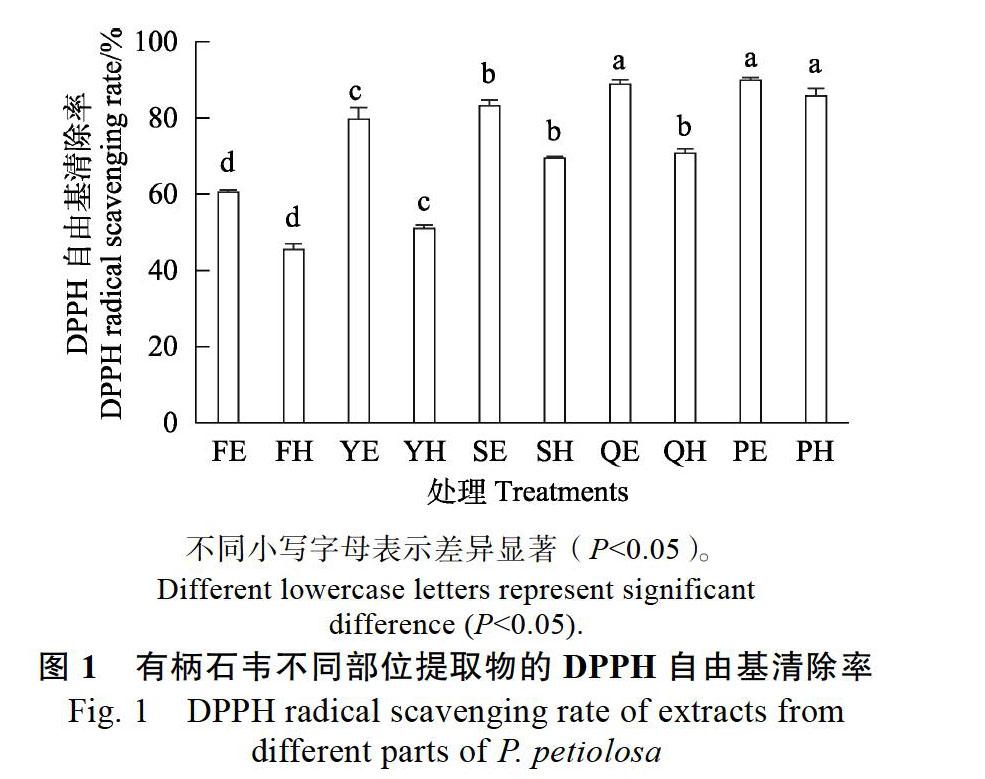
2.3 有柄石韦不同部位DPPH自由基清除能力
有柄石韦不同部位有不同程度的清除 DPPH 自由基的能力。如图1所示,在不同部位的醇提物中PE和QE的DPPH自由基清除率较高,均高于88%,显著高于SE、YE和FE;各部位水提物中PH的清除率最大,为85.86%,其次是QH和SH,显著高于YH和FH,FH的清除率最低。
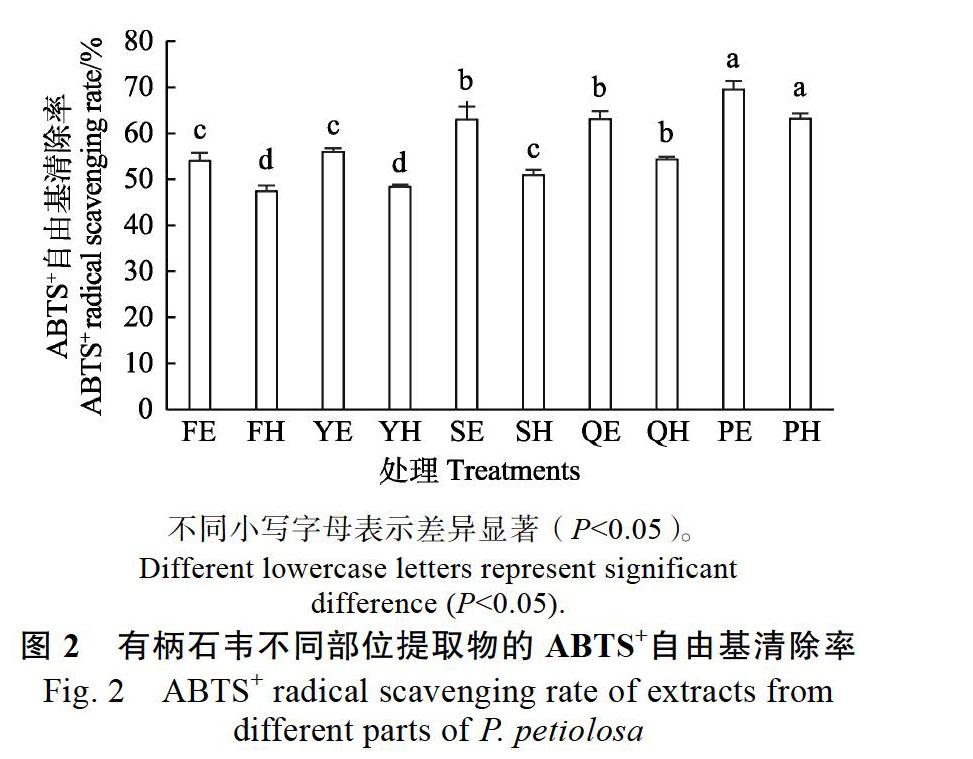
2.4 有柄石韦不同部位ABTS+自由基清除能力
由图2可知,在醇提物中,PE的清除率最高,为69.44%,显著高于SE、YE和FE,YE和FE的差异不显著。在水提物中,分析结果与醇提物一致,FH对ABTS+自由基的清除率最低,仅为47.37%;不同部位提取物对ABTS+自由基能力强弱与DPPH分析结果高度相似。
2.5 有柄石韦不同部位总抗氧化能力(FRAP法)
总抗氧化能力的测定结果见图3,有柄石韦不同部位提取物总抗氧化能力强弱不同。在不同部位的醇提物中,总抗氧化能力最高的是PE,为(3.12±0.15)?mol/mL,与QE差异不显著,但显著高于SE、YE和FE;在水提物中,最高的是PH,为(2.58±0.06)?mol/mL,各部位之间的总抗氧化能力的差异均达到显著性水平,强弱排序为:PH>QH>SH>YH>FH。
2.6 有柄石韦不同部位4种有效成分的含量
绿原酸、芒果苷、咖啡酸和芦丁的线性回归方程见表2,测定结果如表3和图4所示,4种有效成分在有柄石韦营养叶、孢子叶和去孢子叶中都有被检测到。去孢子叶和营养叶的绿原酸含量含量分別为(7.37±1.22)、(6.94±0.23)mg/g,显著高于孢子叶、叶柄和孢子囊;咖啡酸在叶柄和孢子囊中未检测到,营养叶中的咖啡酸含量高于去孢子叶和孢子叶,孢子叶中的咖啡酸含量仅为营养叶的1/5;芦丁在孢子囊中未检出,营养叶和去孢子叶的芦丁含量相近,是叶柄含量的3倍。
2.7 有柄石韦不同部位有效成分与抗氧化活性的相关性分析
总黄酮和酚类化合物对抗氧化活性有很大影响。如表4所示,分析有柄石韦不同部位的4种成分和抗氧化活性的每个参数之间都显示出良好的相关性,TF、TP、绿原酸、芒果苷、咖啡酸以及芦丁的含量都与DPPH和ABTS+自由基清除活性呈极显著相关(P<0.01),与总抗氧化能力显著相关(P<0.05)。
3 讨论
本研究结果表明,有柄石韦不同部位的提取成分含量不同,提取率在11.56%~25.36%之间。不同部位的醇提取率和水提取率大小排序相同,均为:去孢子叶>孢子叶>营养叶>叶柄>孢子囊。有柄石韦各部位均含有总黄酮和总酚,总黄酮含量在27.33~ 129.46 mg/g之间,Cao等[19]的研究中有柄石韦总黄酮含量(80.6 mg/g)仅次于肉质伏石蕨(125.9 mg/g);总酚含量在11.49~47.85 mg/g之间,表明有柄石韦中的总黄酮和总酚物质含量丰富。种贝贝[20]研究中有柄石韦醇提总黄酮含量是水提物的5.61倍,本研究与之不同的是去孢子叶、营养叶和孢子叶的水提物中的总黄酮含量高于醇提物,叶柄和孢子囊水提物的总黄酮含量则低于醇提物。有柄石韦去孢子叶、营养叶和孢子叶的水提物以及去孢子叶的醇提物中的总黄酮含量较高,总酚含量较高的是去孢子叶的醇提物和水提物以及营养叶的水提物,总黄酮和总酚含量最低的是孢子囊的醇提物和水提物。而营养叶和孢子叶提取物的总黄酮和总酚含量差异均未达到显著性水平,孢子叶的提取率却大于营养叶,可能是孢子叶提取物中含有其他成分,陈超君等[21]研究发现石韦属的石韦植物中孢子叶的总皂苷含量高于营养叶。
在抗氧化活性测定试验中,营养叶的抗氧化效果最好,营养叶水提物的自由基清除效果和总抗氧化能力均显著高于其他部位的水提物,营养叶醇提物的抗氧化活性也显著高于孢子叶、叶柄和孢子囊。唐雅楠等[22]研究发现75%乙醇洗脱获得的样品中的抗氧化活性比水强。本研究中有柄石韦各部位醇提物的抗氧化能力普遍强于水提物,说明有柄石韦中抗氧化物质种类复杂,70%乙醇提取的物质抗氧化活性较强。这可能是醇提物中抗氧化物质会在一定的抗氧化体系中产生协同作用,使得其抗氧化活性更高[23]。
石韦属植物含有多种植物化学物质,有柄石韦中常见绿原酸、芒果苷、咖啡酸和芦丁等有效成分[24]。本研究中,绿原酸、芒果苷和芦丁在去孢子叶和营养叶的含量明显较高,石韦药材中的绿原酸作为药典[19]指定指标成分,去孢子叶和营养叶的绿原酸含量高达7 mg/g,孢子囊最少,仅为1.76 mg/g,营养叶的绿原酸含量比孢子叶高1.93 mg/g;而咖啡酸在叶柄和孢子囊中未检测到,营养叶的咖啡酸含量高于去孢子叶和孢子叶,孢子叶的咖啡酸含量仅为营养叶的1/5;营养叶的芦丁含量比孢子叶高6.25 mg/g,是叶柄的3倍。
有柄石韦不同部位的总黄酮、总酚含量与抗氧化活性呈显著正相关,与庄远杯等[25]的研究结果相同,说明总酚和黄酮类物质是其具有抗氧化活性的主要作用成分。绿原酸、芒果苷、咖啡酸、芦丁也与DPPH、ABTS+自由基清除能力及总抗氧化能力呈显著正相关,4种指标物质在其抗氧化活性中发挥了重要作用。
综上可知,有柄石韦去孢子叶和营养叶的总黄酮和总酚以及4种指标物质的含量较孢子叶、叶柄和孢子囊高,营养叶的抗氧化能力强于其他4个部位,且有柄石韦不同部位清除ABTS+自由基清除能力、DPPH自由基清除能力及总抗氧化能力均与其有效成分含量呈显著正相关(P< 0.05)。有柄石韦的孢子囊和叶柄的有效成分含量较低,相对孢子叶,营养叶具有较多的有效成分和更强的抗氧化能力,质量更佳。此外,关于石韦植物叶片不同组织部位的成分差异及活性等研究极少,今后可对其进行深入考察,以期为石韦药材的开发利用提供科学依据。
参考文献
[1] Niki E. Assessment of antioxidant capacity in vitro and in vivo[J]. Free Radical Biology and Medicine, 2010, 49(4): 503-515.
[2] 吴英详, 余雪芳, 詹兴堆, 等. 千层金叶片醇提物抗氧化活性的研究[J]. 热带作物学报, 2019, 40(7): 1367-1372.
[3] 方允中, 杨 胜, 伍国耀. 自由基、抗氧化剂、营养素与健康的关系[J]. 营养学报, 2003, 25(4): 337-343.
[4] Xia X, Cao J G, Cao Y G, et al. Flavonoids contents and bioactivities of 19 species of ferns from China[J]. Industrial Crops & Products, 2014, 58: 91-98.
[5] Cheng D D, Zhang Y Y, Gao D M, et al. Antibacterial and anti-inflammatory activities of extract and fractions from Pyrrosia petiolosa (Christ et Bar.) Ching[J]. Journal of Ethnopharmacology, 2014, 155: 1300-1305.
[6] 赖海标, 梅全喜, 范文昌. 石韦的化学成分、药理作用和临床应用研究进展[J]. 中国医药导报, 2010, 7(21): 9-11.
[7] 李春磊, 韦 悦, 高德民, 等. 不同产地有柄石韦总多糖含量的分析[J]. 中国野生植物资源, 2013, 32(4): 29-30.
[8] 亓 雪, 李 兰, 张颖颖. 有柄石韦的化学及药理研究进展[J]. 山东化工, 2018, 47(16): 64-65, 68.
[9] 陈 飞, 罗国勇, 杨武德, 等. 黔产有柄石韦利尿通淋有效部位化学成分研究[J]. 中药材, 2019, 42(12): 2822-2826.
[10] Hsu C Y. Antioxidant activity of Pyrrosia petiolosa[J]. Fitoterapia, 2008, 79(1): 64-66.
[11] 丁文慧, 种贝贝, 邵 尉, 等. 有柄石韦醇提物抗氧化活性研究[J]. 亚热带植物科学, 2016, 45(1): 13-16.
[12] 李 娜, 种贝贝, 辛晓伟, 等. 石韦、庐山石韦和毡毛石韦不同浸提物的红外光谱特征比较分析[J]. 中国野生植物资源, 2016, 35(2): 34-36.
[13] 李雁群, 黎颖菁, 黎 桦, 等. 广西石韦属七种植物叶片结构与孢子形态的比较研究[J]. 广西植物, 2010, 30(4): 462-470.
[14] Hee C K, Ju Y L, Mi G J, et al. Seasonal variations in the phenolic compounds and antioxidant activity of Sasa quelpaertensis[J]. Industrial Crops & Products, 2018, 122: 506-512.
[15] 陈丛瑾, 黄克瀛, 李德良, 等. NaNO2-Al(NO3)3显色分光光度法测定香椿叶总黄酮的含量[J]. 食品研究与开发, 2007, 28(5): 104-107.
[16] Wang Z H, Wang C Z, Zhang C W, et al. Ultrasound- assi-sted enzyme catalyzed hydrolysis of olive waste and recovery of antioxidant phenolic compounds[J]. Innovative Food Science & Emerging Technologies, 2017, 44: 224-234.
[17] 國家药典委员会. 中华人民共和国药典: 一部[S]. 北京: 中国医药科技出版社, 2015: 90.
[18] 贾富娟, 崔露露, 张颖颖, 等. HPLC测定不同品种石韦中绿原酸、芒果苷、咖啡酸、芦丁含量[J]. 食品与药品, 2017, 19(3): 187-189.
[19] Cao Y G, Zheng Y X, Xia X, et al. Total flavonoid contents, antioxidant potential and acetylcholinesterase inhibition activity of the extracts from 15 ferns in China[J]. Industrial Crops & Products, 2015, 75: 135-140.
[20] 种贝贝. 石韦药材及其替代品的生药学比较与抗氧化抗病毒活性研究[D]. 济南: 山东中医药大学, 2017.
[21] 陈超君, 尹小红, 黄 敏, 等. 石韦孢子叶和营养叶中活性成分含量分析[J]. 广西植物, 2010, 30(1): 133-136.
[22] 唐雅楠, 曹雪原, 邵 尉, 等. 中药石韦中黄酮类化合物的含量及抗氧化活性研究[J]. 山东化工, 2018, 47(8): 30-31, 33.
[23] 张志清, 向建军, 周利茗, 等. 麦苗中阿魏酸、抗坏血酸(VC)、总黄酮协同抗氧化能力分析[J]. 中国粮油学报, 2013, 28(7): 5-11, 18.
[24] 邵 尉, 高德民. HPLC 法同时测定有柄石韦中6种有效成分的含量[J]. 山东科学, 2017, 30(3): 21-25.
[25] 庄远杯, 凌梅娣, 詹佳虹, 等. 石韦提取物抗氧化及抑制亚硝化作用研究[J]. 天然产物研究与开发, 2020, 32(4): 681-688.
责任编辑:崔丽虹

