关节镜下射频松解治疗臀肌挛缩的临床疗效*
曾亚兰 肖世卓 郑秋 汪武祥 杨洪彬
(西南医科大学附属医院骨与关节外科,四川 泸州 646000)
臀肌挛缩症(Gluteal Muscle Contracture,GMC)是由多种原因引起臀部肌肉及周围筋膜纤维变性导致一系列特殊体征的临床综合征,国内臀肌挛缩与幼年时期反复肌肉注射以苯甲醇为溶煤的青霉素有关,表现为髋关节屈曲、内收功能受限出现不同程度的异常步态[1]。随着年龄增长,病理改变及严重程度不断增加,可出现双下肢不等长、骨盆倾斜、代偿性脊柱侧弯,严重时可出现双侧髋关节脱位[2]。保守治疗效果欠佳,一般通过手术彻底松解挛缩的肌肉及增生的纤维束达到治疗效果;传统的开放式手术存在剥离范围广,伤口感染风险高,术后易形成血肿及瘢痕组织形成等不足[3]。随着关节镜微创技术的发展,关节镜下利用射频松解挛缩带已经逐渐替代传统手术。本研究采用在关节镜下射频松解治疗臀肌挛缩,并对疗效进行分析。
1 资料与方法
1.1 一般资料 选取2015年6月~2018年12月我院收治的12例关节镜下治疗臀肌挛缩患者为研究对象,据刘玉杰分型[4],其中条索型6例,扇型3例,混合型2例和阔筋膜张肌挛缩型1例;男性4例,女性8例;单侧臀肌挛缩4例,双侧臀肌挛缩8例;年龄14~26岁,平均20岁;平均随访(17±4.97)个月。其中10例有明确的反复臀部肌肉注射史,2例无明确的臀部注射史;术前查体均有不同程度的步态异常,“交叉腿”试验阳性,Ober’s试验阳性等。
1.2 治疗方法 患者侧卧位,术前常规对股骨大转子、臀肌挛缩带、坐骨神经走行及手术入口进行标注;进行消毒、铺无菌单(若是双侧臀肌挛缩,则分别消毒),连接关节镜设备,术中使用30°的膝关节镜。在挛缩带上下两端分别约4 mm的手术入口,切口方向与挛缩带方向一致,沿臀肌挛缩带表面与皮下筋膜层之间钝性分离出约5 cm×5 cm的工作腔隙,以增加手术视野,生理盐水充盈。利用刨削清理脂肪组织,由浅入深逐层切开髂胫束及大转子周围臀肌挛缩带,避免过多地破坏正常肌肉组织。术中射频松解挛缩带的同时进行髋关节被动屈曲、内收、内旋松解活动,直到髋关节活动不受限、无弹响为止。在手术过程中采取过度屈髋、内收、内旋检查手术松懈效果,并保证髋部弹响消失与Ober’s试验阴性;以射频电凝仔细止血后,放置负压引流管后,缝合切口,并局部加压包扎(若为双侧臀肌挛缩时,以相同的方法做另外一侧)。
1.3 术后康复 术后臀部创面区域予以加压、冰敷,双下肢并拢放置,鼓励患者及时行踝泵、股四头肌肌力练习。术后第一天拔除血浆引流管,拔管后即可下床行一字“猫步”行走锻炼,扶床头并膝下蹲,坐位交叉腿等锻炼,予术后2周拆线。
1.4 评估指标 术后通过门诊或电话视频随访,随访内容包括:①一般情况:伤口恢复情况、有无感染、有无下肢感觉异常等。②功能评估:评估末次随访臀肌挛缩功能量化评分、髋关节运动评分(HOS-sport)、髋关节日常生活评分(HOS-ADL)。

2 结果
2.1 患者术后情况 术后有2例患者出现局部血肿,经加压包扎后2~3 d恢复;无切口感染以及坐骨神经损伤等并发症。通过门诊、电话或视频随访,12例患者均得到随访,平均随访(17±4.97)月;末次随访臀肌挛缩功能量化评分、HOS-sport、HOS-ADL评分较术前有明显提高(P<0.05),见表1。

表1 GMC术前与末次随访各项功能评分对比
2.2 典型病例 患者女性,22岁,并膝下蹲困难10+年,既往幼年双侧臀部多次青霉素注射史。查体:脊柱无侧弯,骨盆无明显畸形;上楼梯及奔跑时呈“外八字”步态,站位时双臀外上部皮肤轻度凹陷,皮肤色泽及弹性良好,双侧臀部外上部可扪及条索状挛缩带。双侧髋关节屈曲、内收、内旋受限,后伸活动正常;无法并膝下蹲,“划圈征”阳性,“交叉腿”试验阳性;Ober’s试验阳性。经关节镜下松解挛缩带后,术后1个月随访步态正常,“划圈征”阴性,“交叉腿”试验阴性;Ober’s试验阴性。诊断为:双侧臀肌挛缩,条索型;术前、术中及术后随访情况见图1~3。
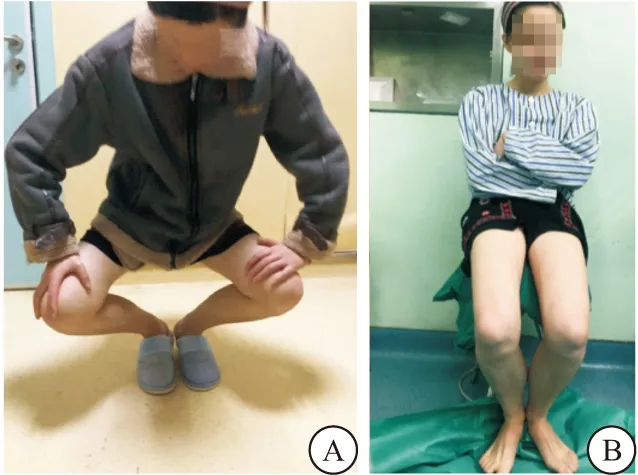
图1 术前查体
3 讨论
3.1 臀肌挛缩病因及诊断 GMC是一种由感染、外伤、免疫异常、瘢痕体质、遗传等多种因素导致臀部肌肉及筋膜组织纤维增生。有学者认为臀肌挛缩与TGF-β/ Smad途径介导的I、III型胶原积累有关[5],主要表现为臀部外形改变、异常步态、髋关节弹响、双膝并拢下蹲受限等症状的临床综合征[6-7]。国内普遍认为幼年时期臀部反复多次接受以苯甲醇为溶媒的青霉素肌肉注射是我国臀肌挛缩较为常见的原因[8]。挛缩严重程度及范围与注射频次、药物扩散范围及深度具有密切关系;对于年龄越小,用药剂量越大,注射次数越多,间隔时间越短的患者越容易发生臀肌挛缩[9]。临床对于臀肌挛缩的分型缺乏统一的标准,刘玉杰等[4]根据临床症状和术中挛缩带情况将臀肌挛缩分为:条索型、扇形、混合型、阔筋膜张肌挛缩型为关节镜下松解挛缩带提供参考。臀肌挛缩多在幼年起病,随病程的延长,髋关节周围挛缩带会导致正常生理结构产生改变,造成姿势的异常与特殊步态,如双下肢不等长、骨盆倾斜、代偿性脊柱侧弯,严重时可出现双侧髋关节脱位[10];当髂胫束受累时患者会出现髌股关节不稳导致膝前疼痛[11-12];对患者日常生活及生活质量构成较大的影响。因此,一旦确诊臀肌挛缩时应当积极手术干预治疗。
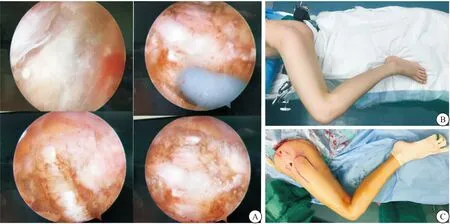
图2 术中松解挛缩带
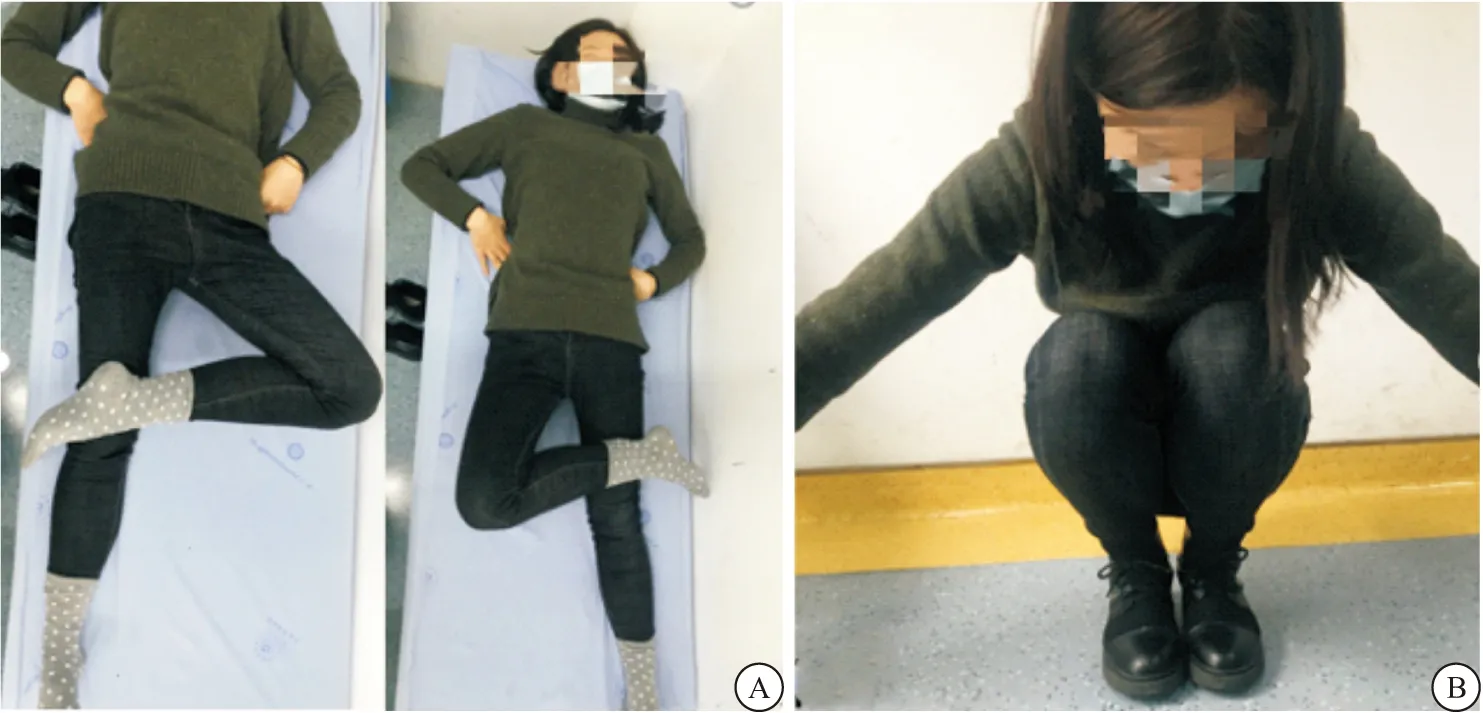
图3 术后随访
该病患者主要因自觉下蹲受限,行走常常成“八字步态”,不能翘“二郎腿”等特殊体征就诊;追问既往史多在年幼时有多次反复的臀部肌肉注射病史,往往可以较为容易的诊断。但由于一些其他的髋部疾病也可以出现上诉症状及体征如脂肪瘤、纤维瘤等,尤其是对于单侧臀肌挛缩的患者,容易与其他疾病混淆。目前可以通过髋部CT、X线等辅助检查诊断或排除诊断[13]。由于臀肌挛缩主要累及肌肉及筋膜等软组织,因此髋关节MRI对挛缩带累及范围、深度、形态具有显著的临床诊断价值[14]。最近有学者利用高频超声波诊断臀肌挛缩,并取得较好的诊断效果[15]。
3.2 臀肌挛缩的微创治疗 臀肌挛缩治疗的主要目的是松解挛缩带,恢复髋关节周围组织的功能,提高患者生活质量。臀肌挛缩传统的治疗方式为大范围切开剥离松解挛缩带,然而巨大的手术创伤会显着增加术后并发症的风险,如急性疼痛性血肿、伤口感染、巨大手术瘢痕形成、伤口裂开、行走不稳和神经血管损伤等并发症,甚至出现手术失败的风险[16-17]。有文献报道在行开放手术松解的187例患者中,62例术后出现瘢痕增生,6例血肿形成,3例伤口感染,1例伤口裂开[18]。随着关节镜等微创外科的发展,关节镜在治疗臀肌挛缩已经取得令人满意的疗效[19],而且相较于传统的开放手术创面较小,出血较少,恢复时间较短,发生术后感染的机率较小[20-21];初次切开治疗臀肌挛缩失败,二次手术选择使用关节镜微创松解也能取得较好的临床疗效[22]。国外文献报道关节镜下治疗臀肌挛缩的术后并发症约9.6%,开放手术的并发症约13.9%[7]。此次手术中发现混合型臀肌挛缩,特别是累及臀大肌及臀中肌时,由于挛缩带累及部位较深、范围较广,关节镜下操作范围狭窄,稍有不慎极容易损伤坐骨神经,松解前对挛缩带周围的脂肪组织进行刨削清除,可以在一定程度上增加手术操作空间,逐层松解挛缩带;虽然,此次研究病例中未发现坐骨神经与挛缩带粘连移位的情况,但是在此类患者的手术过程中一定要非常谨慎,避免损伤坐骨神经。若为阔筋膜张肌型的臀肌挛缩在清除挛缩带周围脂肪组织后,逐步松解阔筋膜张肌和臀大肌在髂胫束上方的附着部分,同时做Ober’s试验,一旦Ober’s试验阴性或明显感觉挛缩带的紧张度下降,则不再过多的松解。关节镜治疗臀肌挛缩的局限体现在手术操作空间有限,对深部的挛缩带松解有一定的难度[23]。因此有学者认为提出,对于累及范围较广、较深的臀肌挛缩其需要松解的范围比较大,倾向选择开放性手术[20,24]。除了使用关节镜,有研究报道使用椎间盘镜松解挛缩带也具有很好操作性、安全性及有效性[25]。对于轻症或不能耐受手术的患者可选择保守治疗,如理疗、短波照射及主动和被动伸展运动。有学者报道,在进行严格康复锻炼的情况下,48例患者最终只有38%的患者的症状有所缓解[16]。因此,本研究建议一旦确诊臀肌挛缩,应尽可能早期进行手术治疗。
4 结论
关节镜下射频松解治疗臀肌挛缩症可以缩短患者康复时间,提高患者满意度,是一种有效、安全、微创的治疗方式。该手术方式具有降低手术风险、提高手术效率、提高床位周转率等优势,是一种临床有效的微创治疗手段。

