时差的生理影响及治疗*
郭金虎,马晓红,甘锡惠
中山大学 生命科学学院,有害生物控制国家重点实验室,基因功能与调控教育部重点实验室,广州 510006
1 生物钟及其分子调控
地球表面的昼夜交替环境导致光照、温度等很多环境因子表现出24 h的周期性变化,而绝大多数生物为了适应这种周期性变化而演化出一种内在分子调控机制——生物钟[1],其赋予生物调节基因表达、生理和行为节律的功能。生物钟对于调控生理、心理及行为的24 h周期具有重要意义。当人的生物节律受到干扰或破坏时,生理或健康会受损,从而引起睡眠障碍、免疫力下降、代谢紊乱、情感性疾病等,肿瘤的发生率也会增加[2]。
在光照、温度等环境因子昼夜交替变化的环境下,生物表现出来的周期为24 h的节律称为昼夜节律(diurnal/diel rhythm)。有一些昼夜节律受生物钟基因的调节,具有内在性。这些节律即使在恒定条件下(光照、温度等环境因子保持不变),仍然可以表现出周期接近24 h的节律(20~28 h),这种节律称为近日节律(circadian rhythm)。产生近日节律的系统称为近日生物钟(circadian clock)[3]。近日节律被环境因子导引,可表现出与环境周期相同且相位稳定的昼夜节律。但是,并非所有的昼夜节律都是近日节律,如果有的昼夜节律在恒定条件下节律丧失,就不符合近日节律的特征。
在组织水平上,哺乳动物的生物钟系统由光感受器、起搏器、振荡器等元件组成[3]。不同生物具有不同的生物钟起搏器,哺乳动物的生物钟起搏器位于下丘脑前部的视交叉上核(suprachiasmatic nucleus,SCN)[4]。生物钟基因调节着SCN及外周组织、细胞基因表达的节律。生物钟通过正调控元件和负调控元件组成的转录-翻译水平的负反馈环(transcription-translation feedback loops,TTFLs)调节分子水平的节律。在哺乳动物的TTFLs中,BMAL1和CLOCK形成的异源二聚体与顺式因子E-box增强子结合,激活PER1、PER2、CRY1和CRY2的转录。当PER和CRY在细胞质中积累时,PER和CRY形成异源二聚体进入细胞核,通过干扰CLOCK-BMAL1二聚体的活性来抑制其促转录功能。此外,BMAL1和CLOCK的转录也受到视黄酸相关孤儿受体(RORs)和REV-ERBs的调节,这一通路对调节代谢具有重要作用[4]。SCN通过神经和激素等途径调节外周组织、细胞的节律,最终在整体水平上调节生理、认知和行为(图1)。

图1 生物钟系统组成及分子调节机制。左: 生物钟系统由位于下丘脑前端的视交叉上核(SCN)的主生物钟和其他各组织、器官的外周生物钟组成;右:哺乳动物中由正调控元件和负调控元件组成的生物钟负反馈分子通路
2 时差及其对生物节律的影响
光照、温度、饮食等对节律的相位具有调节作用的环境因子称为授时因子(德文:zeitgeber,或英文:time giver)。在各种授时因子中,光对节律的调节作用最为明显。快速跨时区旅行到达目的地后,目的地的光照等环境因子与出发地存在差异,会给旅行者带来时差。在生理或病理层面上,时差是时差综合征(jet lag syndrome或jet lag disorder)的缩写,指乘坐飞机等交通工具快速跨时区旅行后,身体内在节律在短时间内难以适应目的地的时间变化而出现失同步化(desynchronization),导致各种不适,包括最常见的夜间失眠及白天困倦。此外,时差还会引起疲劳、易怒、情绪低落、消化系统不适、认知及工效降低等问题[5-7]。在研究时差时要注意区分单纯旅行产生的疲劳与时差产生的疲劳之间的区别:前者只要是长途飞行就会产生,与是否跨时区无关,且一夜充足睡眠后就可以显著缓解,这两个特征都与时差不同[8]。
时差所导致的失同步化包括生物钟系统与环境之间的失同步化,以及体内不同组织间节律的失同步化[9]。在经历时差的过程中,SCN适应新的环境周期显著快于外周组织,因而导致失同步化[10]。此外,SCN内不同区域的神经元对于时差的适应能力也存在差异,腹外侧区域对环境变化的适应快于背内侧[11]。
与光照等自然环境因素相对应,一些社会性因素如夜班、轮班、周末、夜晚娱乐、假期及夏令时等因素也会导致人们的内在节律与自然的昼夜更替环境出现类似时差的不同步现象,称为社会性时差(social jet lag)[12]。例如,与工作日相比,周末人们通常会晚睡晚起,这会导致生理、行为节律的相位延迟。跨时区快速旅行的时差与社会性时差造成节律紊乱的原因是不同的。简单地说,跨时区快速旅行的时差是由于体内的节律相位赶不上新环境,在一段时间内难以适应而造成的;而社会性时差是由于在环境不变的情况下,生理、行为的节律相位发生改变,难以与环境保持协调。虽然两者的起因存在不同,但是对节律和健康的影响有相似之处。
3 时差对生理和健康存在广泛影响
在现代工业化国家里,有15%~20%的工作涉及倒班工作和跨时区旅行,都可能导致节律紊乱[13-14]。对于跨时区旅行来说,一般认为,东向飞行抵达目的地后需要我们将相位提前,而西向飞行需要我们将相位推迟,以适应目的地的环境。由于人类的内在节律周期接近25 h,西向飞行调整时差要容易一些[15]。跨时区旅行以及社会性时差会给生理和健康带来广泛的不利影响,包括节律紊乱和睡眠障碍、饮食和代谢变化、警觉性和认知能力降低等。长期倒时差或社会性时差更是与一些疾病相关,如代谢疾病(肥胖、糖尿病、心血管疾病)、免疫力下降、肿瘤发生率增高等[16]。节律紊乱也会引发情感性疾病。Lee等[17]的一项研究揭示,夜间轮班工作与罹患抑郁症的风险增加有关[2]。
时差和倒班工作障碍是一种生理节律性睡眠-觉醒障碍,是由于人们的行为改变了与外界环境相关的睡眠-觉醒时间表而引起的。夜间光照包括电子产品的使用都可能导致节律相位推迟,影响睡眠相位和质量[18-20]。与年轻人相比,由于老年人体内生物钟系统间的协调能力减弱,他们倒时差更为困难[21]。
3.1 时差导致节律紊乱和睡眠障碍
在基因组水平上,哺乳动物生物钟调节约40%蛋白编码基因的表达[22]。当发生节律紊乱时,众多基因的表达也出现异常。Laing等[23]发现,睡眠剥夺和类似时差的睡眠相位延迟可导致血细胞转录组中约100个基因的表达发生显著改变,这些基因多与糖皮质激素信号通路以及免疫功能相关。在小鼠当中,每周相位提前6 h的时差对Bmal1的节律影响比Per2更为明显,Bmal1几乎丧失了节律[24]。一些研究发现,在倒时差过程中,与内在节律相关性较弱或容易受环境影响的一些生理、行为指标如睡眠-觉醒以及心律节律,相位调整得较快,而核心体温以及尿液中6-羟基硫酸褪黑素(6-sulfatoxymelatonin,6-MT)、可的松等与内在节律密切关联指标的相位调整过程则很慢[25]。这些因素会导致内在各组织、器官间生物节律的失同步化。
睡眠-觉醒周期受睡眠稳态和生物钟的调节,节律紊乱可导致睡眠相位异常、失眠、睡眠-觉醒周期丧失等不同类型的睡眠障碍[26]。此外,在经历时差的过程中,可能也同时经历睡眠剥夺,这本身就会对睡眠产生干扰。
3.2 时差对代谢的影响
生物钟与代谢途径密切相关,调节代谢的很多方面,包括进食节律、葡萄糖和脂质代谢、体温及激素分泌、心血管系统功能、氧化还原稳态等。许多重要代谢途径如血糖、氨基酸等代谢途径的关键基因,都受到生物钟的调节[4]。生物钟对代谢的调控还表现在对相反或不相容的代谢过程(如同一分子的合成与降解)在时间上的阻隔,以保证代谢过程的时空有序性。生物钟基因突变或环境不适造成的节律紊乱会增加罹患代谢综合征的风险。代谢综合征是指代谢稳态失衡,导致出现肥胖、血脂异常、胰岛素抵抗、高血糖等病症[27]。
生物钟调节胃肠道的许多生理功能,包括细胞增殖、运动、分泌、电解质平衡,以及蛋白质、碳水化合物和脂质的消化和吸收。时差导致的昼夜节律紊乱常会引起消化系统不适,如腹泻、消化性溃疡、胃食管反流病等[27]。社会性时差与BMI (body mass index) 值呈显著的正相关,因此被认为是身体超重和罹患代谢相关疾病的一个重要风险因素[28]。与对照组相比,轮班工人患2型糖尿病的风险增加,风险增加的程度与每月的夜班次数有关[29-31]。轮班工人的代谢综合征患病率较高,肥胖、高甘油三酯和低浓度的高密度脂蛋白胆固醇更多发生在轮班工人中。肥胖在所有年龄段的女性轮班工作者中更为普遍,糖耐量受损则在老年轮班女工中最为常见[30]。肠道中的葡萄糖吸收,肌肉、脂肪组织和肝脏中的胰岛素代谢以及胰腺中的胰岛素分泌也受到主生物钟和外周各组织生物钟的调控。昼夜节律控制或其与环境/行为循环的协调紊乱,如轮班工作、晚食或由于遗传变化,会增加罹患血糖控制紊乱和2型糖尿病的风险[32]。
生物钟与代谢对心血管机能具有重要影响。经常倒时差的男性飞行员心电图左心室肥大和收缩压升高的发生率显著高于普通人群,并且飞行员胆固醇水平明显升高[33]。与白班工人相比,轮班工人的冠心病风险更高,血清总胆固醇水平较高,倾向于中间型肥胖(central obesity)[31]。还有研究显示,轮班工作者罹患心血管疾病和心血管疾病死亡的风险增加,并且轮班工作时长对这一影响具有剂量效应[34]。
肠道微生物群对宿主的新陈代谢具有重要的调节功能,包括营养消化、维生素合成和免疫编程等,肠道微生物平衡的破坏会导致多种代谢紊乱[35]。肠道微生物的丰度受到生物钟的调节,在生物钟基因Per1/2缺陷小鼠以及倒时差的正常小鼠中,肠道微生物的节律丧失。将倒时差的人肠道微生物移植到无菌小鼠肠道可引起代谢稳态的失调,小鼠体重明显增加,血糖浓度也显著升高[36]。此外,口腔微生物的丰度变化也受到生物钟的调控[37]。
睡眠-觉醒周期是生物钟最明显的表现。生物钟与免疫系统具有紧密关系,并且两者间具有双向的调节作用[38]。生物钟对很多免疫相关的生理过程或疾病,包括宿主抵御微生物感染、败血症和炎症反应等,都具有调节作用[39]。哺乳动物及人的很多免疫因子,包括白介素(IL-1β、IL-2、IL-6、IL-12)、肿瘤坏死因子TNF-α、干扰素IFN-γ等,都受到生物钟的调控,主要在夜间分泌;一些抗炎症因子如IL-4、IL-10则主要在白天分泌[40]。动物实验显示,慢性时差会引起中风的风险增加,注射脂多糖后检测结果显示时差还会引起免疫反应失调[41-42]。慢性的时差会引起大鼠自然杀伤细胞(natural killer cells)数量和节律特征的改变,加快肺部肿瘤的生长[43]。此外,褪黑素(melatonin)对生物节律、细胞周期、细胞死
3.3 时差与免疫力下降及肿瘤发生具有关联
亡以及DNA损伤等相关基因的表达也具有调节作用[44],如TP53等基因,而节律紊乱会加快肿瘤的生长速率。生物钟独立于细胞周期,但两者间存在偶联,可以共同对细胞增殖发挥作用。生物钟的核心基因如BMAL1、PER2,在肿瘤中的表达通常会出现异常。一方面,这些生物钟核心基因对与细胞周期或肿瘤相关的基因的表达具有调节作用;另一方面,一些肿瘤相关基因也会影响生物钟基因的表达和功能。例如,PER2可以促进 p53的作用,而BMAL1的表达受到MYC的调控[45]。破坏小鼠的SCN除了引起节律紊乱,还会导致植入的骨肉瘤和胰腺癌组织生长加快[46]。在另一项研究里,夜间人工光照(artificial light at night,ALAN)导致植入裸鼠体内的人乳腺癌组织生长显著加快[47]。由于PER1与雄激素受体(adrogen receptor,AR)结合,过表达PER1可抑制前列腺癌细胞的生长,促进凋亡[48]。
在用诱变剂诱导小鼠肝癌发生的实验中,倒时差的小鼠肿瘤发生进程也显著加快[49]。飞国际航线、通宵工作的空乘和长期上夜班的护士患乳腺癌的风险增加,患其他癌症(如肺癌、皮肤癌及消化系统癌症等)的风险也增加,并且轮班时间越长,风险增加的概率越高[50-55]。一项研究发现,轮转的夜班工人患前列腺癌的风险显著高于日间工人和夜间固定时间工作的工人,并且这一风险在“夜猫子”时间型的人群里更高[56-58]。针对轮班工人的研究评估了罹患各种癌症的风险,结果显示其中风险较高的癌症类型包括前列腺癌(男性)、结直肠癌、卵巢癌和子宫内膜癌(女性)等[16]。2007年,基于动物及临床研究数据,国际癌症研究机构(International Agency for Research on Cancer,IARC)提出,轮班工作可导致节律紊乱并增加致癌风险[16]。此外,还有研究发现,对于恶性肿瘤患者,能够保持正常节律的患者五年存活率显著高于节律不明显的患者[59]。
新冠病毒COVID-19肆虐全球已经有一年多的时间,夺去了超过295万人的生命,也给全球经济造成了巨大损失。许多国家为应对COVID-19采取的隔离措施也会对节律和睡眠产生干扰。一项针对40个国家11 431名成年人的调查发现,被调查人员的睡眠-觉醒时间在隔离前和隔离期间发生了显著的改变,工作日和休息日的睡眠时间均有延迟[60-61]。细胞表面的ACE2是SARS-CoV-2 病毒Spike蛋白的受体,其表达受生物钟调节,提示COVID-19的病理和临床特征也可能具有节律性[62]。
3.4 时差影响认知、工效
生物钟对生理和心理都具有广泛的影响,参与学习、记忆、警觉度、认知及工效等方面的调节[63-64]。当人体因时差等原因发生节律紊乱时,这些指标都会受到影响,从而影响人的认知水平、运动状态和作业能力[65]。旅行时差会对商务、旅游等产生数日不等的短暂影响。
生物钟对人的肌肉力量、柔韧性、反应速度和协作性也具有广泛的影响[66],因此,时差对体育赛事也有影响,会影响运动员的发挥。Song等[67]对美国职业棒球大联盟(Major League Baseball) 20年期间(1992—2011) 4 919次赛事数据进行了分析,发现东向飞行对于比赛成绩的影响较大,而西向飞行对于赛事成绩的影响较小。人内在近日节律的周期约为25 h,因此,Song等[67]认为西向飞行需要推迟节律相位,比东向飞行调节相位、适应时差更为容易。
此外,时差及长期的轮班工作对于生殖能力也会产生不利影响。节律紊乱会影响多种动物的生殖周期[68]。一项调查显示,国际航班的女性空乘有30%~50%出现排卵延迟和月经不调等状况,出现宫颈糜烂的比例也高于对照群体[69]。节律紊乱对健康的不利影响是多方面的,并有可能产生叠加效应。大量通过改变环境周期或通过遗传操作等手段改变生物内在节律周期的研究结果显示,节律紊乱会影响生物对环境的适应性[70]。动物实验结果显示,经常倒时差也会缩短寿命,其中相位不断提前对寿命的影响更为显著[71-72]。
除了跨时区飞行及轮班工作外,一些国家、地区采用的夏令时(daylight saving time)也会产生提前或推迟1 h的时差[73]。我国从1986年开始也曾使用过夏令时,但6年后就废止了。尽管夏/冬令时在一年的春季或秋季人为产生仅1 h的时差,但也会带来不利影响。夏令时在每年刚改时间后会影响人的情绪,出现睡眠不足,导致各种事故及医院的急诊病例增加等情况[73]。甚至还有报道显示,在改时后接受辅助生殖的妇女流产率也会增加[74]。
4 时差的调整与治疗
不同动物调节时差的能力明显不同,人类一般每天能够调整大约1 h的时差[75]。轮班与跨时区飞行的时差症状相似,但是前者受轮班工作时间的影响,一旦结束轮班情况就会得到改善,而跨时区飞行的时差在到达目的地数日后会缓解并适应新的环境周期。用以调整轮班与跨时区飞行造成的节律紊乱的手段也基本相似,大致可分为物理因素治疗、药物治疗和社会因素调整等三类。物理治疗如通过光照来调节相位,药物治疗包括服用褪黑素和安眠药等,第三类手段是指通过调节睡眠、运动和饮食时间来调整时差。具体的治疗方案需要根据目的地和出发地时间差、在目的地停留的时间等因素来确定。尽管这些措施对于缓解时差的不适症状和加快相位调整具有一定的作用,但效果仍非常有限。
一般来说,如果目的地与出发地相隔少于3个时区,时差的影响不太明显,不需要特意调整时差;即使目的地与出发地相隔超过3个时区,但在目的地停留少于3天,也不需要调整时差,否则时差还未调整过来,在离开目的地后又要按新的地点来调时差;如果目的地与出发地相隔超过3个时区,并且在目的地停留超过3天,就需要采取措施调整时差,以减少不适感和尽快适应目的地的环境周期[8,52]。通过昼夜同步改善代谢健康的策略包括调节光照、调整作息、睡眠卫生和时间疗法等。此外,一些药物也可以用于调整时差,如褪黑素、糖皮质激素(glucocorticoid)等[76]。
采用各种方法调整节律都需要注意在合适的时间进行,要依据它们的相位反应曲线(phase response curve,PRC)来设计和安排治疗时间。例如:如果要提前相位则要在下午或傍晚服用褪黑素并避免强光,而在上午接受强光照射;如果要推迟相位,需要在下午或傍晚接受光照而在上午避免光照并服用褪黑素(图2)。所谓强光,是指500 lx以上的白光或蓝光。在治疗时差时,光照与褪黑素常配合使用,既可以取得更好的效果,也可以避免光照对褪黑素的降解作用[8]。
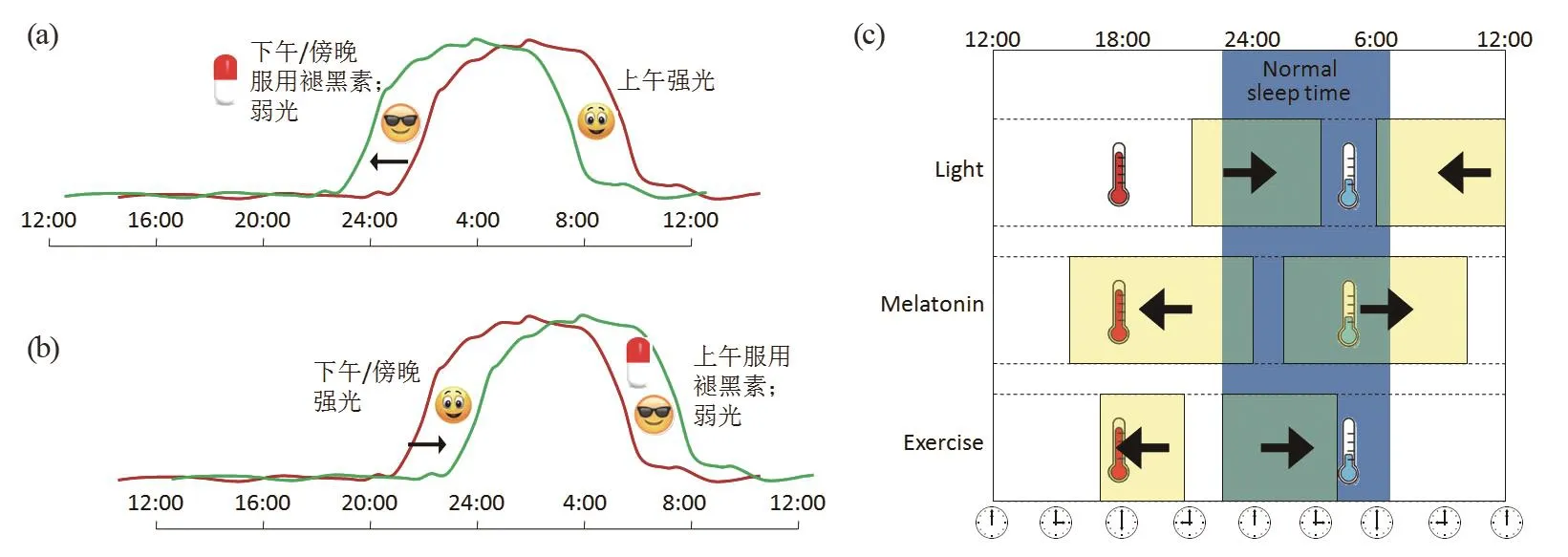
图2 采用褪黑素及光疗调整节律相位的示意图。红色曲线表示调整前的节律,绿色曲线表示调整后的节律。(a)节律相位提前。在下午/傍晚服用褪黑素,并且避免强光暴露,而上午则要强光暴露。(b)节律相位推迟。在下午/傍晚强光暴露,上午避免强光暴露并服用褪黑素。不戴墨镜表示接受强光照射,戴墨镜表示避免强光。(c)不同时间接受光照、服用褪黑素和体育锻炼对节律相位的影响。蓝色阴影表示平时的睡眠时间,黄色方框表示接受光照、服用褪黑素和体育锻炼的时间。左箭头表示导致相位提前,右箭头表示导致相位推迟。红色温度计表示体温的峰值时间,蓝色温度计表示体温的谷值时间
迄今,已经有一些调控相位变化的基因被鉴定出来。SCN背侧区域含有分泌精氨酸加压素(arginine vasopressin,AVP)的神经元,腹侧含有分泌血管活性肠肽(vasoactive intestinal peptide,VIP)的神经元。AVP/V1受体通路对于调节SCN相位变化具有重要的功能,AVP/V1受体编码基因V1a、V1b敲除小鼠适应时差的能力显著加快[77]。盐诱导激酶1(salt inducible kinase 1,SIK1)可以磷酸化受CREB调节的转录共激活因子CRTC1,进而抑制节律的相位改变。Sik1敲除小鼠对时差的适应性显著加快[78]。但是,对于完全消除时差后相位的快速改变是否反而不利于机体对环境的适应这一问题,迄今尚无报道。
4.1 光疗法调整时差
视网膜内在光敏神经节细胞(intrinsically photosensitive retinal ganglion cells,ipRGCs)负责感受光照并将信号传递给SCN,以调整主生物钟及外周生物钟。夜间轮班工作增加了在夜晚的光照暴露,而ALAN会扰乱内在节律,损害健康[16]。反过来,正是由于在多种环境因子当中,光对调整节律的作用最为显著,光疗可以用来调整时差,改善节律紊乱。
ipRGCs对波长约为460 nm的光最为敏感,因此可以用白光或蓝光来调整时差[79],也可以通过补充光源、调整工作或生活环境的光照条件(调暗或调亮)以及佩戴特殊的眼镜等方式来调整时差。佩戴眼镜是指在需要避光的情况下佩带墨镜或防蓝光眼镜。光疗法也普遍用于调整季节性情感障碍(seasonal affective disorder,SAD)患者的节律,以缓解他们的抑郁症状[80]。光疗法对于ipRGCs受损的盲人或视网膜至SCN神经通路受损的人不适用,但在这种情况下,他们可以通过褪黑素等其他手段来改善节律紊乱。
4.2 褪黑素及其他药物治疗
哺乳动物及人的褪黑素由松果体分泌,具有调节节律、促进睡眠、抗氧化、调节免疫、抑制肿瘤等功能[21,81]。在两栖动物中,褪黑素还具有改变皮肤颜色的功能[82]。哺乳动物和人的褪黑素的分泌具有明显的节律特征,褪黑素和核心体温的节律被认为是内在节律的金指标。合成褪黑素的限速酶芳基烷基胺N-乙酰转移酶(arylalkylamine N-acetyltransferase,AA-NAT)的表达受到生物钟的调节。褪黑素主要在夜间分泌,因此也称为黑暗激素(hormone of darkness)[83]。夜晚的光照引起血清里的褪黑素含量迅速下降,不利于睡眠[16,18]。此外,褪黑素的分泌也会受季节的影响,在日照时长较短的冬季分泌较多,而夏季较少[21]。
褪黑素的受体包括G蛋白偶联的MT1、MT2和MT3三种受体,褪黑素主要通过抑制SCN的MT1受体神经元放电以及通过外周组织的MT2受体两种途径调整节律[44,84-85]。褪黑素已被广泛用于治疗节律紊乱以及因节律紊乱引起的睡眠障碍,对于时差或轮班引起的疗效尤其显著[86]。褪黑激素的副作用目前尚不清楚,但有一些研究提示褪黑素可能有导致过敏性反应的风险[87]。此外,褪黑素的类似物以及褪黑素受体的激动剂、拮抗剂也被用于治疗节律紊乱或睡眠障碍,如可与MT1和MT2受体结合的褪黑素受体激动剂雷美尔通(Ramelteon)、阿戈美拉汀(Agomelatine)等。
莫达非尼(Modafinil)、右旋苯异丙胺(Dextroamphetamine sulfate)以及咖啡因(caffeine)等药物被用于改善时差期间白天的疲惫和精神不振状态,但需要注意这些药物的成瘾性以及产生的头痛、血压升高、食欲丧失等副作用[21]。非苯二氮卓类安眠药(如佐匹克隆(Zopiclone)、唑吡坦(Zolpidem))被用于改善睡眠状况和减缓时差的影响,通常在抵达目的地后的几天内每天晚上睡前服用。但是需要注意的是,安眠药也会有各种副作用,包括头痛、头晕、恶心、神志不清和健忘[88]。在军事任务上,短效安眠药被用来缓解飞行时差或社会性时差,以降低不适,改善睡眠,以及提高警觉度和工效[89]。
近年来不同实验室陆续鉴定出一些小分子化合物,能够以激动剂、反向激动剂或者拮抗剂等方式调节节律的振幅、周期或相位[90-92]。RuvB-like ATPase 2 (RUVBL2) 可与染色质上其他已知的时钟蛋白相互作用来调节昼夜节律。Ju等[53]报道了腺苷类化合物虫草素(cordycepin)可抑制RUVBL2与BMAL1等生物钟因子的互作。小鼠服用虫草素可引起长至12 h的相位改变,显著加快倒时差进程[53]。这些小分子化合物有可能成为调整时差、改善节律紊乱的候选药物。
4.3 通过睡眠、运动和饮食的时间管理来调整时差
除了上述方法外,人们也可以通过合理计划和安排作息时间、用餐时间及社交活动等社会性因素来调整节律。与光照、褪黑素等因子相比,这些措施对于节律的调节作用要弱很多,但仍可以作为节律紊乱的辅助治疗手段。对于跨时区飞行的时差来说,这些措施有助于加快倒时差的进程;对于轮班等社会性时差而言,这些措施有助于维持工作时段的警觉度以及保障休息时段的睡眠质量。
饮食时间对外周组织(包括肝脏、白色脂肪组织、消化道、心脏、肺、肾脏等)的节律具有调节作用。饮食可能通过糖皮质激素等激素、葡萄糖等代谢物以及腺苷酸激活蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)等营养分子感受器影响外周组织的节律。动物实验揭示,夜行性动物在白天进食也会对中枢神经系统(包括弧形和背内侧核、中央杏仁核和小脑)的节律产生影响,而SCN和海马组织则不受影响[93]。因此,在治疗时差或社会性时差当中,饮食和其他一些措施的主要作用是针对外周组织,对调整节律起辅助和强化作用。
通过饮食调整节律相位也要注意时间性。Kräuchi和同事[94]发现,在傍晚食用高热量食物有助于改变心率、核心体温和褪黑素的分泌节律,但如果在早晨食用高热量食物则效果不明显[8]。在长途飞行过程中,可按照目的地的时间安排用餐。此外,在乘飞机旅行时也要防止脱水[95]。
适度的体育运动有助于睡眠,对生物节律也有一定的调节作用。但是体育运动的相位响应曲线不是很清楚,因此与光照、褪黑素等授时因子相比,在何时锻炼能够提前或推迟相位尚不是很明确(图2)[8]。
5 时差机理及治疗方案研究的展望
López-Otín和Kroemer[96]最近提出人体健康的8个重要指征,包括局部病变调控、分子回收与更新、调节网络集成、节律震荡、稳态恢复、毒物兴奋效应调节、修复与再生、生理屏障以及生物节律。一方面,由跨时区快速旅行产生的时差是一种新的疾病,是随着飞机等高速交通工具的发展才出现的,至今不足百年;另一方面,现代社会工作和生活节奏的加快也使得社会性时差更为普遍。
分子水平的研究有助于我们深入理解包括时差在内节律紊乱的生理和病理机制,但是,如何将这些基础研究转化为有效的治疗措施,目前仍然是一个巨大挑战。迄今,所有的调整手段和药物只能在一定程度上加快对时差的适应,无法做到在短时间内迅速调整时差,更没有任何能够预防时差的方法[8]。因此,有关时差对健康的影响及相应的预防和治疗研究还有很长的路要走。很多情感性疾病和神经退行性疾病也具有节律紊乱的症状,例如阿尔茨海默病(Alzheimer disease)患者的病情通常在傍晚加重。因此,关于时差的研究以及治疗手段、药物的开发对于治疗其他很多与生物钟功能障碍相关的疾病也具有重要意义。

