MR Dixon、T2 mapping、T2* mapping技术定量评估腰椎原发性骨质疏松症的可行性研究
南方医科大学顺德医院(佛山市顺德区第一人民医院)放射科(广东 佛山 528308)
周翠铷 胡秋根* 陈海雄 刘子蔚 张 榕
骨质疏松症(osteoporosis,OP)是一种因骨量丢失及骨微结构受损,而致骨强度下降、易发生骨折的慢性全身性骨骼疾病。OP多见于绝经后妇女及老年男性,是一种与年龄增长相关的常见病,随着人口老龄化日趋严重,OP已成为我国乃至全球面临的重要公共健康问题,骨质疏松性骨折(亦称“脆性骨折”)是OP的最常见并发症,一旦发生脆性骨折将给患者带来沉重的身体及经济负担[1]。OP是可防可治的,对高危人群进行早期筛查,及时发现并进行适当治疗,可大大降低骨折的风险。
1994年,世界卫生组织(WHO)推荐使用双能X线骨密度测量(DXA)作为诊断OP的国际标准[2],2007年国际临床骨测量学会(ISCD) 的专家建议QCT可用于诊断OP[3],DXA及QCT对OP的诊断标准都是基于骨密度(bone mineral density,BMD),但是BMD只能单从骨量方面反映骨强度,骨强度还受骨质量因素影响,因此单方面采用BMD诊断OP会存在一定的局限性,同时相关研究表明OP患者中骨折组与非骨折组的BMD存在一定交叉重叠,仅参照BMD来评估脆性骨折风险将会使约一半以上的患者发生漏诊[4]。本研究旨在采用磁共振水-脂分离成像(Dixon)、T2mapping、T2*mapping定量技术从骨质量方面评估OP,以期为临床医生全面诊断OP提供新的影像学检测方法及参考指标。
1 资料与方法
1.1 一般资料选取本院2019年6月1日至2020年6月30日门诊及住院来源患者120例,年龄30~86岁,平均年龄(63±13)岁,男34例,女86例。纳入标准:前后一个月内在放射科同时做过腰椎QCT及腰椎常规MRI、Dixon、T2mapping、T2*mapping检查的患者。排除标准:影像及临床资料不全者;患有腰椎感染性或肿瘤性病变者;可引起骨代谢紊乱的因素,如糖尿病、慢性肾病、甲状旁腺功能亢进症等患者或服用糖皮质激素、性激素等激素治疗者;腰椎内固定或骨水泥微创术后者;腰椎椎体变形者;既往有化疗或放疗病史者。
1.2 检查方法
1.2.1 腰椎QCT扫描及BMD测量 采用东芝Aquilion/Prime 160层螺旋CT机及美国Mindways 公司的QCT标准体模和后处理测量工作站。患者取仰卧位,扫描参数分别为管电压120kV,管电流150mAs,FOV 250mm×250mm。扫描结束后将原始数据传至QCT Pro工作站,分别测量L1-3椎体的BMD并取均值作为最终测量值,在椎体中央偏前位置勾画感兴趣区时要避开椎体骨皮质及椎基静脉走行区。QCT诊断标准为当BMD大于120mg/cm3提示骨密度正常,当BMD在80~120mg/cm3范围内提示骨量减少,当BMD小于80mg/cm3提示OP[3]。以BMD结果为分组依据,将患者分为骨密度正常组29例、骨量减少组32例及骨质疏松组59例。
1.2.2 腰椎MRI扫描 采用西门子Skyra 3.0T MR机进行检查,脊柱32通道线圈,分别对患者进行腰椎常规MRI序列及Dixon、T2mapping、T2*mapping序列扫描,常规序列包括矢状面的T1WI、T2WI及横断面的T2WI,其中T2mapping的多回波TE分别为13.8/27.6/41.4/55.2/69.0ms,T2*mapping的多回波TE分别为3.71/9.99/16.27/22.55/28.83ms,各个序列扫描范围均包括L1-5椎体,具体扫描参数见表1。
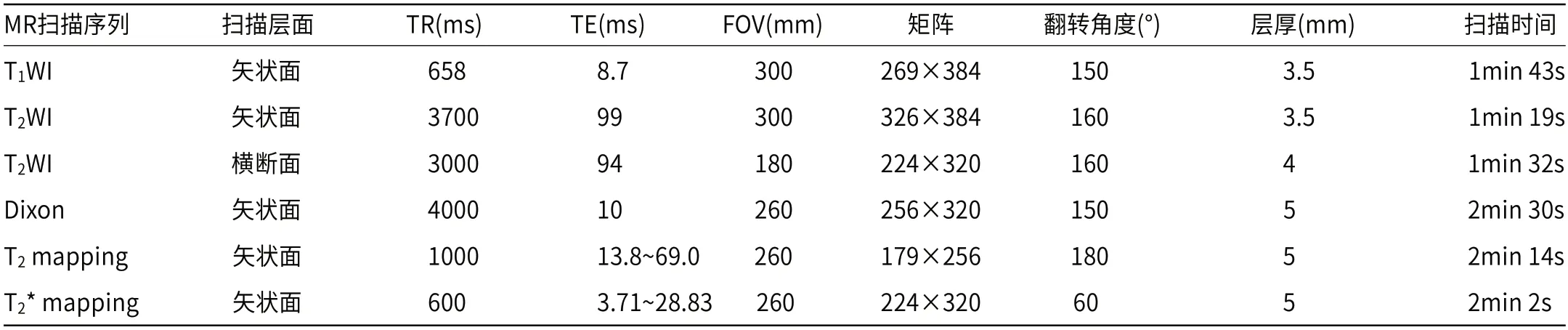
表1 腰椎MRI序列扫描参数
1.2.3 FF值、T2值及T2*值的测量 腰椎MRI扫描结束后将原始数据传至西门子图像后处理工作站,生成FF图及T2mapping、T2*mapping伪彩图(图1~图3),分别在这三组图像上选取腰椎正中矢状位的连续3个层面,在L1-3椎体上勾画感兴趣区(面积约2.0cm2)分别测量相应指标并取相应平均值作为最终测量值。
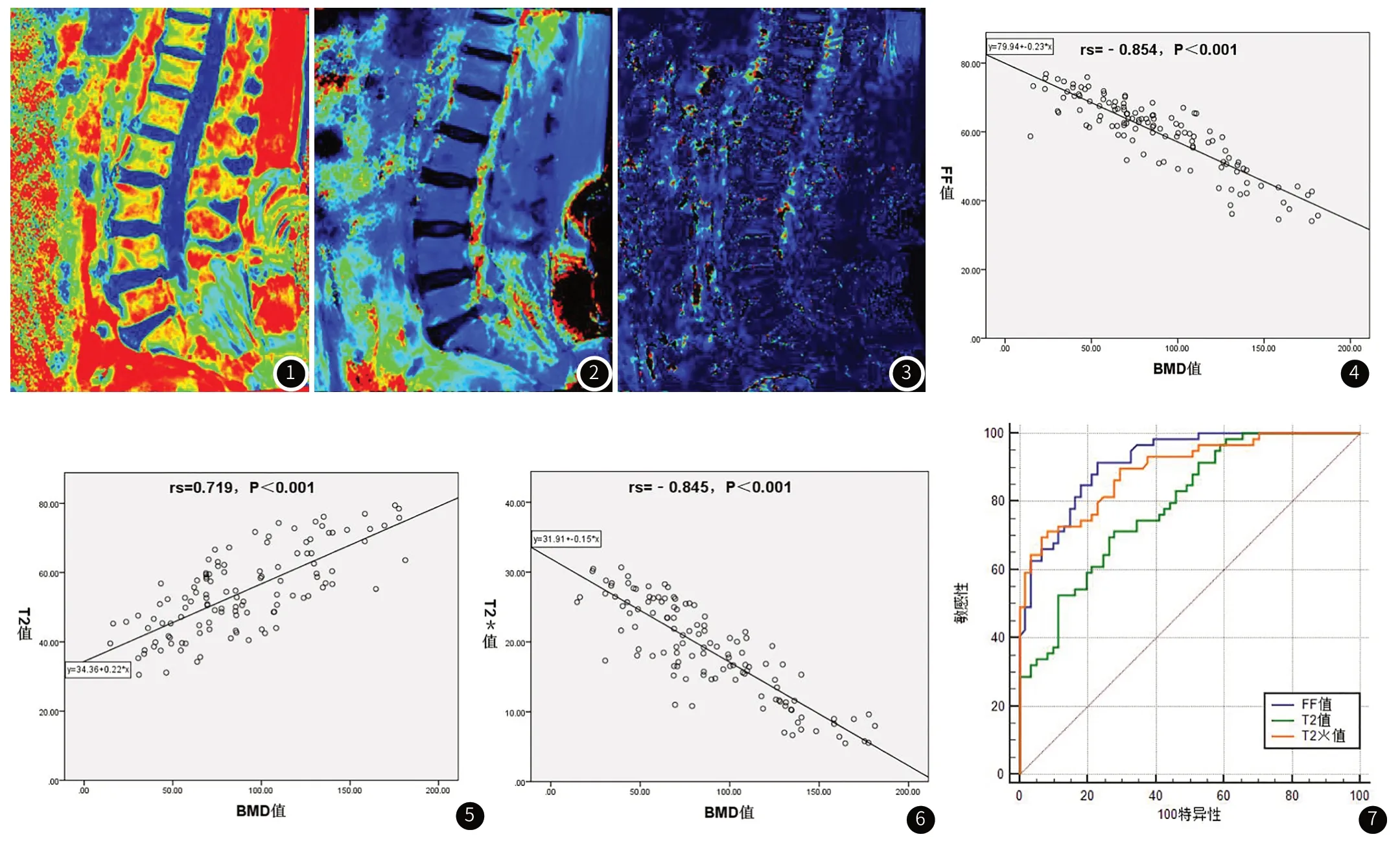
图1~图3 女,79岁,分别为FF图、T2 mapping伪彩图、T2* mapping伪彩图,分别测量获得FF值为66.45%、T2值为48.73ms、T2*值为26.23ms。图4~图6 FF值、T2值及T2*值与BMD的相关性。图7 FF值、T2值及T2*值诊断OP的ROC曲线。
1.3 统计学方法应用SPSS22.0统计软件进行数据分析,本研究所有测量数据均为计量资料,以(χ-±s)表示。检验FF值、T2值及T2*值这三个测量指标是否服从正态分布采用Shapiro-Wilk检验,三个测量指标在不同分组间的比较采用Kruskal-Wallis H非参数检验,三个测量指标与BMD的相关性分析采用Spearman相关分析,三者对OP的诊断效能采用接受者操作特性曲线(receiver operating characteristic curve,ROC曲线)分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 对三个分组的FF值、T2值及T2*值进行正态分布及方差齐性检验采用Shapiro-Wilk检验对三个分组的FF值、T2值及T2*值进行正态性检验,统计结果显示骨量减少组T2值(P=0.032)及骨质疏松组T2*值(P=0.017)不服从正态分布,其余各组数据服从正态分布(P>0.05);经Levene's方差齐性检验,统计结果显示T2*值方差不齐(P=0.019),FF值及T2值方差齐(FF值:P=0.125,T2值:P=0.721)。
2.2 三个分组间的FF值、T2值及T2*值比较Kruskal-Wallis H非参数检验分析显示,三个测量指标在骨密度正常组、骨量减少组及骨质疏松组间的差异有统计学意义(P<0.001);采用Bonferroni法校正显著性水平的事后两两比较发现,FF值及T2*值在任意两组间的差异均有统计学意义(调整后P<0.001),T2值在骨密度正常组和骨量减少组、骨密度正常组和骨质疏松组间的差异有统计学意义(调整后P<0.001),而在骨量减少组及骨质疏松组间的差异无统计学意义(调整后P=0.056),见表2。
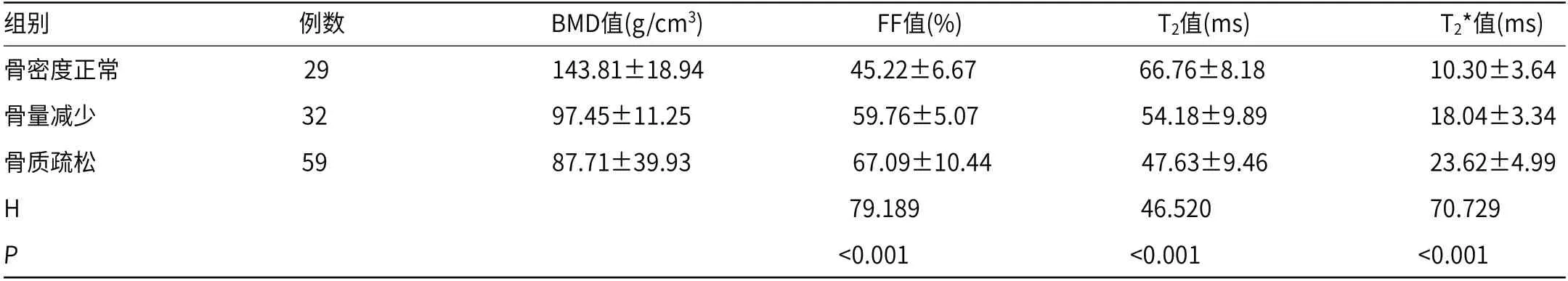
表2 三个分组间FF值、T2值及T2*值比较
2.3 FF值、T2值及T2*值与BMD的相关性Spearman相关分析显示,三个测量指标与BMD的相关系数分别是rs(FF)=﹣0.854、rs(T2)=0.719、rs(T2*)=﹣0.845,差异均有统计学意义(P<0.05),见图4~图6。
2.4 FF值、T2值及T2值对OP的诊断效能以骨质疏松症为阳性事件,FF值、T2值及T2*值ROC曲线的曲线下面积(areas under curve,AUC)分别是(0.918±0.024)、(0.792±0.039)、(0.894±0.028),差异均有统计学意义(P<0.05),见表3及图7。通过ROC曲线两两对比分析得出,FF值与T2*值对OP的诊断效能差异无统计学意义(P=0.4732),FF值与T2值对OP的诊断效能差异有统计学意义(P=0.0029),T2值与T2*值对OP的诊断效能差异有统计学意义(P=0.0073),见表3。
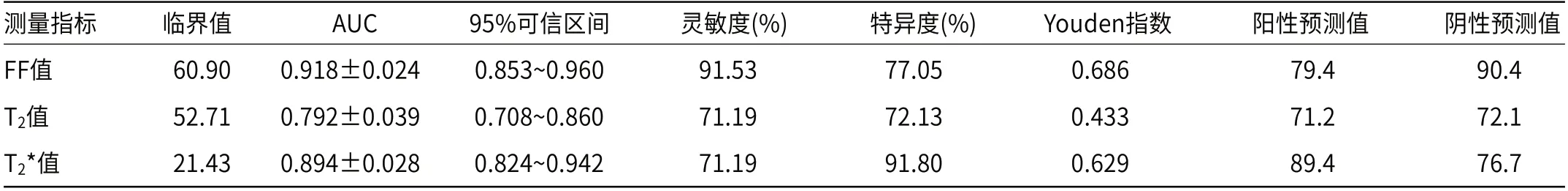
表3 FF值、T2值及T2*值对OP的诊断效能
3 讨 论
2001年美国国立卫生研究院(National Institutes of Health,NIH)指出骨质疏松症(OP)的特征是骨强度下降伴骨折风险增加[5]。脆性骨折是OP最常见、最严重的并发症,据统计,2015年我国主要脆性骨折(腕部、椎体和髋部)约为269万例,预测到2035年将增至483万例(增幅达79.55%)[5],同时据2015年预测,我国2015年、2035年和2050年用于治疗主要骨质疏松性骨折的费用分别高达720亿元、1320亿元和1630亿元[6],可见脆性骨折的发病率不容乐观,同时骨折为患者带来的身心压力及经济负担不容小觑。WHO指出,对OP高危人群进行早期筛查,是预防脆性骨折最有效、最经济的可行性措施,因此早期诊断、早期治疗OP对降低骨折风险至关重要。过去一直以BMD作为诊断OP及预测骨折风险的指标,然而骨骼抵抗外力的能力不仅取决于BMD,还取决于其内部骨小梁的空间分布以及组成骨的内在物质构成等因素,后者是骨质量的重要组成部分。生理学上,骨强度主要由BMD和骨质量两个内容构成,BMD只能反映60%~70%骨强度的变化[7-8],因此,单纯地使用BMD诊断OP及预测骨折危险性,其敏感性及特异性将受到一定的限制。
越来越多的研究证实,OP患者的病理生理学改变与骨髓内水、脂肪及矿物质含量密切相关[9-12],磁共振Dixon技术可以无创地测定人体组织内的脂肪含量,已被广泛应用于全身多个系统,尤其是脂肪肝的研究及临床诊断中[13-14];T2mapping技术可以反映组织内部的水成分差异,可以通过测定T2值来分析病灶的水含量[15-16];T2*mapping技术亦可用于组织含水量的测定,并且可以在一定程度上反映骨髓内矿物成分的含量,同时T2*值与骨髓微结构中骨小梁的数量及空间几何形状密切相关[17]。
本研究结果显示,通过Dixon、T2*mapping技术获得的腰椎椎体FF值及T2*值在骨密度正常组、骨量减少组及骨质疏松组任意两组间的差异均有统计学意义,即FF值及T2*值可用于骨密度正常、骨量减少及骨质疏松的鉴别;通过T2mapping技术获得的T2值在骨密度正常组和骨量减少组、骨密度正常组和骨质疏松组间的差异有统计学意义,而在骨量减少组及骨质疏松组间的差异无统计学意义,不能用于骨量减少与骨质疏松的鉴别。同时FF值、T2值及T2*值与BMD的相关系数分别是-0.854、0.719、-0.845,即随着BMD的降低,FF值及T2*值呈逐渐上升、而T2值呈逐渐降低的趋势,主要原因在于:(1)遗传、衰老、性激素、细胞因子等多种调控因素导致OP患者骨吸收多于骨形成,骨重建失平衡致使骨量丢失,骨小梁稀疏变薄、排列紊乱、间隙扩大,再加上红黄骨髓的转换,骨髓内水分逐渐减少而脂肪组织逐渐增多[7,18-19],所以T2值会降低,FF值会上升;(2)T2mapping是一种自旋回波序列,而T2*mapping是一种梯度回波序列,两者的共同点都是利用多回波序列采集的横向磁豫时间,而不同点在于T2*mapping序列在成像过程中施加完90度脉冲后没有施加180度相位重聚脉冲,导致磁场中质子的失相位状态没有被抵消,因此所产生的磁豫时间是被检组织内质子的自旋横向弛豫时间T2与因磁场不均匀性引起相位偏离所产生的横向弛豫时间T2*的相结合,而T2mapping采集的是真正的横向磁豫时间T2,可见T2*值能反映磁场的不均匀性,因此T2*值相比于T2值更有利于显示受检组织结构对磁敏感变化的差异[20]。本研究受检组织中引起的磁敏感差异主要来源于椎体内骨小梁的微空间几何结构形态及其数量,还有骨小梁与骨髓交界面磁化率的差异,由于OP患者骨髓内骨小梁减少、间隙扩大,再加上骨髓内脂肪组织增多,骨小梁与骨髓的交界面减少,造成局部磁场不均匀性减弱,从而使磁豫时间延长,T2*值增大[21]。
上述研究结果表明随着骨密度的变化,FF值、T2值及T2*值会按一定的规律发生相应的变化,此外,本研究通过这三个指标相关ROC曲线诊断效能的分析中发现,FF值、T2值及T2*值诊断骨质疏松的临界值分别为60.90%、52.71ms、21.41ms,这意味着当进行腰椎MRI-Dixon、T2mapping、T2*mapping定量检查时,在对检查图像进行定量测量的过程中若发现FF值大于60.90%、T2值小于52.71ms、T2*值大于21.41ms时,就要考虑骨质疏松的可能。
既往有不少学者利用MRI技术对骨质疏松症展开研究,但他们的研究大多是围绕单一的一个技术,主要是评价该技术对骨质疏松症到底有无诊断意义,而没有综合比较这些技术之间哪个对骨质疏松症的诊断更胜一筹。本研究通过分析ROC曲线下面积(AUC)及Youden指数发现,采用FF值、T2值及T2*值指标评估骨质疏松症具有良好的诊断价值;通过ROC曲线两两对比分析得出,FF值与T2*值对骨质疏松症的诊断效能差异无统计学意义(P=0.4732),FF值与T2值对骨质疏松症的诊断效能差异有统计学意义(P=0.0029),T2值与T2*值对骨质疏松症的诊断效能差异有统计学意义(P=0.0073),表明对于骨质疏松症的诊断价值,FF值优于T2值,T2*值优于T2值,而FF值与T2*值之间没有可比性,这一研究结果可以为临床医生优先选择哪一种检查方法提供参考依据。
本研究获得的FF值及T2*值与BMD的相关系数以及对OP的诊断效能分析中AUC、特异度均高于Wu等[17]、翟树佳等[22]的研究结果,但灵敏度没有上述学者的研究结果高,同时FF值与T2*值评估OP的临界值也跟上述学者的研究结果不一致,原因可能在于:(1)本研究纳入的研究例数比上述学者的研究例数多,且受试者的年龄段跨度相对较广;(2)受试者分组标准不一致,上述学者的分组标准是根据双能X线吸收法(dualenergy X-ray absorptiometry,DXA)测量得出的BMD,有别于本研究利用QCT获得的BMD,前者测量得到的是二维的面积骨密度,测量结果容易受到受检骨体积、形态大小、骨质增生、骨旁韧带钙化等因素的影响,而QCT测量得到的是三维的体积骨密度,反映的是真正松质骨内的骨密度,准确性高于DXA[23];(3)MR机型号不一致等原因。
本研究的不足之处在于纳入研究的例数不够多,难以对不同年龄段及性别等不同因素进行分组分析;研究得出的临界值需要更多的研究例数进行验证支持;仅对L1-3椎体进行测量研究,没有纳入其它易引起脆性骨折的部位。
综上所述,磁共振Dixon、T2mapping、T2*mapping技术不但具有无创、无辐射、数据后处理方便的优势,还可以分别通过测定腰椎FF值、T2值及T2*值反映椎体骨质量情况,对OP做出初步评估,为OP的全面诊断提供新的影像学检测方法及参考指标。

