MRI-STIR信号变化对老年骨质疏松型骨折患者延迟愈合或不愈合的评估价值
济宁医学院附属医院兖州院区医学影像科(山东 济宁 272100)
刘 文*
骨质疏松型骨折以老年患者最常见[1],其中骨质疏松性椎体压缩性骨折较典型。既往老年骨质疏松型骨折患者会通过长期卧床休养来促进骨折痊愈[2],但容易出现骨折延迟愈合或不愈合的现象,严重影响患者康复[3],增加下肢静脉血栓形成风险。因此非常有必要鉴别骨质疏松型骨折患者延迟愈合或不愈合风险,以提升治疗效果,减少并发症,提高患者生活质量。X线及MRI在诊断骨质疏松型骨折及判断骨折愈合情况上有作用[4],但X线无法预估骨质疏松型骨折患者延迟愈合或不愈合风险。MRI-STIR序列能较好地反映骨髓信号异常,能有效鉴别骨折的良恶性病因[5],但对老年骨质疏松型骨折患者延迟愈合或不愈合的评估价值尚未完全明确,与之相关的作用机制有待探讨。因此,本研究选取我院2016年2月至2018年6月收治的老年骨质疏松性椎体压缩性骨折患者作为研究对象,采用MRI-STIR检查,现将研究结果报道如下。
1 资料与方法
1.1 一般资料选取医院2016年2月至2018年6月收治的老年骨质疏松性椎体压缩性骨折患者100例。根据MRI-STIR是否出现黑色现象信号作为分组标准,其中未出现中央线性低信号区为A组(46例),出现中央线性低信号区为B组(54例)。A组患者中男性21例,女性25例,年龄51~72岁,平均年龄(63.69±4.21)岁,骨密度30~61 mg/cm3,平均骨密度(43.58±6.28)mg/cm3;累及胸椎38例,腰椎8例。B组患者中男性25例,女性29例,年龄51~72岁,平均年龄(63.63±4.28)岁,骨密度32~68mg/cm3,平均骨密度(43.52±6.24)mg/cm3;累及胸椎36例,腰椎18例。两组患者一般资料差异比较无统计学意义(P>0.05),具有可比性。诊断标准[6]:所有患者均满足全国中西医结合骨伤科学研讨会制定的老年骨质疏松型骨折相关标准。纳入标准:知情同意;自愿参加;病案信息完整;接受PVP手术治疗;单体骨折。排除标准:粉碎性骨折;对骨水泥过敏患者;严重心血管病变患者;合并各种恶性肿瘤患者。
1.2 方法检查方法:所有患者均接受MRI-STIR检查,采用GE signa HDxt 1.5T磁共振型开放式的MR,使用体部线圈对两组患者进行检查,矩阵256×256。扫描厚度4mm,层间隔1mm。开启SE序列矢状位T1WI、T2WI序列,横断面T2WI序列。注射对比剂后开启增强扫描SE序列,行T1WI矢状位、冠状位、轴位扫描。将图像送至工作站,判断影像学特征。
手术方法:所有患者均接受单侧椎弓根穿刺治疗,选取俯卧过伸位,C臂透视下记录椎体弓根体位置,局部麻醉,经双侧椎弓根穿至骨折椎体后的1/3处,抽针芯及置入导针,满意后套入工作管套,注入骨水泥,凝固后拔除套管。
基础信息:统计两组患者基线资料。术前及随访3d评价患者的疼痛及腰椎神经功能。术前及随访3个月检测患者压缩椎体前缘与椎体后缘高度比及Cobb角。统计两组患者术后骨水泥渗漏情况(有、无)及弥散度情况(良好、不佳)。随访6个月采用X线评价两组患者延迟愈合或不愈合情况。骨折疼痛情况参考视觉模拟评分标准(VAS)评价,评分越高,表示疼痛越严重。腰椎神经功能采用日本矫形外科协会评分(JOA)标准评定。
1.3 统计学方法患者所有资料采用SPSS 27.00软件处理,符合正态分布的计量资料包括年龄、VAS评分、JOA评分、Cobb角等以()表示,较采用t检验;患者计数资料包括性别、骨水泥渗漏情况、弥散度情况(良好、不佳)、MRI-STIR征象采用以百分比表示,其中性别比较采用χ2检验,临床疗效采用秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者VAS、JOA评分比较术前两组患者VAS、JOA评分差异比较无统计学意义(P>0.05),术后VAS评分降低,JOA评分增加,其中B组患者VAS评分、JOA评分高于A组(P<0.05),见表1。
表1 两组患者VAS、JOA评分比较(,分)

表1 两组患者VAS、JOA评分比较(,分)
2.2 两组患者高度比及Cobb角比较术前两组患者高度比及Cobb角差异比较无统计学意义,术后高度比增加,Cobb角减小,其中B组患者高度比大于A组(P<0.05),Cobb角小于A组(P<0.05),见表2。
表2 两组患者高度比及Cobb角比较()

表2 两组患者高度比及Cobb角比较()
2.3 两组患者骨水泥渗漏及弥散度情况比较B组骨水泥渗漏率、弥散度不佳率高于A组(P<0.05),骨水泥无渗漏率、弥散度良好率低于A组(P<0.05),见表3。

表3 两组患者骨水泥渗漏及弥散度情况比较[n(%)]
2.4 两组患者MRI-STIR征象比较AB两组椎体病灶分布、骨折椎体形态、MRI-STIR信号变化、椎旁肿块信号变化、邻近椎体信号变化差异比较有统计学意义(P<0.05),见表4。
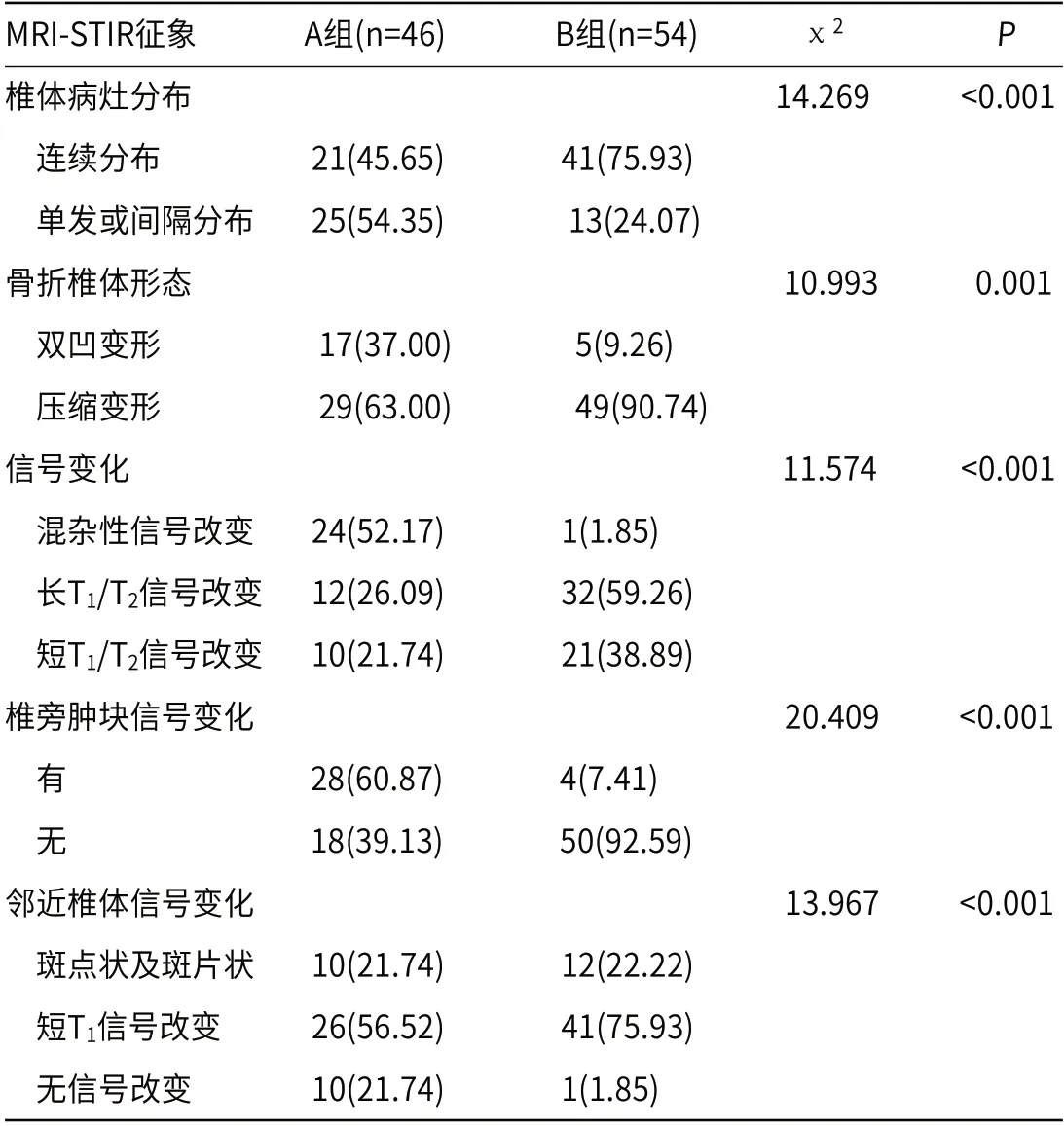
表4 两组患者MRI-STIR征象比较[n(%)]
2.5 两组患者延迟愈合、不愈合情况比较B组延迟愈合率、不愈合率高于A组(P<0.05),见表5。

表5 两组患者延迟愈合或不愈合情况比较比较[n(%)]
2.6 老年骨质疏松型骨折患者延迟愈合或不愈合MRI-STIR信号特征分析B组54例患者MRI-STIR出现黑色线性信号,主要表现为T1低信号,T2及STIR高信号,且边界清楚。41例椎体病灶连续分布的患者T2加权表现为低信号,STIR表现为高信号。39例压缩性变形的患者表现为T1加权低信号,T2高信号,STIR高信号,边界清楚。35例骨水泥渗漏患者黑色线信号弥散情况不佳。详情见图1。
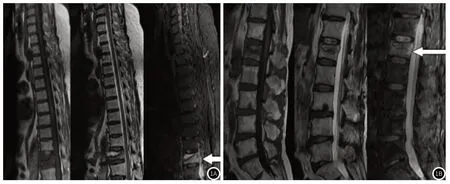
图1 MRI特征图。图1A:T1显示椎体楔形改变,T1低信号,T2高信号,STIR黑色线性信号;图1B:出现楔形改变,见斑片状异常信号,T1低信号,T2高信号,STIR出现斑片状混杂黑色线性信号。
3 讨 论
老年骨质疏松型骨折与高龄、骨密度、撞击力等有关。随着年龄的增长,机体骨密度下降,椎体小梁骨变细及数量减少[7]。骨小梁在压力的作用下会出现局部碎裂,形成老年骨质疏松型骨折。有文献报道[8],7%~30%老年骨质疏松型骨折患者在术后会出现延迟愈合或不愈合现象,严重影响手术效果,降低老年患者生活质量。老年骨质疏松型骨折延迟愈合或不愈合影响因素较多,包括骨折类型、病灶分布等[9]。双凹状椎体变形是一种较特别的老年骨质疏松型骨折类型,影像学具有双凹状变化、鱼脊骨的特点[10]。压缩性骨折在老年骨质疏松型骨折延迟愈合或不愈合中常见[11],其形成原因是骨折后机体受重力作用导致参与骨质破裂向四周移位导致变形。钟远鸣等[12]认为椎体后缘外凸是恶性骨折的征象,术后常出现延迟愈合或不愈合问题。MRI-STIR信号是椎体内真空裂隙征的一种特殊类型[13],其形成与骨缺血性坏死密切相关。MRI-STIR征象脂肪抑制影像能抑制椎体内脂肪信号,故能较好地表现水肿、骨碎信号。MRI-STIR信号改变的原因目前还没有明确定论,可能与新鲜骨折时椎体内存在水肿信号有关。有报道发现,MRI-STIR信号改变呈黑色线性信号时患者椎体骨折往往较难愈合,会出现骨折延迟愈合或不愈合现象[14]。因此,MRI-STIR信号改变能作为预测老年骨质疏松型骨折延迟愈合或不愈合重要指标。
本研究认为,MRI-STIR信号改变与骨小梁损伤部位的脂肪含量及脂肪变性程度有关。骨折部位的脂肪会在一定程度上阻止骨折愈合。分析发现,出现黑色线性信号B组将患者术前VAS、JOA情况与A组相同,但术后VAS、JOA评分较高(P<0.05),说明MRI-STIR信号改变患者术后疼痛较明显,腰椎神经功能较差。B组患者压缩椎体前缘与椎体后缘高度比大,Cobb角小,说明MRI-STIR信号改变患者术后腰椎具体形态改变情况不及未出现MRI-STIR信号改变的患者。同时,B组患者骨水泥渗漏及弥散度情况较差,提示MRI-STIR信号改变可提示手术效果。进一步分析发现,B组患者MRI-STIR征象较典型,主要包括椎体病灶分布、骨折椎体形态、MRI-STIR信号变化、椎旁肿块信号变化、邻近椎体信号变化。临床可通过分析骨折椎体形态、MRI-STIR信号变化、椎旁肿块信号变化、邻近椎体信号变化等信号特征判断老年骨质疏松型骨折术后延迟愈合或不愈合的可能性。最后B组患者延迟愈合、不愈合情况多。
综上所述,MRI-STIR信号改变能作为预测老年骨质疏松型骨折术后延迟愈合或不愈合重要征象,临床应密切观察黑色线性信号患者,制定个性化、针对性治疗方法,以预防术后延迟愈合或不愈合。

