DCE-MRI与MSCT在子宫颈癌患者临床分期中的诊断价值
平煤神马医疗集团总医院放射科(河南 平顶山 467000)
韩 超* 陈新晖
子宫颈癌是最常见的妇科恶性肿瘤,其中原位癌多发于30~35岁,浸润癌多发于45~55岁,其发病考虑与HPV感染、多性伴、初产年龄小、多孕多产、沙眼衣原体、单纯疱疹病毒Ⅱ型、滴虫等感染和吸烟等因素有关[1-2]。近年来,随着环境污染和工作压力的增大,子宫颈癌发病逐渐呈年轻化的趋势,且发病率逐渐增高,严重威胁女性健康。手术是目前治疗早期子宫颈癌的主要方法,故术前诊断与分期对子宫颈癌治疗方式选择及预后具有重要意义[3-4]。临床目前常采用体格检查,并联合双合和三合诊、胸片、膀胱镜及直肠镜检查进行综合判断,然后进行分期,但对盆壁和膀胱直肠壁侵犯、宫旁受累及淋巴转移难以明确,故存在一定的局限性,从而影响准确性[5]。近年来随着影像学技术的发展,DCE-MRI与MSCT逐渐在宫颈癌诊断、分期及放化疗的疗效评价中得以应用。其中动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)是功能性成像方法,可评价病变组织的形态学和血供特征,通过注射对比剂并连续扫描获得MRI图像从而显示肿瘤形态学信息,并可观察肿瘤供血情况,为临床提供重要参考价值[6]。而多层螺旋CT(multi slice compulted tmography,MSCT)具有高分辨率、直观性较强的优点,可多期扫描,观察肿瘤生长情况,对临床分期诊断具有一定价值[7]。为进一步明确两者诊断价值,本研究将DCE-MRI与MSCT应用于子宫颈癌患者临床分期中,以期为临床治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2017年5月至2019年4月本院收治的并经病理学证实的60例子宫颈癌患者的临床资料,纳入标准:所有患者均经病理学证实;年龄28~75岁;均行MSCT增强和DCE-MR检查;临床资料完整者。排除标准:合并其他恶性肿瘤者;合并心、肺等器官严重衰竭及血液系统性疾病患者;临床资料不完整者;对本研究依从性较差,难以配合;妊娠及哺乳期妇女;合并其他肿瘤者。所有患者均为女性,年龄28~75岁,平均年龄(51.87±6.02)岁;其中鳞癌49例,腺癌11例。患者主要症状为阴道不规则出血和排液,年轻患者表现为接触性出血。
1.2 研究方法DCE-MRI检查:采用Siemens Avanto 1.5T超导型磁共振扫描仪,采用TORSO8通道相控阵线圈。常规扫描序列为横断面SE T1WI,矢状面和横断面脂肪抑制序列TSE T2WI。成像参数:矩阵304×512,层厚5~7mm,层间距0.5~1.0mm,三期扫描开始采用高压注射器以3.0mL/s的速度经肘静脉注入Gd-DTPA 0.1mmoL/kg,然后注入生理盐水20mL冲洗管道,采集时间为280s,然后行横断面、矢状面及冠状面T1WI延迟增强扫描。
MSCT检查:采用64排螺旋CT扫描仪,嘱咐患者憋尿充盈膀胱,取仰卧位,扫描范围:耻骨联合下缘向上至髂脊。扫描参数:管电压120kV,管电流200~300mA,层厚5~10mm,螺距1,重建间隔0.5~2.5mm。平扫后以3.0~4.0mL/s的速度经肘静脉高压注射造影剂碘海醇80~100mL,并启动计算机造影示踪技术,在腹主动脉CT值达到设置阈值的170~180HU后进行动脉期扫描。并延迟65s后扫描实质期,延迟3~4min使膀胱和输尿管成像。
由两名经验较为丰富的影像学医生判读图像,意见不同时经讨论达成共识。根据2018面宫颈癌FIGO分期标准进行分期[8]。ⅠA期:病灶浸润深度<5mm,ⅠB期:病灶浸润最大进入深度≥5mm,病变位于子宫颈;ⅡA期:病灶超过子宫,单位在子宫旁周围组织浸润;ⅡB期:病灶向宫颈外组织浸润,宫颈旁脂肪间隙欠清,但未侵犯骨盆壁或阴道下部;ⅢA期:肿瘤累及阴道下三分之一,且未扩张到骨盆壁;ⅢB期:瘤体扩展到骨盆壁,或盆腔淋巴结、腹主动脉旁淋巴结转移;Ⅳ期癌播散超出盆腔或直肠黏膜。
1.3 统计学方法选用统计学软件SPSS 20.0对研究数据分析和处理,计数资料采取率(%)表示,行χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 手术病理确诊结果术后组织病理学检测ⅠA期2例,ⅠB期10例,ⅡA期20例,ⅡB期15例,ⅢA期7例,ⅢB期5例,ⅣA期1例。
2.2 DCE-MRI在子宫颈癌患者临床分期结果与病理结果比较DCE-MRI诊断宫颈癌ⅠA期的准确率为50.00%,诊断ⅠB期的准确率为90.00%,诊断ⅡA期的准确率为85.00%,诊断ⅡB期的准确率为86.67%,诊断ⅢA期的准确率为87.50%,诊断ⅢB期的准确率为80.00%,诊断ⅣA期的准确率为0.00%,见表1。
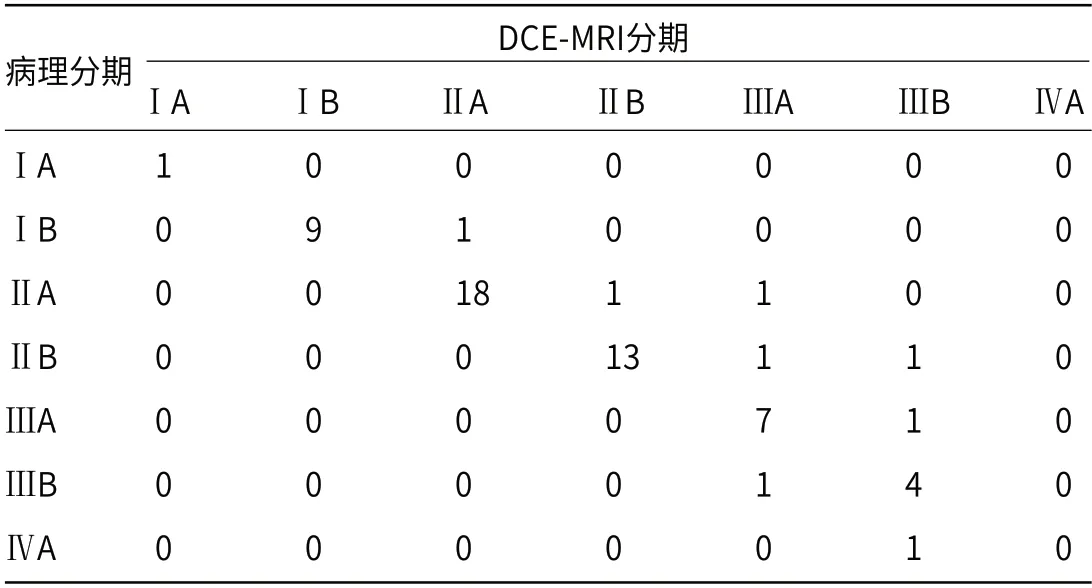
表1 DCE-MRI在子宫颈癌患者临床分期结果与病理结果比较(例)
2.3 MSCT在子宫颈癌患者临床分期结果与病理结果比较MSCT诊断宫颈癌ⅠA期的准确率为0,诊断ⅠB期的准确率为80.00%,诊断ⅡA期的准确率为80.00%,诊断ⅡB期的准确率为80.00%,诊断ⅢA期的准确率为71.43%,诊断ⅢB期的准确率为60.00%,诊断ⅣA期的准确率为0,见表2。
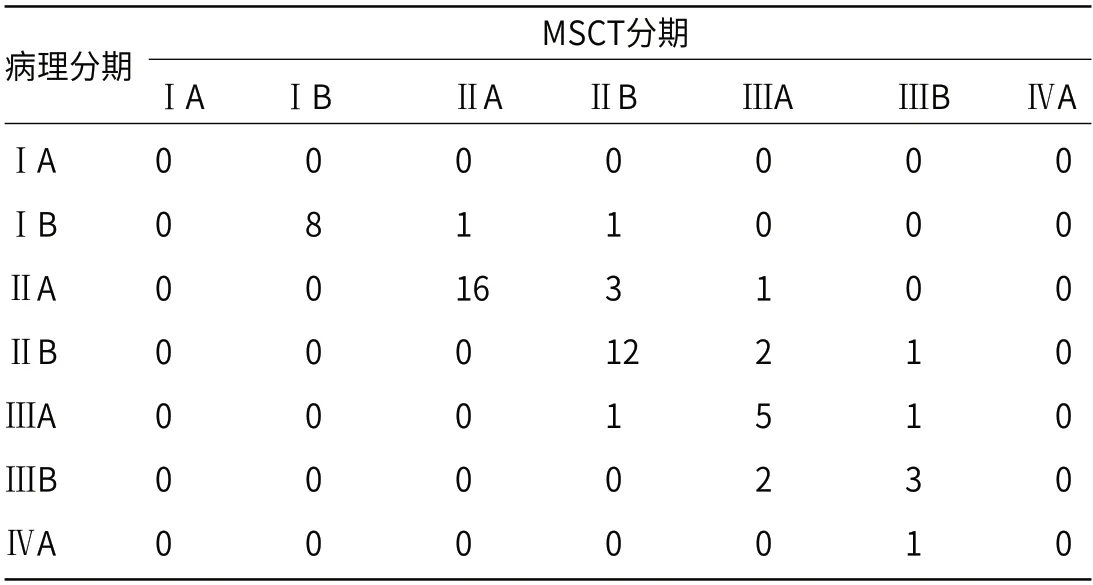
表2 MSCT在子宫颈癌患者临床分期结果与病理结果比较(n)
2.4 DCE-MRI与MSCT在子宫颈癌患者临床分期中的诊断准确性比较DCE-MRI在子宫颈癌患者临床分期中的诊断准确率为86.67%,灵敏度为86.89%,特异度为88.17%,MSCT在子宫颈癌患者临床分期中的诊断准确率为73.33%,灵敏度为72.13%,特异度为72.88%。DCE-MRI在子宫颈癌患者临床分期中的诊断准确率、灵敏度为及特异度均高于MSCT(P<0.05),见表3。
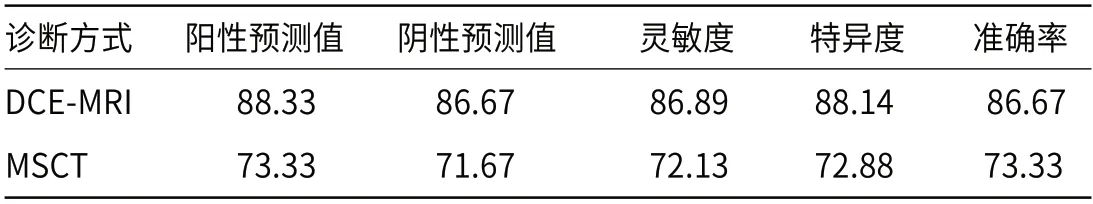
表3 DCE-MRI与MSCT在子宫颈癌患者临床分期中的诊断准确性比较(%)
2.5 典型病例影像分析典型病例影像分析结果见图1~图2。
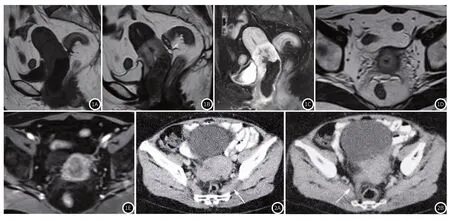
图1 为子宫颈鳞癌Ⅱb期,女,56岁,图1A、1B为T1WI、T2WI图像,1C为DCE-MRI延迟期矢状图,示宫颈壁环状不规则增厚,子宫下部和阴道穹隆部受侵;图1D、1E分为增强动脉期和静脉期横断位图像,显示宫颈壁增高及信号不均匀。图2 子宫颈鳞癌Ⅱb期,女,35岁,图2A为CT增强横断面,显示宫颈增大,且不均匀强化,左侧梨状肌增厚,不均匀强化(如箭头所示);图2B为CT增强扫描,可见右侧子宫骶骨韧带增厚(如箭头所示)。
3 讨 论
子宫颈癌是女性生殖器常见的恶性肿瘤,其发病率仅次于乳腺癌,已成为影响女性健康的主要疾病之一[9]。近年来子宫颈癌发病率呈低龄化,且病情复杂。据资料显示,我国每年新发病例约10万人,其中死亡率约3万人[10]。故对其进行早分期、治疗对降低宫颈癌危害程度具有重要意义。临床过去主要通过专科检查和宫颈细胞活检进行临床分期,但难以明确肿瘤范围及深度,目前临床常采用DCE-MRI与MSCT检查,本研究进一步探讨其诊断价值,以期为临床选择最佳治疗方案。
FIGO是临床常用分期方法,主要根据体格检查,并结合相关检查进行评价,但准确度较低,据相关报道显示,与手术病理分期相比,FIGO对宫颈癌Ⅰ期患者的临床分期误诊率为22.0%,Ⅱ~Ⅳ期达65%[11]。MSCT可一次屏息整个器官或部位,并可减少运动伪影,任意性重建图像不受层间隔大小约束,具有较高空间和密度分辨率,可清晰观察淋巴结形态及周围组织的关系,且能够获得亚毫米层厚的数据,通过三维重建可多角度、多方位观察宫颈病变,显示局部解剖结构和病灶浸润范围,克服了单纯横断面图像的不足。同时能够通过注射造影剂增强病变组织显示效果[12]。DCE-MRI对宫颈癌检出率较为敏感,在注射磁共振对比剂前、中、后连续获得磁共振图像,可显示与病灶及与周围组织关系,反映肿瘤组织血供状态,并通过对图像采集、处理,可记录信号强度变化,显示宫颈病变,反映病灶血供变化和血管分布情况,以了解基质受侵程度。其序列主要包括T2WI和T1WI,前者对血管内对比剂敏感,可反映血管容量和病变程度;后者对血管外细胞间隙内对比剂敏感,可反映血管渗透性和灌注,有利于进行定量分析[13]。本研究结果显示,DCE-MRI在子宫颈癌患者临床分期中的诊断准确率、灵敏度为及特异度均高于MSCT,提示DCEMRI诊断子宫颈癌患者临床分期的价值优于MSCT,而MSCT可作为子宫颈癌分期较好的辅助诊断方式。而>ⅢA期的准确率降低,考虑其原因可能为与肿瘤的转移和浸润有关,存在一定局限性。本研究的临床分期病理样本量较少,可能存在一定误差,故临床下一步研究应扩大样本量,从而为临床提供参考。
综上所述,DCE-MRI与MSCT均可为子宫颈癌患者临床分期提供参考,且DCE-MRI诊断价值优于MSCT,值得临床推广应用。

