城市剩余污泥基吸附剂对水中两种喹诺酮类抗生素的去除
陶虎春 宫一玮 张丽娟 丁凌云 张善发
深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055;† E-mail: taohc@pkusz.edu.cn
由于抗生素的广泛使用和不间断排放, 全球范围内的水环境中都能检测到抗生素污染[1]。在众多抗生素中, 喹诺酮类药物的稳定性较好, 能够穿透河流和湖泊到达地下水层[2]。通常, 环境中喹诺酮类抗生素的浓度为 ng/L 至 mg/L 水平, 其来源主要为养殖业、医院和制药企业的废水。据报道, 印度制药厂的废水中环丙沙星浓度高达 31 mg/L[3]。
水环境中的抗生素污染物会导致环境中抗性基因增加, 最终对人类的健康产生严重的威胁, 主要表现在以下 3 个方面。1) 最常见的抗生素不再能有效地控制传染病[4], 某些细菌感染变得很难治愈[5]。2)饲养畜禽的抗生素通过食物链传播抗性, 导致人体内抗生素耐药性的积累和增加, 特别是对儿童将产生严重的影响[6]。3) 因抗性基因转移的相互作用环境微生物的组成发生变化, 其中喹诺酮类抗生素可通过急性或慢性作用破坏生态系统[7]。
吸附是控制抗生素废水污染的主要方法。活性炭是工业规模上水和空气净化应用最广泛的吸附剂之一[8], 但合成生物炭的成本较高。城市剩余污泥是市政废水处理过程中的主要副产物, 大量城市剩余污泥的产出已经成为严重的环境和社会负担, 资源化利用的需求迫切。因此, 以城市剩余污泥为原料制备吸附剂来去除水中的抗生素污染物, 具备原料易得、成本低廉、操作便捷等优点, 能够实现良好的经济效益、社会效益和环境效益。
本研究以深圳市某污水处理厂剩余污泥为原料, 通过水解碳化和改性, 制备成吸附剂, 以喹诺酮类抗生素环丙沙星(Ciprofloxacin, CIP)和洛美沙星(Lomefloxacin, LOM)为目标污染物, 研究城市剩余污泥基吸附剂对两种抗生素的去除效能。
1 材料与方法
1.1 实验材料
城市剩余污泥来源于深圳市某污水处理厂。主要试剂: 分析纯硝酸(HNO3)、氢氧化钠(NaOH)和过氧化氢(H2O2)购自阿拉丁(试剂)上海有限公司,98% 环丙沙星和 98% 洛美沙星盐酸盐购自北京百灵威科技有限公司。
1.2 实验设备
实验设备: A124S 分析天平(德国Sartorius), HZQX500C 恒温振荡器(上海一恒科学仪器有限公司),Talboy 数显型磁力加热搅拌器(美国 Henry Troemner LLC), IE438PH 计(瑞士 Mettler), DR-6000 紫外可见分光光度计(美国 HACH), Nicolet 6700 傅里叶变换红外光谱仪(美国 Thermo)和 ZEISS SUPRA®55 扫描电子显微镜(德国 Carl Zeiss)。
1.3 实验方法
1.3.1 吸附剂的前处理及改性
剩余污泥经 120~180℃, 2~6 小时的热水解碳化工艺流程后, 得到含水率约 25%的干泥, 经 105℃烘箱干燥 24 小时脱水, 在玛瑙研钵中研磨 30 分钟,通过 2 mm 筛孔, 在 4℃、避光的条件下保存备用,得到部分碳化的污泥基生物炭土, 称为污泥基吸附剂(Sewage sludge adsorbent, SSA)。
配置浓度分别为 0.1, 1 和 5 M 的 NaOH 溶液, 浓度分别为 0.1, 1 和 5M 的 HNO3溶液以及浓度分别为10%, 20%和 30%的 H2O2溶液, 作为改性溶液。SSA 和改性溶液以 1:50 的比例混合, 在 30℃下搅拌4 小时。经洗涤、干燥、研磨后, 将样品过 2 mm 筛孔, 备用。改性后的吸附剂分别标记为 0.1MNaOH-SSA, 1M-NaOH-SSA, 5M-NaOH-SSA, 0.1MHNO3-SSA, 1M-HNO3-SSA, 5M-HNO3-SSA, 10%-H2O2-SSA, 20%-H2O2-SSA 和30%-H2O2-SSA。
1.3.2 吸附剂的表征
利用扫描电子显微镜(scanning electron microscopy, SEM) 和傅里叶红外转换光谱(Fourier transform infrared spectroscopy, FTIR) 分析吸附剂表面形貌及官能团组成。吸附剂的零电荷点值(pHpzc)采用Carabineiro 等[9]的方法测定。
1.3.3 吸附实验
配置浓度为 10 mg/L 的抗生素溶液, 超声波振荡 10 分钟至完全溶解, 选取改性后的吸附剂样品,以 1 g/L 的比例加入 50 mL 抗生素溶液中, 于 170 r/min、30℃、避光条件下震荡 4 小时, 使样品经 0.22 μm 膜过滤, 测定溶液中抗生素的浓度。选用吸附效果最好的吸附剂进行后续实验。
通过单因素控制实验, 分别探究吸附剂投加量、温度、溶液 pH 和离子浓度对吸附效果的影响。首先在溶液初始 pH 为 6.5 的情况下, 改变吸附剂投加量(0.05, 0.125, 0.25, 0.5, 1, 2.5, 5 和 10 g/L),于 170 r/min、30℃和避光条件下震荡 4 小时, 确定最佳吸附剂投加量。采用最佳吸附剂投加量, 分别在 20, 30, 40 和 50℃条件下进行吸附实验, 其他条件与上述实验一致。采用最佳吸附剂投加量和最佳反应温度, 调节溶液初始 pH 值分别至 1.0, 3.0, 5.0,7.0, 9.0, 11.0 和 13.0 进行吸附实验, 其他条件同上。在最佳吸附剂投加量、最佳温度和最佳 pH 值条件下, 分别使用浓度为 0.00, 0.05, 0.1 和 0.2 M 的NaCl 和 CaCl2溶液调节离子强度进行吸附实验, 其他条件同上。
在最佳吸附条件下, 分别在 10, 20, 30, 60, 120,180, 240, 300, 480, 720 和 1440 分钟取样, 探究吸附剂对两种抗生素的吸附过程随时间变化的规律。采用准一级动力学和准二级动力学模型对实验数据进行拟合。
配置浓度为 20 mg/L 的抗生素溶液, 超声波振荡溶解后, 依次稀释至 2, 5, 8, 10, 12, 14, 16 和18 mg/L, 吸附剂投加量为 1 g/L, 在 30℃条件下, 对CIP 和 LOM 进行等温吸附, 用 Freundlich 和 Langmuir 吸附等温模型对实验数据进行拟合。
1.3.4 材料循环利用
每次完成吸附实验后, 将吸附剂从溶液中离心分离, 用 0.01 M NaOH 溶液对吸附剂进行反复洗脱,直到洗脱液中检测不到目标抗生素为止。用去离子水洗涤, 去除吸附剂表面残留的洗脱液。将洗脱后的吸附剂置于 60℃环境下干燥 12 小时, 收集并再次用于 CIP 和 LOM 吸附实验。
1.4 分析与计算方法
采用紫外分光光度计法测定喹诺酮类抗生素的浓度, 分别利用 274 和 286 nm 处的吸光度测定环丙沙星(CIP)和洛美沙星(LOM)的浓度。
吸附剂对水溶液中喹诺酮类抗生素吸附容量(q)和去除率(removal efficiency)的计算公式分别为
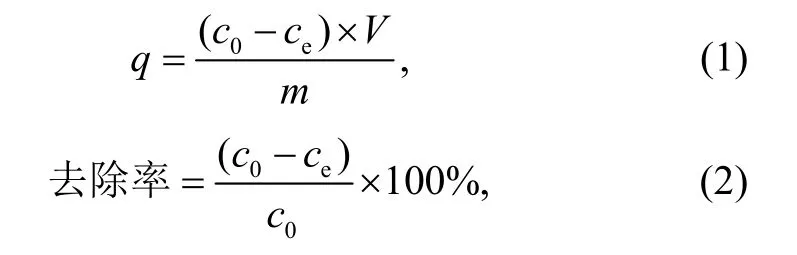
式中,c0表示初始质量浓度(mg/L),ce表示平衡质量浓度(mg/L),V表示抗生素溶液体积(L),m表示吸附剂添加量(g)。
2 结果与讨论
2.1 改性后吸附剂的效能比较
改性条件对吸附剂性能的影响如图 1 所示。总体而言, 吸附剂的吸附效果取决于改性溶液的种类和浓度。与未改性的吸附剂相比, 经低浓度 NaOH或低浓度 HNO3改性后的吸附剂对 CIP 和 LOM 的吸附效果有显著提高, 优于高浓度改性溶液的效果。3 种浓度的 H2O2改性对吸附效果的影响均不显著。吸 附 效 果 为 0.1M-HNO3-SSA>0.1M-NaOH-SSA>1M-HNO3-SSA>1M-NaOH-SSA>5M-HNO3-SSA>SSA。后续选用效果最佳的 0.1M-HNO3-SSA (HSSA)进行吸附实验, 其对 CIP 和 LOM 的去除率分别可达90%和 73%, 是未改性吸附剂的 2.18 和 2.43 倍。
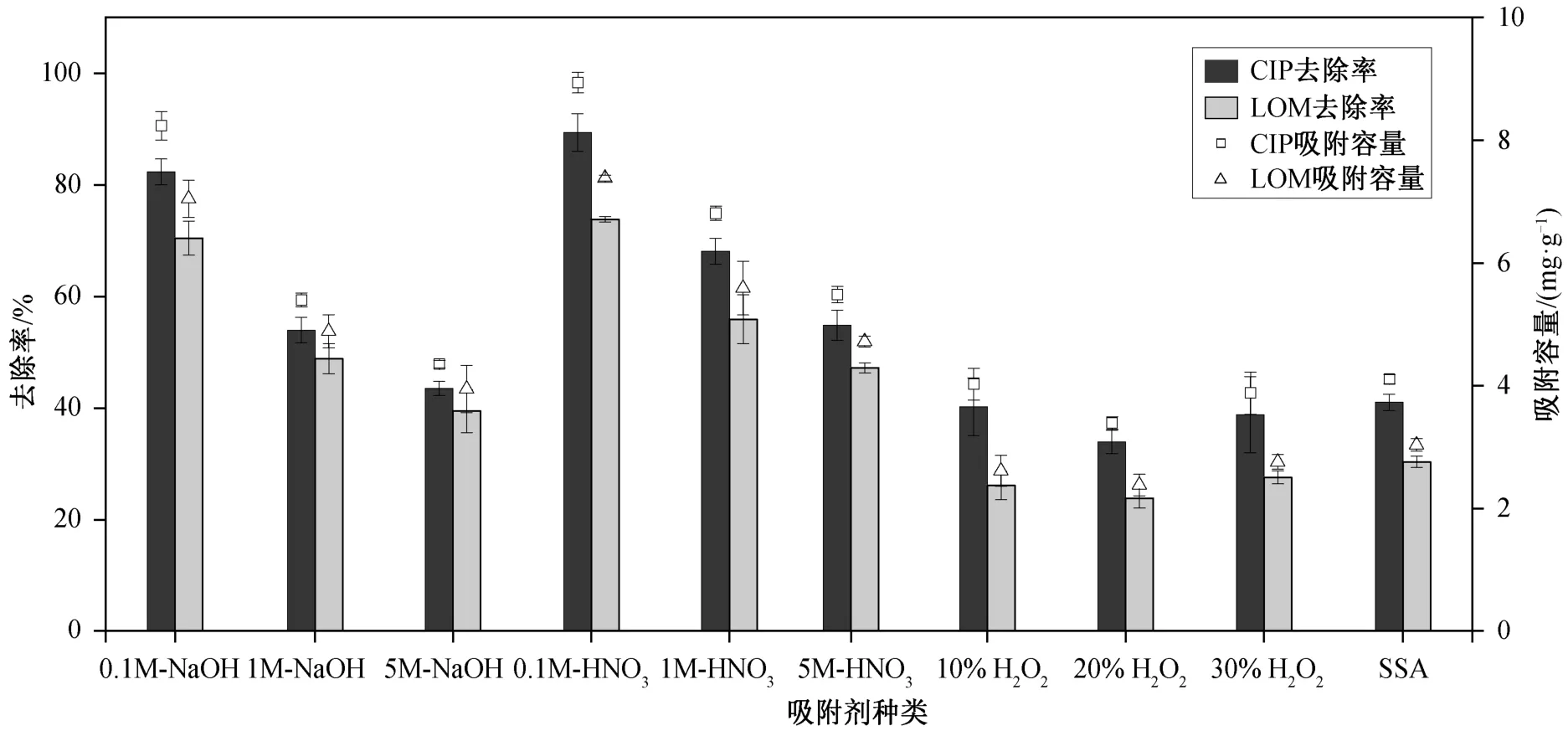
图1 吸附剂的吸附效果对比Fig. 1 Comparison of adsorption effect of adsorbents
SSA 和经 0.1M HNO3改性后得到的 HSSA 的SEM 结果见图 2 。图 2(a)和(b)分别为 SSA 和 HSSA的表面形貌, 可以观察到 SSA 呈片状和块状, 表面较为平整, 而改性后的 HSSA 表面呈颗粒状, 粗糙度增加。图 2(c)和(d)为 HSSA 的局部细节放大, 可以观察到吸附剂表面还有许多空腔和孔状结构, 可为抗生素的吸附提供更多的位点。
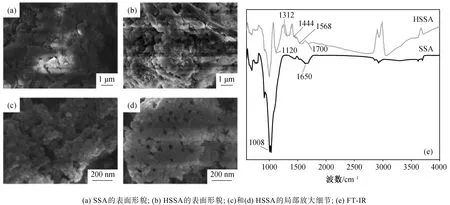
图2 改性前后吸附剂的SEM 和FT-IR 对比Fig. 2 Comparison of SEM and FT-IR of adsorbents before and after modification
SSA 和 HSSA 的 FT-IR 结果见图 2(e)。SSA 谱显示, 在 1008 cm-1处和 750 ~ 500 cm-1处的峰归因于 Si―O―Si 和 Si―O 的伸缩振动, 1650 cm-1处的峰是芳环上 C=C 的伸缩振动。与 SSA 相比, 改性后 HSSA 的表面官能团发生变化。1008 cm-1处的吸收峰振动强度减弱, 表明改性去除了部分矿物,1120 cm-1处是醇中 C―O 的伸缩振动峰, 1312 cm-1处的峰为芳香族或乙烯基醚的 C―O 伸缩振动造成,1460~1444 cm-1处的峰对应 C=O 和 O―C =O 官能团, 1568 和 1700 cm-1处的波动是由羰基或羧基中C=O 的伸缩振动产生[10-12]。可见, 酸改性增加了吸附剂含氧官能团含量, 而含氧官能团可以通过形成氢键增强对水中有机物的吸附[13-14]。
2.2 影响HSSA 吸附CIP 和LOM 的因素
2.2.1吸附剂投加量的影响
HSSA 投加量对抗生素去除率影响如图 3 所示。随着吸附剂与抗生素质量比值不断增加, CIP 和LOM 的去除率逐渐升高, 当 HSSA 的投加量为 1 g/L 时, 吸附剂对 CIP 和 LOM 的去除率分别达到87%和 70%, 随后增长缓慢。当吸附剂投加量达到10 g/L 时, 吸附剂对 CIP 和 LOM 的去除率分别为95%和 77%。高剂量的吸附剂可能引起颗粒聚集,降低单位质量吸附剂的比表面积, 导致吸附质的扩散路径增加, 从而使单位质量吸附剂的吸附能力降低, 吸附剂上的有效位点得不到充分的利用[15]。由于 HSSA 具有非均质性, 活性中心分布不均匀, 所以增加投加量并不能一直显著地提高吸附效果[16]。综合考虑去除效果和成本, 选用最优吸附剂投加量为 1 g/L。
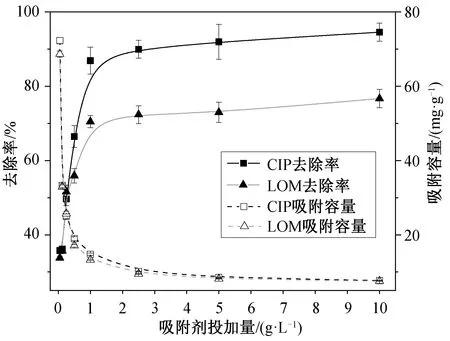
图3 吸附剂投加量对吸附的影响Fig. 3 Effect of HSSA dosage on adsorption
2.2.2 溶液温度对吸附的影响
CIP 和 LOM 的去除率随温度的变化如图 4 所示。当温度从 20℃升至 30℃时, 去除率上升, 然后随着温度的进一步升高, 吸附率呈下降趋势。原因可能是因为低温时抗生素分子的动能较低, 与吸附剂的接触较少, 导致较低的去除率; 温度升高后,抗生素分子的运动加速, 同时加速解吸过程, 导致吸附能力下降。当溶液温度为 30℃时, 吸附剂对 CIP和 LOM 的去除率最高, 分别为 87.89%和71.77%。
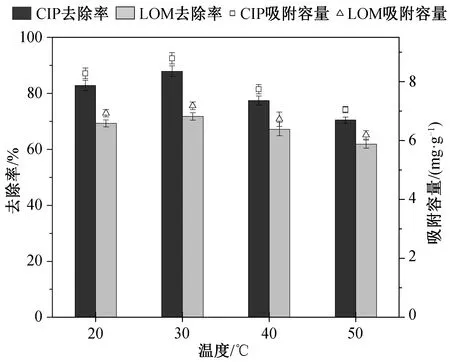
图4 溶液温度对吸附性能的影响Fig. 4 Effect of solution temperature on adsorption
2.2.3 溶液初始pH值对吸附的影响
CIP 和 LOM 在不同 pH 的环境中可以以阳离子、两性离子和阴离子的不同形态存在, 所以 CIP或 LOM 在吸附剂上的吸附程度高度依赖溶液的pH (CIP[17]: pKa1=6.09, pKa2=8.74; LOM[18]: pKa1=5.38,pKa2=7.85)。吸附剂的 pHpzc值为 4.13。图 5 显示溶液初始 pH 值对 CIP 和 LOM 吸附情况的影响, 两者的变化趋势相似, 都是先增大、后减小, 在 pH 值5~9 范围内有较好的吸附效果, 作用机理相似。以CIP 为例, 当溶液 pH<6.09 时, CIP 的哌嗪胺基官能团发生质子化, 分子带正电, 以阳离子形式存在,溶液中的氢离子会与 CIP 阳离子竞争吸附剂上的吸附位点, 从而降低 HSSA 对 CIP 的有效吸附。随着pH 的不断升高, 溶液中 H+浓度降低, 竞争吸附减少, 吸附剂对 CIP 的吸附量逐渐增加。当 6.09<pH<8.74 时, CIP 主要以中性分子形态存在, 此时吸附剂对它的吸附量达到最大。随着 pH 的持续增加,CIP 分子中的羧基基团会脱去质子, 使分子带负电,由于吸附剂表面也带负电, 静电排斥作用使 CIP 的吸附量减少。

图5 pH 对吸附的影响Fig. 5 Effect of pH on adsorption
2.2.4 离子强度对吸附的影响
实际废水中往往含有较高浓度的盐, 溶液中的离子种类和浓度会对吸附效果产生影响。离子浓度对吸附剂吸附 CIP 和 LOM 的影响如图 6 所示。Na+的存在对吸附影响较小, 随着 Na+浓度由 0 升到 0.2 M, HSSA 对 CIP 的吸附去除率由 88%逐渐降至 75%, 对 LOM 吸附去除率由 72%降至 63%。溶液中 Ca2+对吸附的影响程度大于 Na+, 随着 Ca2+离子浓度升高, CIP 和 LOM 的吸附去除率分别降至 45%和 39%。推测是由于溶液中 Na+和 Ca2+占据了吸附剂表面的活性位点, 且较高的离子浓度减弱了吸附剂和抗生素之间的静电吸引力, 使得 HSSA对 CIP 和 LOM 的吸附效果降低。有研究表明, Ca2+可能与 CIP 和 LOM 分子形成螯合配合物, 从而限制抗生素分子与吸附剂之间氢键的生成[19], 导致Ca2+对吸附的抑制效果大于Na+。
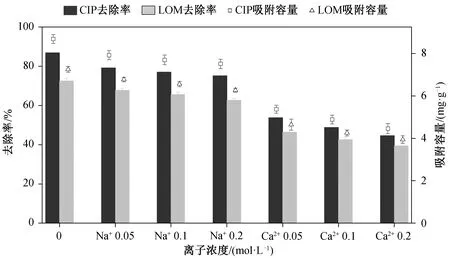
图6 离子浓度对吸附的影响Fig. 6 Effect of ions on adsorption
2.3 吸附动力学
吸附时间对 HSSA 吸附 CIP 和 LOM 的影响如图 7 所示。在吸附初始时, 由于吸附剂表面有大量的活性位点, HSSA 对 CIP 和 LOM 的吸附量随着时间的增加迅速增大。随着吸附作用的进行, 240 分钟后吸附量趋于平稳, 不再显著地增加, 吸附逐渐达到平衡。24 小时后, HSSA 对 CIP 的吸附量为 8.95 mg/g, 对 LOM 的吸附量为 7.28 mg/g。采用准一级动力学和准二级动力学模型[20]对实验结果进行模拟, 结果见表 1。准二级动力学模型对 CIP 和 LOM的拟合度>0.98, 拟合效果较好(准一级动力学模型拟合度在 0.83~0.97 之间)。由准二级动力学模型计算得出的饱和吸附量与实际吸附量较为接近, 说明HSSA 对溶液中的 CIP 和 LOM 的吸附更符合准二级动力学方程, 在吸附过程中控制吸附速率的主要是化学过程[21]。通过对比qm值, 可知 HSSA 对抗生素的吸附效果为 CIP>LOM。
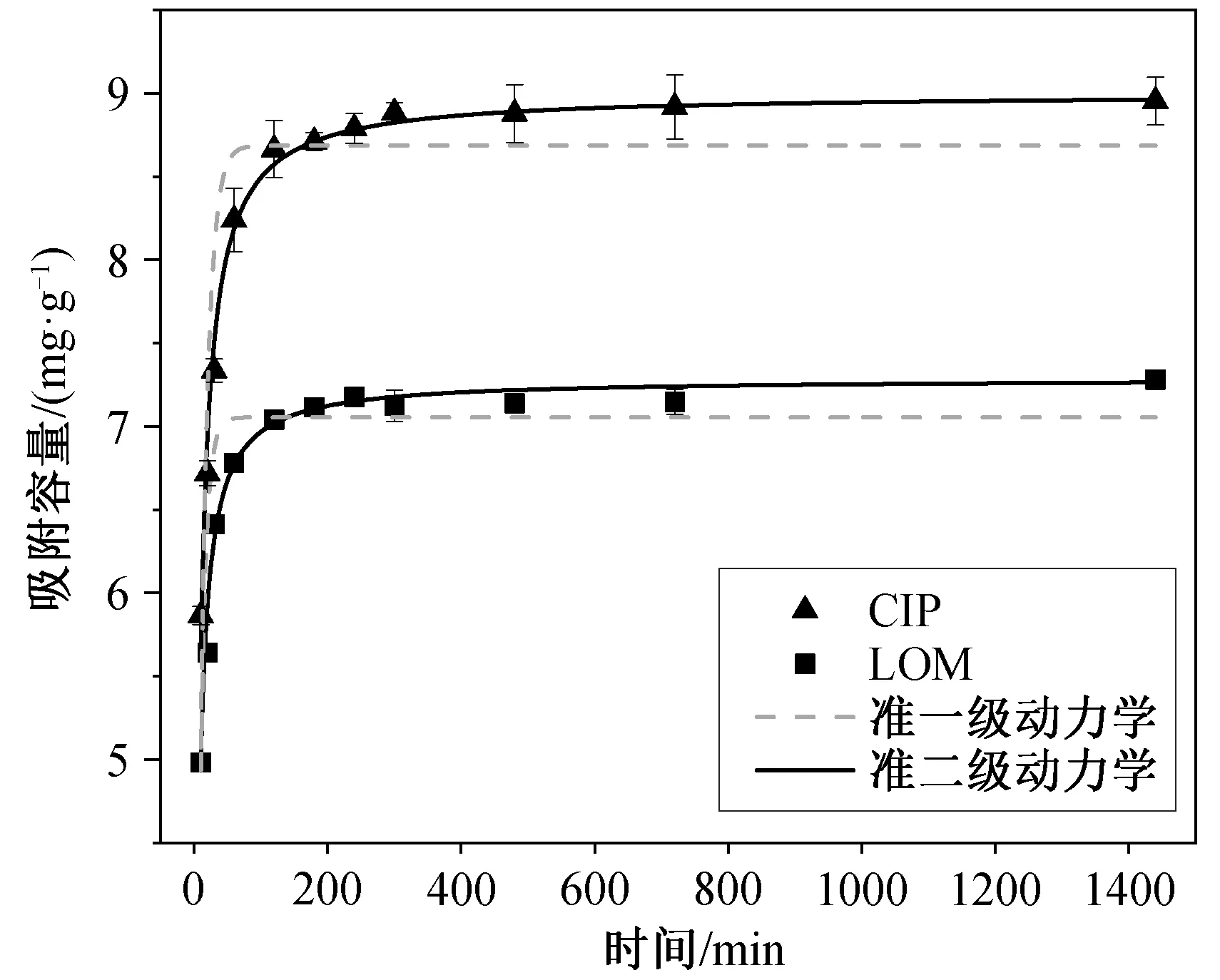
图7 吸附时间对CIP 和LOM 吸附的影响Fig. 7 Effect of adsorption time on adsorption of CIP and LOM

表1 HSSA 对CIP 和LOM 的吸附动力学参数Table 1 Kinetic parameters of CIP and LOM adsorption by HSSA
2.4 吸附等温线
CIP 和 LOM 的吸附等温线如图 8 所示。随着抗生素初始浓度的增加, 吸附剂的吸附容量不断提高。采用 Freundlich 和 Langmuir 吸附等温方程[22]进行拟合, 相关参数见表 2。可以看出, 两个方程均能描述吸附剂对 CIP 和 LOM 的吸附(R2>0.94)。但与 Freundlich 模型(R2<0.97)相比, Langmuir 模型具有更高的拟合效果,R2均大于 0.99, 表明 CIP 或LOM 分子是通过单层化学吸附而覆盖在 HSSA 表面[23]。通过 Langmuir 模型计算, HSSA 对 CIP 和LOM 的理论最大吸附容量分别为 20.48 和 13.01 mg/g。在 30~50℃范围内进行吸附热力学研究, CIP的吸附焓变 (-8.42 kJ/mol)小于 LOM (-3.41 kJ/mol),表明 HSSA 吸附 CIP 后的构型稳定性更高, 因此吸附剂对 CIP 有更高的吸附容量。

表2 不同温度下 HSSA 吸附 CIP 和 LOM 的吸附等温参数Table 2 Adsorption isothermal parameters of CIP and LOM by HSSA at different temperatures
2.5 再生性能
吸附剂的经济性是决定其在实际工程中能否被采用的重要评价指标。循环吸附实验结果如图 9 所示, 经 5 次循环后, HSSA 对 CIP 和 LOM 的去除率分别为 84%和 67%。与初次使用时相比, 5 次循环后的去除效率达到最大值的 96%和 92%, 表明 HSSA可通过使用低浓度碱再生的方法进行循环利用。再生方法操作简单、经济性好、重复利用率高, 因此HSSA 具有良好的应用前景。
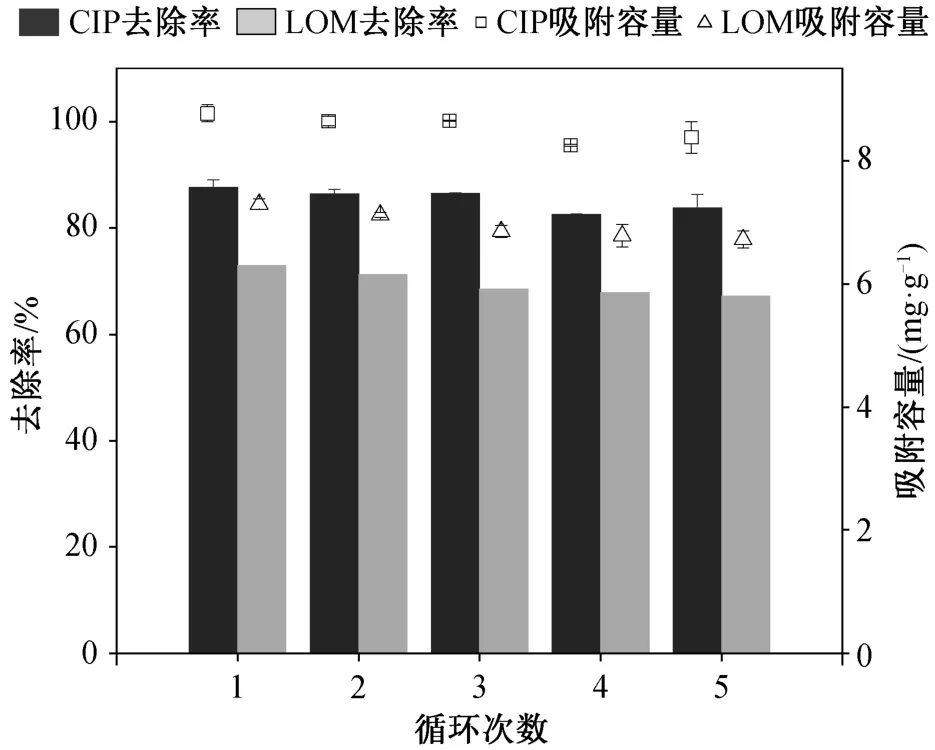
图9 5 次循环实验对 CIP 和 LOM 的吸附效果Fig. 9 Adsorption of CIP and LOM for five cycles
3 结论
本文以城市污水处理厂剩余污泥为原料, 制备改性污泥基吸附剂, 研究其对水溶液中环丙沙星(CIP)和洛美沙星(LOM)的吸附效果, 得出如下结论。
1) 污泥基吸附剂的最佳改性条件为: 污泥基吸附剂在 0.1 M HNO3溶液、30℃条件下搅拌 4 小时。改性后的吸附剂效能明显提升, 对 CIP 和 LOM 的去除率分别为 90%和 73%, 是未改性吸附剂的 2.18 和2.43 倍。
2) 最佳吸附条件为: 在抗生素初始浓度为 10 mg/L, 吸附剂投加量为 1 g/L, 反应温度为 30℃, pH为 7, 离子浓度为 0。此时, 吸附剂对 CIP 和 LOM的吸附量分别为 8.95 和 7.28 mg/g。
3) 吸附作用在 240 分钟内达到平衡, 吸附行为符合准二级动力模型, 等温吸附过程符合 Langmuir方程, 表明吸附剂表面被单分子层覆盖, HSSA 对CIP 和 LOM 的理论最大吸附容量分别为 20.48 和13.01 mg/g。
4) 经 5 次循环使用后, 吸附剂对 CIP 和 LOM 的去除率仍可达 84%和 67%。

