稳定表达荧光素酶BGC823细胞系的构建
王 琳, 张紫怡, 金 静, 段海潇, 王润杨, 胡 翰, 汪 洋, 刘滨磊
(湖北工业大学生物工程与食品学院, 湖北 武汉 430068)
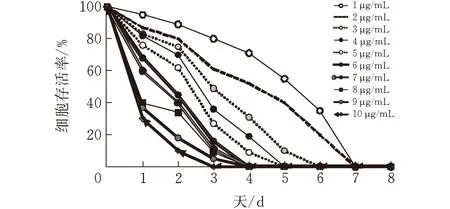
图 1 BGC823细胞对不同浓度嘌呤霉素敏感性曲线
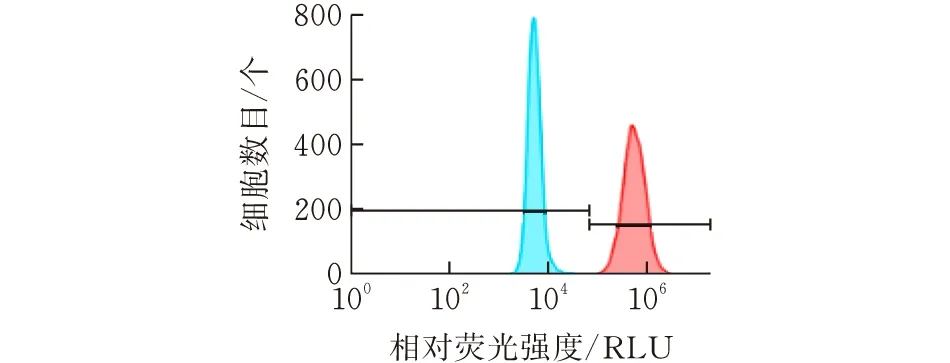
图 2 流式细胞仪检测BGC823-Fluc单克隆细胞纯度
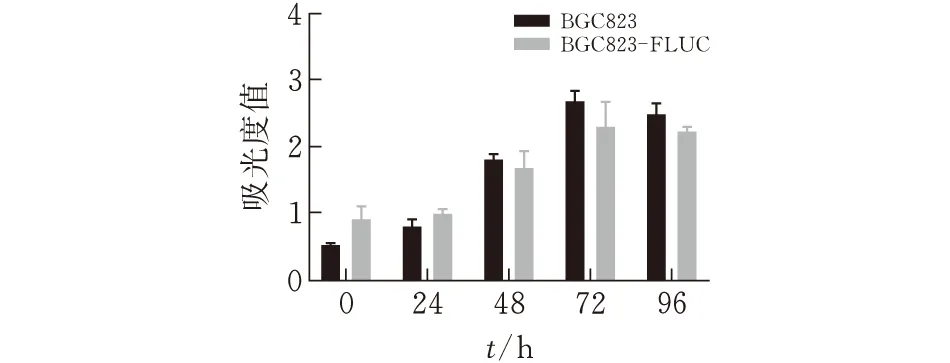
图 3 BGC823细胞与FLuc-BGC823细胞生长对比
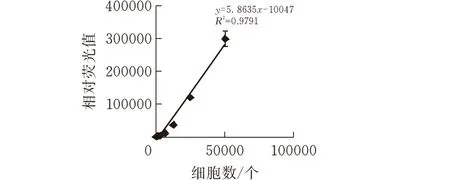
图 4 相对荧光值与细胞数目的相关性曲线
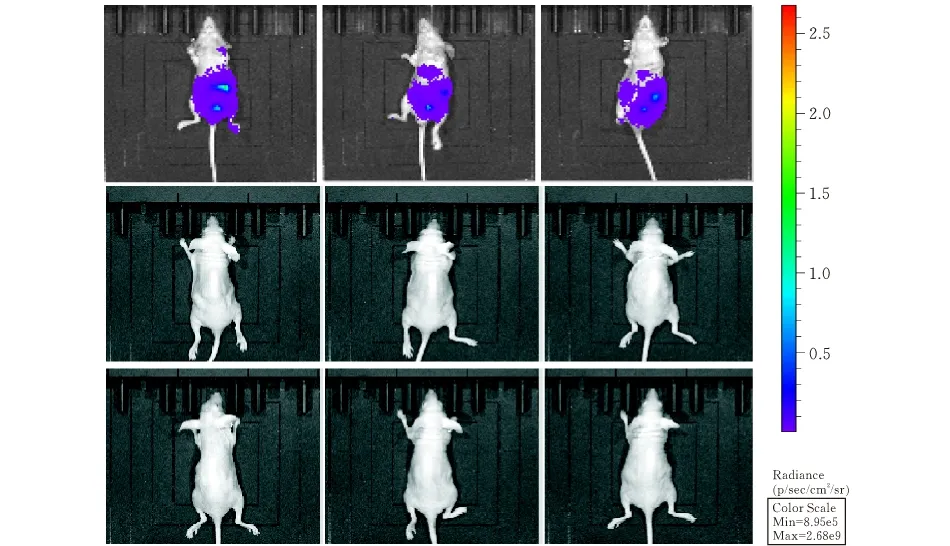
图 5 活体动物拍摄裸鼠腹腔植瘤
胃癌的形态学、分子特征复杂,具有高度异质性,为了鉴定病理和分子生化机制,已经在大鼠和小鼠中建立了各种实验动物模型[1]。生物发光是存在于生物体内的一种特殊类型的发光现象,主要指在酶的催化作用下将生物能转化成光能的过程,而不依赖于有机体对光的吸收[2]。生物发光成像技术具有非侵袭性、可定量、高灵敏度、操作简单,以及能够实时及连续动态监测等优点,被广泛应用于生物医学研究等领域[3]。
荧光素酶(luciferase)报告系统是生物发光最常见的系统之一,是luciferase 以荧光素(luciferin)、三磷酸腺苷(ATP)和O2为底物,在Mg2+存在时发生酶促反应产生光子的过程[4]。荧光素酶报告基因被广泛应用于构建特殊的单克隆细胞系,用于抗肿瘤药物的筛选。被荧光素酶标记的肿瘤细胞可通过腹腔植瘤到动物体内,可用生物发光成像仪进行检测。柯宗煌等人构建了稳定表达荧光素酶的B16R细胞系,并构建适用于小动物活体成像观察的C57 小鼠皮下移植瘤模型[5]。
绿色荧光蛋白(green fluorescent protein,GFP)是重要的探针分子,广泛应用于标记特定分子或细胞[6],其缺陷是不能像酶一样有信号放大作用[7],表达量低时不易检测。荧光素酶标记的细胞检测时需添加荧光素酶底物,可快速、无创地进行活体检测,具有较高的灵敏性、特异性和组织穿透能力,适用于体内成像[8]。荧光蛋白作为一种自发荧光,受到激发光源后可在倒置显微镜下观察到,因为自发荧光的体内成像可能被生物体内部一些组织干扰,比较适用体外的相关研究。本研究构建含单色荧光素酶以及GFP绿色荧光蛋白的BGC823细胞系,形成双荧光标记,生物发光和荧光成像的优点被应用在一起,在实际应用中有更多兼容性。
1 材料与方法
1.1 细胞试剂和仪器
实验使用的细胞株(BGC823)购于北京协和医院细胞资源中心;细胞所用的培养基是DME/F-12(HyClone, USA);lipofectamine 3000 转染试剂盒购于Thermo Fisher Scientific 公司;PiggyBac-Dual-Promoter-Firefly Luciferase( PBDP-FLUC) 重组质粒和PBDP 转座酶, 本实验室提供。 大肠杆菌菌株DH5α,本团队制备;质粒DNA小量抽提试剂盒(天根生物公司)。嘌呤霉素和MTS购自碧云天生物;BD流式细胞检测仪,倒置荧光显微镜,Nikon公司)。多功能酶标仪Thermo Fisher Scientific;荧光素酶底物(翊圣);北京东联生物安全柜。
1.2 质粒的提取
从-80℃超低温冰箱中取出用甘油保存的PBDP-FLuc质粒大肠杆菌。该质粒由实验室前期构建并保存,在室温快速解冻后以1∶1000的比例与LB液体培养基混匀,放37°C摇床1600 r/min进行摇菌15 h。质粒提取按照天根小提质粒试剂盒说明书操作。
1.3 细胞培养和转染
BGC823细胞复苏后培养在含10%胎牛血清的DME/F12培养基。转染前一天,胰酶消化并将BGC823细胞并传代至24孔板105个细胞每孔,细胞存活率97%。当细胞密度达到80%左右时,质粒PBDP-FLuc和PBDP-transposase以5∶1比例根据Lip3000说明书进行转染操作。 BGC823细胞转染24 h后在倒置显微镜的蓝光和白光下可观察到GFP阳性率。
1.4 细胞敏感性实验及单克隆筛选
将细胞扩培到T 25瓶后,铺24孔板。当24孔板中细胞覆盖率达到80%时,弃去原细胞培养液。分别配置含嘌呤霉素浓度为1 、2 、 3、4、5、6、 7、 8、 9、10 μg/mL的DME/F12完全培养基,各3mL;给24孔板做好嘌呤霉素浓度标记,分别将含嘌呤霉素的DME/F12培养基加入对应孔,每种嘌呤霉素浓度设置3个孔平行对照。将24孔板转移至CO2细胞培养箱中,温度设置为37℃,CO2浓度设置为5%进行细胞培养,连续观察细胞状态,2 d更换一次培养基,最终以第4天杀死24孔板中所有细胞的最低嘌呤霉素浓度为最佳嘌呤霉素筛选浓度。
有限稀释法获得BGC823单克隆,用DME/F12完全培养基(含10% FBS)将细胞稀释至1000个/mL。取干净无菌96孔板,每孔中加入100 μL DME/F12完全培养基(含10%FBS),再加入稀释后的细胞悬液1 μL,于 CO2细胞培养箱中,37℃恒温,5% CO2浓度进行细胞培养。待细胞贴壁后(7 d左右),在倒置显微镜下观察,记录只有单个细胞增殖成团的孔。继续在CO2细胞培养箱中,37℃恒温,5% CO2浓度进行细胞培养。待细胞长至80%,在倒置荧光显微镜下检测细胞发光情况,观察到一个孔全部细胞均发光后, 进行扩大培养,依次扩大到24孔板、6孔板,再到T-25 cm2细胞培养瓶中进行培养,细胞长满T-25 cm2细胞培养瓶。每个细胞样品取106个用于后续流式检测。
1.5 流式细胞仪检测BGC823-FLuc细胞纯度
用流式细胞仪对BGC823-FLuc单克隆细胞系进行纯度鉴定。分别收集BGC823细胞和BGC823-FLuc细胞各106个于EP管中,将细胞悬液离心(800 r/min×4 min),弃去旧培养液,加入1 mL PBS洗涤,离心(800 r/min× 4min),加500 μL PBS重悬,将上样密度调整为2×106个/mL,过细胞滤网,流式细胞仪设置上样细胞数为5×105个,检测细胞纯度,纯度大于98%即为单克隆稳转细胞系。
1.6 MTS实验检测细胞活力与生长曲线
取5块干净无菌96孔板,将培养的BGC823细胞和BGC823-FLuc细胞消化计数后,接种到同一块96孔板中(共3个平行孔),每孔加100 μL密度为5×105个/mL的细胞悬液,CO2细胞培养箱中,37℃恒温,5% CO2浓度进行细胞培养。5块96孔板的培养时间分别为0、24、48、72、96 h。
培养结束后参照MTS说明书进行如下操作:加入MTS 20 μL,CO2细胞培养箱中继续孵育4 h后,置于多功能酶标仪上,在490 nm波长处,以培养基所在孔测定的吸光度值作为背景值,计算时所有样品测定的吸光度值均减去背景值。生长曲线的纵坐标是吸光度值,横坐标是BGC823细胞数目,Excel绘制细胞生长曲线。
1.7 荧光素酶活性鉴定
细胞传代培养后,收集细胞,梯度稀释后加入到96孔板中,每孔100 uL,BGC823-FLuc细胞数分别为5×104、2.5×104、1.25×104、6250、3125、1563个,每种密度设置4个平行孔。设置对照孔,加入100 uL PBS 缓冲液,设置4个平行孔。按照荧光素酶底物使用说明书,全程避光,各孔均加入稀释50倍的荧光素酶底物100 uL,使荧光素酶底物浓度为0.15 mg/mL,培养箱孵育5 min,多功能酶标仪检测化学发光。
1.8 BGC823细胞和BGC823-FLuc细胞的裸鼠体内成瘤实验
随机选取5~6周龄裸鼠9只,分成3组,每组3只。对第一组裸鼠均腹腔注射100 μL,密度为5×106个/mL的BGC823-FLuc细胞;对第二组裸鼠均腹腔注射100 μL,密度为5×106个/mL的BGC823细胞;对第三组裸鼠腹腔注射100 μL PBS缓冲液。接种7 d后,按照荧光素酶底物使用说明书,腹腔注射荧光素酶反应底物,底物用量30 mg/mL,100 μL/只,让裸鼠自由活动10 min后,麻醉裸鼠,再进行动物活体成像,拍摄记录三组裸鼠体内荧光素酶发光情况。
2 结果
2.1 BGC823细胞对嘌呤霉素敏感性实验
通过查阅文献,选取嘌呤霉素的浓度范围为1~10 μg/mL进行细胞敏感性实验。通过最终绘制曲线可知,4天内杀死所有细胞的最低嘌呤霉素浓度为6 μg/mL。因此6 μg/mL作为嘌呤霉素加压筛选的最佳浓度。
2.2 流式细胞仪检测BGC823-FLuc细胞纯度
对稳转BGC823-FLuc细胞与BGC823细胞进行流式细胞仪鉴定。通过对比两者流式检测结果可知,FL1-A+表示GFP阳性率,与对照组相比GFP阳性率为99.9%,说明BGC823-Fluc单克隆细胞系构建成功。
2.3 MTS实验测定BGC823细胞与BGC823-FLuc细胞生长曲线
MTS法检测BGC823细胞活力值。OD 490显示,与对照组相比,转染了荧光素酶基因的细胞在0、24、48、72、96这几个时间点吸光度值差异无显著性(P>0.05),说明稳转荧光素酶基因对BGC823细胞增殖几乎无影响。
2.4 荧光素酶检测
以细胞数目为横坐标,相对荧光值为纵坐标,绘制细胞数目与相对荧光值的相关性曲线,相对荧光值和BGC823-Fluc细胞数目成正比例关系,且细胞数目和相对荧光值相关性为0.9791,说明荧光素酶在单克隆细胞系中表达。
2.5 BGC823-FLuc和BGC823裸鼠腹腔植瘤结果
裸鼠腹腔进行BGC823-Fluc和BGC823细胞注射后,7 d后腹腔注射荧光素酶反应底物30 mg/mL,100 μL/只,让裸鼠自由活动10 min后,在动物活体成像系统中检测裸鼠体内发光情况。第一组3只裸鼠体内注射BGC823-Fluc,活体动物成像显示,3只老鼠体内均能检测到荧光,可以通过荧光来判断裸鼠体内肿瘤进展。第二组3只裸鼠体内注射BGC823,未检测到荧光。第三组3只裸鼠体内注射PBS,也未检测到明显荧光。
3 讨论与结论
通过脂质体转染的方法,将含GFP和荧光素酶的重组质粒转染到胃癌细胞(BGC823)中,经过嘌呤霉素加压筛选,有限稀释法挑选单克隆,经扩大培养后,MTS实验进行细胞活力鉴定并绘制生长曲线,流式细胞仪鉴定,阳性率为99.9%,表明成功构建表达GFP及荧光素酶基因(FLuc)的胃癌细胞系(BGC823-FLuc)。葛晓梅等构建的人胃癌细胞系显示PDX模型来源的肿瘤细胞系不能完全替代PDX模型,需要和PDX模型结合使用[9],在单个细胞系中结合不同的生物读数提供了优于常规基于细胞的测定的显着优势,并接种到裸鼠皮下,建立裸鼠胃癌细胞模型,结合动物活体成像技术监测肿瘤的生长过程。
这一模型的成功构建,能够为胃癌治疗药物筛选、胃癌免疫学治疗、肿瘤的联合治疗手段等动物水平实验提供极的大便利,能够让观察者直观而精确地判断肿瘤在体内的进展。与绿色荧光蛋白、红色荧光蛋白等报告基因相比,荧光素酶灵敏度更高,稳定性更好,背景干扰更低,在动物体内的穿透性更强[10-13],使荧光素酶报告基因在肿瘤治疗和其他生物学领域发挥更大作用。

