蓝舌病病毒群特异性RT-LAMP检测方法的建立与初步应用
李占鸿,朱 沛,宋子昂,李卓然,杨振兴,李华春,杨 恒*,廖德芳*
(1.云南省畜牧兽医科学院,云南省热带亚热带动物病毒重点实验室,昆明 650224;2.云南农业大学动物医学院,昆明 650201)
蓝舌病病毒(bluetongue virus, BTV)感染引起的动物蓝舌病(bluetongue, BT)是一种侵害反刍动物的烈性虫媒传染病,绵羊感染后临床症状最为典型,表现为高热、消瘦、口唇充血肿胀及糜烂、鼻腔和胃肠黏膜出血溃疡、蹄冠脱落引起跛行等[1-2]。当新血清型BTV传入时,感染绵羊的发病率可达80%,死亡率高达40%,严重影响牛羊畜产品的正常国际贸易,给牛羊养殖业造成巨大的经济损失[3]。世界动物卫生组织(Office International des Epizooties, OIE)将BT列为法定报告的动物疫病,我国将其列为一类动物疫病[4]。目前,已在世界范围确认了27种BTV血清型(BTV-1~BTV-27)[5-6],我国存在12种血清型BTV(BTV-1、-2、-3、-4、-5、 -7、-9、-12、-15、-16、-21与-24)的流行,主要分布于云南、广东、广西、江苏、湖南和新疆等地区[[7-10]。
BTV为呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)成员,病毒基因组大小约20 kb,由10个节段(Seg-1~Seg-10)的双链RNA(double stranded RNA, dsRNA)组成,编码7种结构蛋白(VP1~VP7)和5种非结构蛋白(NS1、NS2、NS3、NS3a与NS4)[11-12]。Seg-5编码的NS1蛋白是高度保守的微管形成蛋白,可促进BTV编码蛋白的表达[13]。遗传进化分析表明,BTV的Seg-5/NS1序列在不同血清型毒株之间高度保守[14],可作为BTV群特异性核酸检测的靶基因[15-16]。
环介导等温扩增(loop mediated isothermal amplification, LAMP)技术是Notomi等[17]在2000年发明的一种新型核酸扩增方法。该方法针对靶基因的6个保守区域设计4条特异性引物,利用BstDNA聚合酶的链置换活性,在64 ℃恒温条件下反应约1 h 即可完成扩增,加入环引物后还可大大缩短反应时间,仅需30 min左右即可完成扩增过程[18]。LAMP与其他病原检测技术相比,无需昂贵的仪器设备,反应过程在恒温水浴锅中即可完成,检测速度快,肉眼即可判定结果,非常适合病原的现场快速检测,目前已广泛应用于多种病原微生物的检测[19-21]。当前,关于BTV的LAMP检测方法的报道较少,尚未建立针对所有BTV血清型毒株的群特异性LAMP检测方法,国内也未建立针对中国流行的12种BTV血清型毒株的LAMP检测方法。
本研究根据中国分离的12种BTV血清型毒株的Seg-5序列,选择高度保守区域设计RT-LAMP检测引物,建立了针对中国BTV毒株的群特异性RT-LAMP检测方法,该方法具有良好的灵敏度和特异性,45 min即可完成扩增反应,为我国BTV的检测诊断提供了一种方便快捷的方法。
1 材料与方法
1.1 病毒株、血液样品与核酸样品
本实验室1996—2020年分离的12种血清型BTV(BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、-21与-24)代表毒株,病毒信息见表1,病毒的血清型通过RT-PCR与测序确认;动物流行性出血病病毒(epizootic haemorrhagic disease virus,EHDV)血清10型毒株[22]、中山病病毒(Chuzan disease virus, CHUV)[23]、阿卡斑病毒(Akabane disease virus, AKAV)由本实验室分离并保存;口蹄疫病毒(food-and-mouth disease virus, FMDV)灭活疫苗购自乾元浩生物股份有限公司保山生物公司;非洲马瘟病毒(African horse sickness virus,AHSV)灭活疫苗引自世界动物卫生组织(OIE)参考实验室(Onderstepoort Veterinary Institute: South Africa)。12种血清型BTV感染动物的阳性血液样本共计120份(从对应阳性血液中分离出BTV毒株),于2013—2020年采集自云南省设立的哨兵牛或山羊;2020年采集自云南景洪及师宗监控牛和羊的EDTA 抗凝血液样品各30份;拷贝数为(1.48×1012拷贝·μL-1)的BTVSeg-10 ssRNA由本实验室制备[24]并保存。

表1 中国分离的12种血清型BTV代表毒株分离信息
1.2 主要试剂
WarmStart®LAMP 变色预混液购自新英格兰生物实验公司(北京);实时荧光定量qRT-PCR试剂盒、DL5000 DNA marker购自宝生物工程(大连)有限公司;磁珠法病毒核酸提取试剂盒购自美国应用生物系统公司(ABI)。
1.3 核酸准备
取50 μL病毒液或者血液样品,使用MagMax磁珠法病毒核酸提取试剂盒,按操作说明书在MagMaX Express96核酸自动提取仪(ABI)上进行病毒核酸的提取。将提取的核酸于94 ℃变性3 min,立即冰浴,保存于-80 ℃备用。
1.4 引物设计、合成与筛选
从GenBank中下载不同血清型BTV的Seg-5序列,与本课题组前期获取的中国流行的12种BTV血清型(BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、 -21与-24)毒株的Seg-5全长序列(共75条)进行序列比对分析,选择Seg-5的高度保守区域,利用Primer Exporer V4在线软件设计4组LAMP引物,各组引物均包括2条外引物BTV-F3/B3,2条内引物BTV-FIP/BIP和2条环引物BTV-LF/LB(表2),引物由上海捷瑞生物工程有限公司合成。以BTV1/V143 变性核酸为模板,参照“WarmStart LAMP预混液”试剂盒说明书,进行RT-LAMP反应,反应体系为:WarmStart LAMP 2× Master Mix 12.5 μL、BTV-FIP/BIP 引物(40 μmol·L-1)各1 μL、BTV-F3/B3引物 (20 μmol·L-1) 各1 μL、 BTV-LF/LB (20 μmol·L-1) 各1 μL,核酸模板2 μL,加入无RNA酶H2O补足至25 μL,设ddH2O为阴性对照;反应条件初步设置为60 ℃,反应1 h。反应结束后,根据反应液颜色变化判定结果,溶液保存红色不变,表示检测结果为阴性;由红色变为黄色表示结果为阳性,同时取5 μL反应产物进行电泳检测,选取最佳引物组合进行后续试验验证。
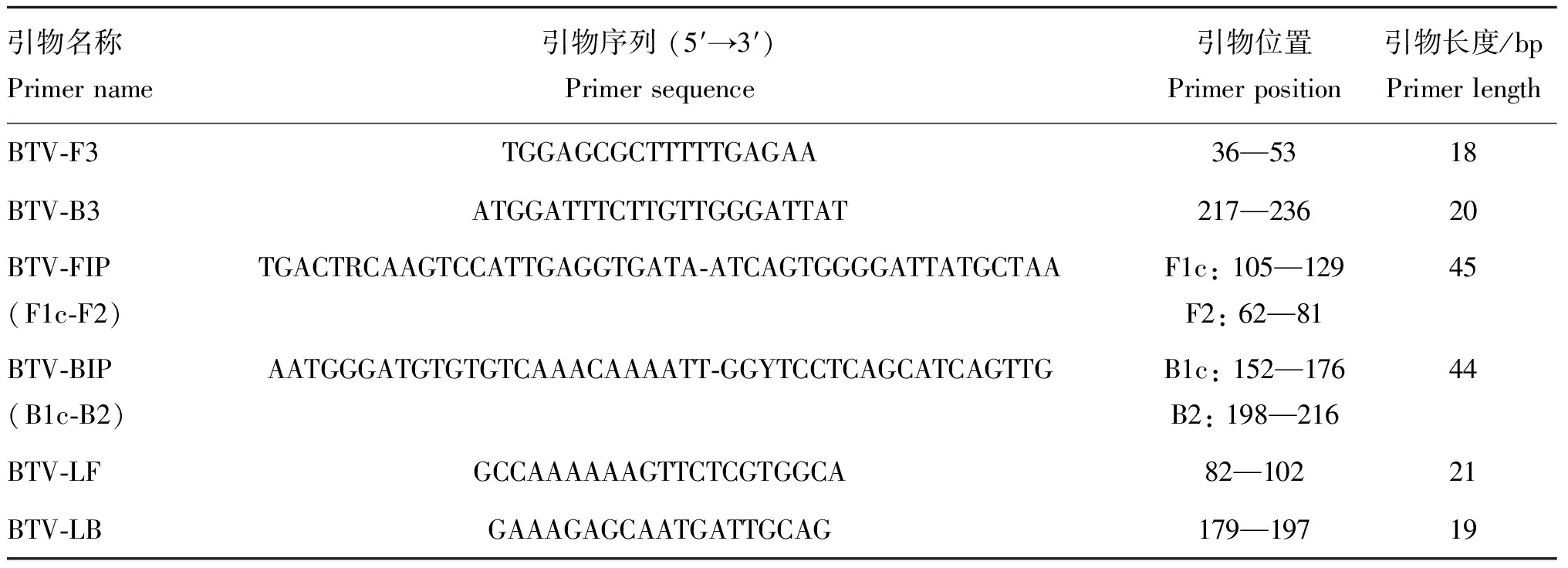
表2 研究所用引物信息
1.5 BTV群特异性RT-LAMP检测方法的建立
1.5.1 反应条件优化 为摸索RT-LAMP最佳反应温度及反应时间,以BTV1/V143毒株核酸为检测模板,设置5个温度梯度:58、60、62、64、66 ℃,按照“1.4”中的反应体系配制反应液,反应时间分别设置为20、30、45、60和75 min。反应结束后,根据反应溶液颜色变化判定结果,同时进行反应产物的电泳检测,确定RT-LAMP的最佳反应温度及反应时间。
1.5.2 引物浓度及比例优化 在最佳反应条件下,以BTV1/V143毒株核酸为检测模板,分别设置5组不同的引物浓度比(表3)进行反应。反应完成后,根据反应溶液颜色变化判定结果,同时进行反应产物的电泳检测,确定最佳引物浓度及比例。
1.6 RT-LAMP反应特异性和灵敏度试验
1.6.1 RT-LAMP反应特异性试验 根据“1.5”确定的最佳反应条件,分别取“1.3”准备的12种BTV血清型(BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、 -21与-24)代表毒株、EHDV、CHUV、AKAV毒株以及FMDV和AHSV疫苗毒株变性核酸为模板,同时以灭菌ddH2O为阴性对照,进行RT-LAMP反应,验证BTV RT-LAMP检测方法的特异性。

表3 引物浓度及比例优化
1.6.2 RT-LAMP反应灵敏度试验 取BTV1/V143毒株的变性核酸为模板,以BTVSeg-10 ssRNA为标准品,根据本实验室建立的BTV 群特异性qRT-PCR方法[24]进行绝对定量。根据核酸定量结果,适当调整BTV1/V143核酸浓度,梯度稀释至4.5×105~4.5×100拷贝·μL-1,以不同浓度的BTV1/V143核酸为模板,按照“1.5”确定的最佳反应条件进行RT-LAMP反应,同时进行BTV qRT-PCR检测[24],分析RT-LAMP检测方法的灵敏度及检测结果的准确性。
1.7 RT-LAMP检测范围覆盖度分析
1.7.1 对中国分离BTV毒株的检测 为分析建立的RT-LAMP检测方法是否可以准确检测中国分离BTV毒株的血清型,提取1996—2020年分离自云南、广西、广地及江苏等省市的12种血清型BTV毒株核酸共计46份,按照“1.5”确定的最优反应条件进行RT-LAMP反应。
1.7.2 对BTV阳性血液样品的检测 为分析建立的BTV RT-LAMP检测方法对于牛羊血液样品中BTV核酸的检测效果,取2013—2020年采集自12种血清型BTV感染的牛羊监控动物的血液样品核酸各10份,分别进行BTV的群特异性RT-LAMP检测和qRT-PCR检测[24],比较二者的检出率及检测结果的吻合程度。
1.8 临床血液样品的检测
取“1.3”提取的2020年采集自云南景洪及师宗的哨兵牛和羊EDTA抗凝血液样品核酸共计60份,以4 μL 变性核酸为模板,同步进行BTV RT-LAMP检测和qRT-PCR[24]检测,比较两种方法对于临床血液样品的实际检测效果。
2 结 果
2.1 BTV RT-LAMP最佳引物的筛选
选择中国BTV毒株Seg-5序列高度保守区,设计出4组LAMP引物,以提取的BTV1/ V143毒株核酸为检测模板,对引物进行初步筛选。反应结果显示,第1、2、3组引物对应的反应液颜色均由红色变为黄色,而第4组引物的反应液颜色保持红色不变;扩增产物电泳结果显示,第4组引物无扩增条带出现,第1、2、3组引物均扩增出梯度条带,其中第2组引物的扩增产物电泳条带最亮,且阴性对照成立,因此选择第2组进行BTV RT-LAMP检测方法的建立(图1),其序列:5′-TGGAGCGCTTTTTGAGAA-3′ (BTV-F3),5′-ATGGATTTCTTGTTGGGATTAT-3′(BTV-B3),5′-TGACTRCAAG TCCATTGAGGTGATA-ATCAGTGGGGATTA TGCTAA-3′(BTV-FIP),5′-AATGGGATGTGTGTCAAACAAAATT- GGYTCCTCAGCATCAG TTG-3′ (BTV-BIP), 5′- GCCAAAAAAGTTCT CGTGGCA-3′ (BTV-LF),5′- GAAAGAGCAATGATTGCAG-3′ (BTV-LB)。
2.2 RT-LAMP检测方法的建立
2.2.1 反应温度优化结果 以BTV1/V143毒株核酸为模板,进行RT-LAMP反应温度的优化,结果显示,反应温度为58 ℃时,反应液颜色变化不明显,仅产生微弱的扩增条带;反应温度为60~64 ℃时,反应液颜色由红色变为黄色,电泳结果显示64 ℃条件下,扩增产物的电泳条带最强,说明此温度下,LAMP反应的扩增效率最高,因此确定最佳反应温度为64 ℃(图2)。
A. 扩增产物电泳;B. 反应结束反应液颜色变化。M. DL5000 DNA相对分子质量标准;1~2. 第1组引物阳性扩增结果及阴性对照;3~4.第2组引物阳性扩增结果及阴性对照;5~6.第3组引物阳性扩增结果及阴性对照;7~8.第4组引物阳性扩增结果及阴性对照A. Electrophoresis analysis of the amplified products; B. Color of the reaction mixture after the amplification. M. DL5000 DNA marker; 1-2. Positive result and negative control of the group 1 primer; 3-4.Positive result and negative control of the group 2 primer; 5-6.Positive result and negative control of the group 3 primer; 7-8.Positive result and negative control of the group 4 primer图1 BTV RT-LAMP引物筛选结果Fig.1 Screening results of the RT-LAMP primers for BTV

A. 扩增产物电泳;B. 反应结束反应液颜色变化。M. DL5000 DNA相对分子质量标准;1~5.反应温度分别为66, 64, 62, 60和58 ℃A. Electrophoresis analysis of the amplified products; B. Color of the reaction mixture after the amplification. M. DL5000 DNA marker; 1-5.RT-LAMP carried out at 66, 64, 62, 60 and 58 ℃, respectively图2 BTV LAMP反应温度优化结果Fig.2 Determination of the optimal temperature for BTV RT-LAMP
2.2.2 反应时间优化结果 反应时间优化结果表明,64 ℃条件下扩增30 min,反应液颜色即出现改变,但扩增产物的电泳条带较弱;延长扩增时间至45、60和75 min,反应液颜色变化显著,产物电泳条带强度无明显差异(图3),因此综合考虑扩增效果及反应时间,确定最佳扩增时间为45 min。综上,本研究建立的BTV RT-LAMP检测方法的最佳反应条件为64 ℃,反应45 min。
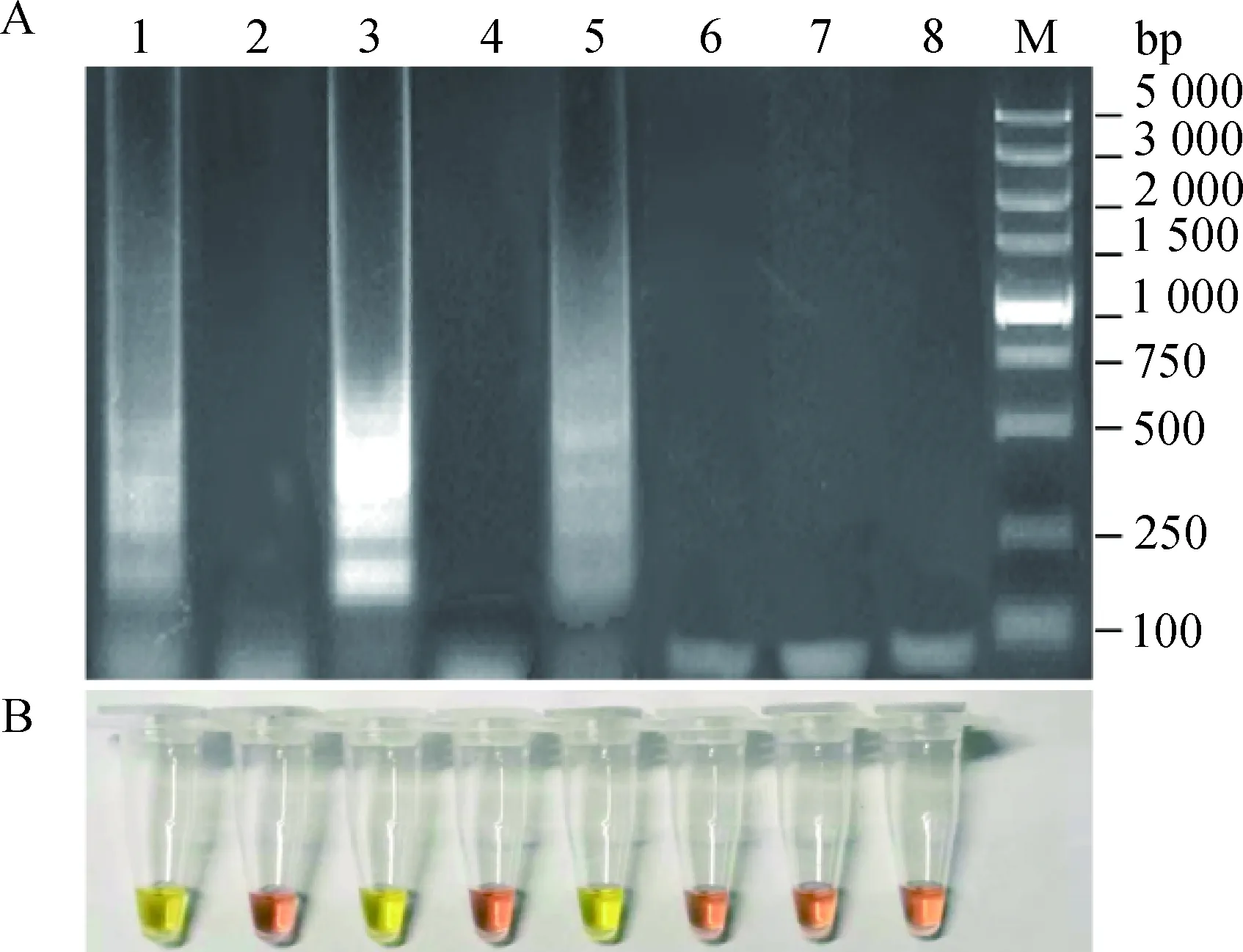
2.2.3 引物浓度及比例优化结果 引物浓度及比例优化结果显示,在最佳反应条件下,当外引物:内引物:环引物浓度比为0.2 μmol·L-1∶0.6 μmol·L-1∶0.4 μmol·L-1时,RT-LAMP 反应液颜色变化显著,扩增产物的电泳条带最强(图4),表明此时的反应效率最高,因此确定BTV RT-LAMP反应中外引物:内引物:环引物浓度的最佳引物浓度及比例为0.2 μmol·L-1∶0.6 μmol·L-1∶0.4 μmol·L-1。
2.3 RT-LAMP反应特异性试验
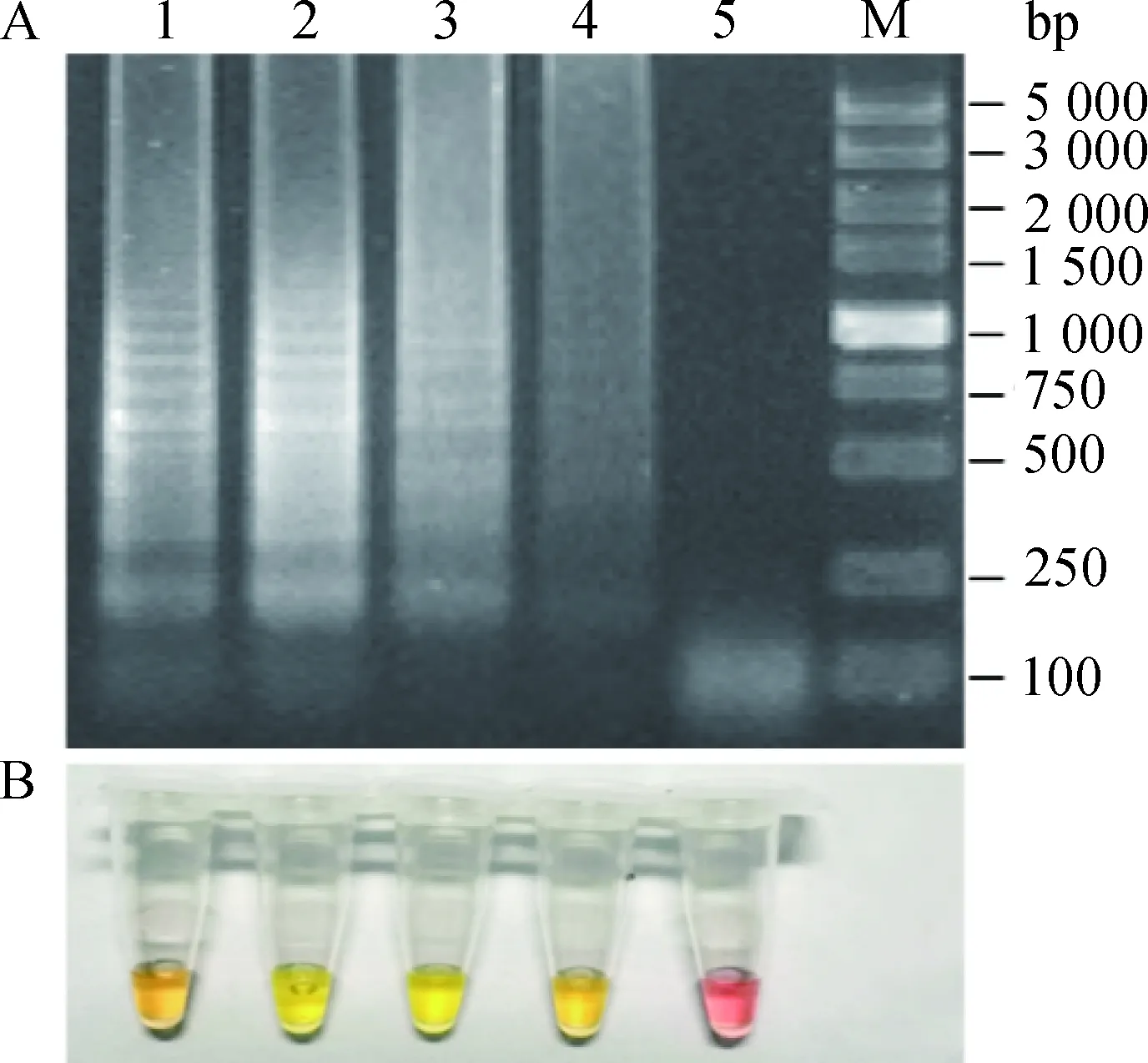
采用建立的RT-LAMP检测方法,分别以12种BTV血清型(BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、-21与-24)代表毒株、EHDV、CHUV、BEFV、AKAV毒株以及FMDV和AHSV疫苗毒株变性核酸为模板,验证RT-LAMP检测方法的特异性。结果以12种BTV血清型毒株核酸为模板均可产生明显梯度状条带,反应液由红色变为黄色,而其他病毒及阴性对照的扩增结果均为阴性(图5),表明建立的RT-LAMP检测方法具有良好的特异性。
2.4 RT-LAMP反应灵敏度试验
对提取的BTV1/V143核酸进行绝对定量,结果表明该毒株的核酸量为4.5×1010拷贝·μL-1。以梯度稀释至4.5×105~4.5×100拷贝·μL-1的病毒核酸为模板分别进行RT-LAMP检测和BTVqRT-PCR检测,结果显示,本研究建立的RT-LAMP检测方法对BTV1/V143核酸的检测下限为4.5拷贝·μL-1(图6),与BTV qRT-PCR检测灵敏度一致,表明建立的RT-LAMP检测方法具有较高的灵敏度,且检测结果准确可靠。
A.扩增产物电泳;B.反应结束反应液颜色变化。M. DL5000 DNA相对分子质量标准;1~5.BTV LAMP外引物∶内引物∶环引物浓度分别为0.2∶0.4∶0.2 μmol·L-1,0.2∶0.6∶0.4 μmol·L-1,0.2∶0.8∶0.6 μmol·L-1,0.2∶ 1.6∶0.8 μmol·L-1,0.2∶2.0∶1.0 μmol·L-1A. Electrophoresis analysis of the amplified products; B. Color of the reaction mixture after the amplification. M. DL5000 DNA Marker; 1-5.Concentration of the outer primers: inner primers: loop primers were 0.2∶ 0.4∶ 0.2 μmol·L-1, 0.2∶ 0.6∶ 0.4 μmol·L-1, 0.2∶0.8∶0.6 μmol·L-1, 0.2∶1.6∶0.8 μmol·L-1 and 0.2∶2.0∶1.0 μmol·L-1图4 BTV LAMP反应引物浓度及比例优化结果Fig.4 Optimization results of primer concentration and ratio for BTV RT-LAMP
2.5 RT-LAMP检测范围覆盖度分析
以提取的1996—2020年分离自云南、广西、广东及江苏等省的不同BTV血清型毒株核酸为模板,进行BTV RT-LAMP检测,结果46份核酸均为阳性,表明本研究建立的BTV RT-LAMP检测方法对于中国不同时间、不同地域分离的BTV毒株具有良好的检测效果。
对12种血清型BTV感染的牛羊监控动物血液样品共计120份进行qRT-PCR及RT-LAMP检测,其中RT-LAMP检出BTV核酸阳性样品数为106份,阳性率为88.33%(106/120),而qRT-PCR共检出108份BTV核酸阳性样品,阳性率为90.00%(108/120),样品Ct值为30.5~37.0,两种方法的检测结果符合率为95.0% (表4),根据McNemar检验,P>0.05,说明两种方法在BTV阳性检出率上无显著差别,表明本研究建立的RT-LAMP方法对于BTV核酸阳性血液样品的检测结果准确可靠。
A. 扩增产物电泳;B. 反应结束反应液颜色变化。M. DL5000 DNA相对分子质量标准;1~12. 分别为BTV-1、-2、-3、-4、-5、 -7、-9、-12、-15、-16、-21、-24毒株核酸扩增结果;13~17.分别为EHDV、CHUV、AKAV、FMDV、AHSV毒株核酸扩增结果;18.阴性对照A. Electrophoresis analysis of the amplified products; B. Color of the reaction mixture after the amplification. M. DL5000 DNA marker; 1-12. Amplification results of BTV-1, -2, -3, -4, -5, -7, -9, -12, -15, -16, -21 and -24; 13-17.Amplification results of EHDV, CHUV, AKAV, FMDV and AHSV; 18.Negative control图5 BTV LAMP特异性验证结果Fig.5 Specificity test results of BTV RT-LAMP
2.6 临床样品的检测
对2020年采集的60份哨兵牛羊血液分别进行BTV RT-LAMP检测和qRT-PCR检测,两种方法均检出15份BTV阳性样品(5份牛血液阳性,10份羊血液阳性),且检出的阳性样品吻合率为100%,进一步表明建立的BTV RT-LAMP对于临床血液样品具有良好的检测效果,可用于牛羊血液样品中BTV核酸的检测。

A. 扩增产物电泳;B. 反应结束反应液颜色变化;C. qRT-PCR检测结果Ct值。M. DL5000 DNA相对分子质量标准;1.阴性对照;2~7.分别为以4.5×100~4.5×105拷贝·μL-1的BTV1/V143核酸为模板的扩增结果A. Electrophoresis analysis of the amplified products; B. Color of the reaction mixture after the amplification; C. Ct value of the BTV qRT-PCR. M. DL5000 DNA marker; 1.Negative control; 2-7.Concentrations of BTV1/V143 dsRNA ranged from 4.5×100-4.5×105 copies ·μL-1, respectively图6 BTV RT-LAMP灵敏度验证结果Fig.6 Sensitivity test results of BTV RT-LAMP
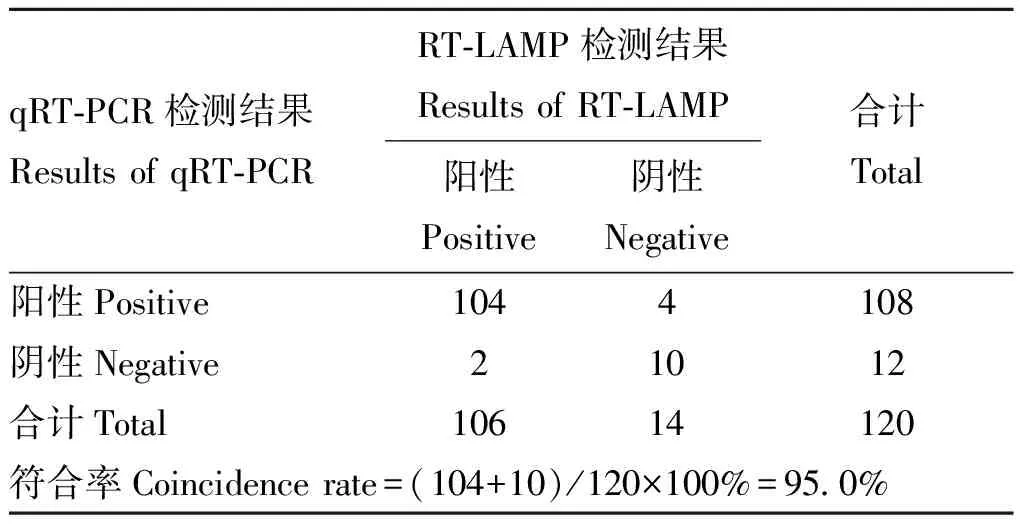
表4 BTV核酸阳性动物血液样品RT-LAMP和qRT-PCR检测结果的比较
3 讨 论
普通RT-PCR[25]、巢氏PCR[16]和实时荧光定量PCR[15]等常用的BTV核酸检测方法,需要使用PCR仪、电泳仪等较为昂贵的实验仪器,无法进行现场快速检测。本研究建立的针对中国毒株的RT-LAMP检测方法,使用恒温水浴锅,在45 min内即可完成扩增反应,同时使用WarmStart®LAMP 变色预混液作为反应试剂,阳性结果的反应液颜色由红色变为黄色,肉眼即可区别阴性和阳性检测结果,从而实现检测结果的现场可视化。
虽然Mohandas等[26]及Maan等[27]都分别报道了BTV 群特异性RT-LAMP检测方法,但是他们建立的方法主要是针对印度流行的BTV血清型毒株开发的,其中Mohandas等[26]建立的方法针对BTV-1、-2、-9、-10、-16、-21和-23等7种BTV血清型毒株,Maan等[27]建立的方法则针对BTV-1、-2、-3、 -5、-9、-10、-16、-21、-23和-24等10种BTV血清型毒株,两种方法均未涵盖中国流行的所有BTV血清型毒株。因此,本研究根据中国流行的BTV血清型毒株开发了相应的RT-LAMP检测方法。为保证建立方法对中国毒株具有良好的检出效果,我们选择中国毒株Seg-5序列的高度保守区域进行引物设计,同时,为验证建立方法对于中国毒株的实际检测效果,分别对中国不同地域、不同时间分离的12种BTV血清型代表毒株进行了验证,检出率为100%,表明建立的方法对于中国毒株具有很好的检测效果。
由于BTV为RNA病毒,所以在验证BTV核酸检测方法的灵敏度时,以确定核酸拷贝的病毒RNA为检测样品,比使用含有检测靶基因的重组质粒更为准确可靠。因此,本研究使用体外转录的ssRNA作为标准品,对BTV1/V143毒株核酸进行了绝对定量,再以梯度稀释的BTV1/V143核酸为模板进行RT-LAMP灵敏度测试。试验结果表明,建立的BTV RT-LAMP检测方法灵敏度可到4.5拷贝·μL-1,与本实验室前期建立的BTV qRT-PCR检测方法灵敏度相当[24]。
RT-LAMP检出BTV核酸阳性样品数为106份,而qRT-PCR共检出108份BTV核酸阳性样品,检测结果的符合率为95.0%(表4)。其中4份样品qRT-PCR检测结果为阳性而RT-LAMP结果为阴性,该4份样品的Ct值在36.7~36.9,已接近qRT-PCR阴阳性判定标准(Ct值≤37),说明样品中的病毒核酸量已很低,因此检测过程中轻微的加样误差都会导致结果出现偏差。作者分析这几份样品的保存时间都在5~8年,很可能是因为保存时间过长导致BTV核酸部分降解。两种方法对2020年采集样品的检测结果完全一致,说明两种方法对于保存时间较短的样品均具有很好的检测效果。
4 结 论
建立的BTV RT-LAMP检测方法具有反应快速、结果可视化、特异性强和敏感度高等优点,为我国开展BTV检测诊断与流行病学研究提供了技术支持。

