HLA-A2限制性CDKN1A编码突变肽的预测及其在膀胱癌中的应答性分析
王 晨 刘源涌 夏维敏 季 萍 余奇文 曹志伟 王 颖 沈海波
(上海交通大学医学院附属新华医院泌尿外科,上海200082)
膀胱癌是泌尿系统最常见的恶性肿瘤之一,也是全身十大常见肿瘤之一。2020年美国最新统计数据显示,膀胱肿瘤约有81 400例新发病例,17 980例死亡病例[1],中国2015年的癌症统计数据显示,膀胱肿瘤约有80 500例新发病例,32 900例死亡病例[2]。膀胱癌可以发生在任何年龄,且有儿童发病的报道,随年龄增长,其发病率也在增加,高发年龄为60岁左右,男性膀胱癌发病率高于女性。2016年美国的一项调查数据显示,35%的膀胱癌患者被诊断为侵袭性膀胱癌,5年生存率为70%,其中肌层浸润型膀胱癌预后更差,5年生存率约为47%[3]。因此,提高膀胱癌的临床诊断和治疗手段仍然是泌尿外科面临的重大挑战。
二代测序技术产生的肿瘤基因组数据为研究肿瘤的进化提供了越来越多的实证,其中通过分析肿瘤局部和正常组织(或是外周血)的全外显子测序则为研究体细胞突变特征提供了直接的证据,由此产生的肿瘤新抗原谱的概念也在新技术的背景下应运而生[4]。相较于经典的肿瘤相关抗原或是肿瘤特异性抗原的概念更加关注于完整抗原分子在肿瘤和正常组织中表达格局的差异,肿瘤新抗原则根据肿瘤产生过程中的突变累积理论,突出了在肿瘤发生发展过程中所出现的各种体细胞突变所产生的新抗原表位,通过二代测序技术和高通量生物信息学手段,获得更加全面的由单核苷酸突变或是框移突变或是缺失导致的肿瘤细胞的突变谱,由此所获得的抗原新表位既有肿瘤共性,也存在个性化[5-6]。这些突变的肿瘤新抗原一旦被提呈到细胞膜表面,就有可能被特异性的T细胞识别,成为抗肿瘤免疫应答的最有功效的细胞[7]。近年来,在各类肿瘤中开展了肿瘤新抗原的筛选,并在实验动物的抗肿瘤研究中获得良好结果,在小规模人群样本中也得到验证[8-9]。如在小鼠肿瘤模型中(肺癌、卵巢癌、黑色素瘤等),肿瘤新抗原疫苗能够引起足够的T细胞反应,控制肿瘤细胞生长,为肿瘤新抗原疗法的临床应用提供了理论支撑[10]。在人类,基于肿瘤新抗原的肿瘤疫苗在黑色素瘤患者中显示出一定的临床抗肿瘤成效,即使未得到控制的患者,在联合免疫检查点抑制剂治疗后,也达到临床治愈的标准[11-12]。因此,基于肿瘤新抗原的免疫治疗显示出了良好的临床应用前景。
本研究利用TCGA数据库中膀胱癌全外显子数据,通过生物信息学方法筛选获得一个具有高表达量的基因CDKN1A存在HLA-A2限制性的突变位点,对该基因编码的野生型和突变型肽段亲和力进行检测,另外在中国膀胱癌人群中验证了肽段特异性T细胞免疫反应性[7]。
1 材料与方法
1.1 材料 T2细胞购自美国ATCC细胞库,并在实验室常规保存;IMDM完全培养基、胎牛血清(FBS)、青霉素/链霉素(PS)和磷酸盐缓冲液(PBS)购自美国Gibco公司;β2微球蛋白购自美国Sigma-Aldrich公司;抗原肽由上海生工公司合成;96孔U底板购自美国BD公司;PE-抗HLA-A2分子的抗体(克隆号BB7.2)购自美国Abcam公司。
1.2 方法
1.2.1 患者信息 本研究招募了140例于2017年9月至2019年6月在上海交通大学医学院附属新华医院泌尿外科接受手术治疗的膀胱癌患者。术前采集全血20 ml,置于抗凝管中,用于进一步实验。纳入标准如下:①未使用免疫抑制剂;②病理证实的尿路上皮癌;③术前全血检测为HLA-A2阳性。排除标准如下:①术前接受化疗/放疗的患者;②有血液病或自身免疫病;③缺乏临床资料或实验室检测资料。本研究共排除100例患者,其中HLA-A2阴性82例,4例为血液病或自身免疫病患者,6例患者缺乏临床资料,8例患者的实验室数据不完整。最后,共有40例患者被纳入本研究,其临床病理特征见表1。此项研究通过上海交通大学医学院附属新华医院伦理委员会的伦理论证,且所有参与研究的患者都已知情,并签署知情同意书,研究程序遵循赫尔辛基宣言。
表1 40例HLA-A2阳性患者临床特征的统计学描述[±s,例(%)]Tab.1 Statistical description of clinical characteristics of 40 HLA-A2(+)patients[±s,n(%)]
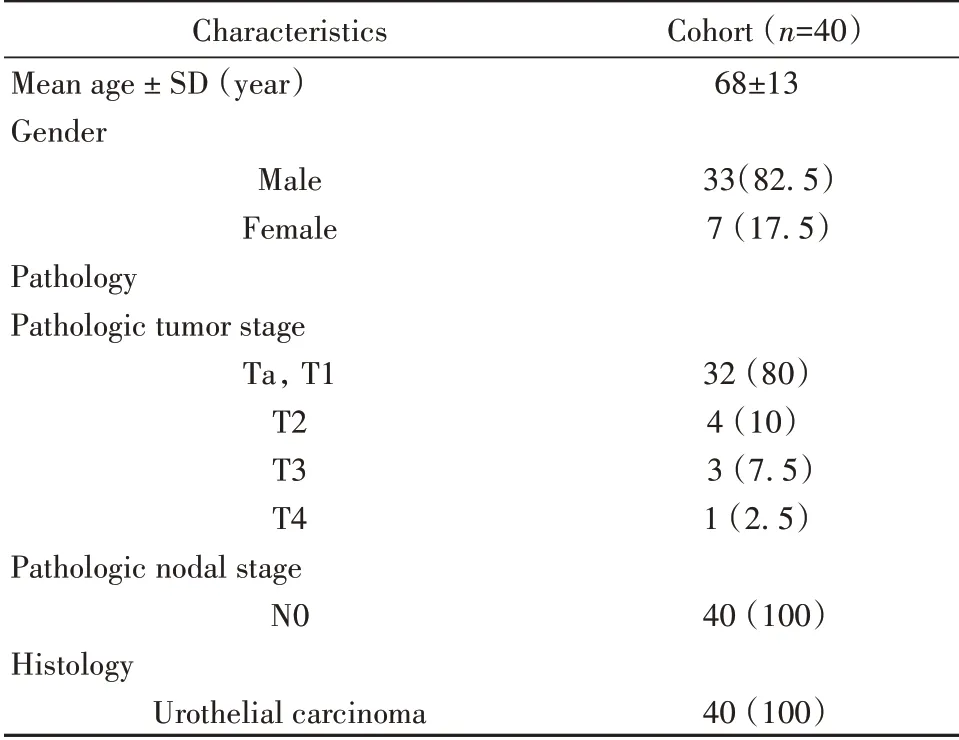
表1 40例HLA-A2阳性患者临床特征的统计学描述[±s,例(%)]Tab.1 Statistical description of clinical characteristics of 40 HLA-A2(+)patients[±s,n(%)]
Characteristics Mean age±SD(year)Gender Male Female Pathology Pathologic tumor stage Ta,T1 T2 T3 T4 Pathologic nodal stage N0 Histology Urothelial carcinoma Cohort(n=40)68±13 33(82.5)7(17.5)32(80)4(10)3(7.5)1(2.5)40(100)40(100)
1.2.2 生物信息学筛选 412例膀胱癌全外显子测序的突变数据来源于TCGA数据库(https://gdac.broadinstitute.org/),转录蛋白序列信息来源于美国国家生物信息学中心(https://www.ncbi.nlm.nih.gov/)。对于存在突变序列的基因,根据转录组数据获得蛋白质序列,利用一个9肽的滑窗产生覆盖突变氨基酸位点的突变肽段序列,相对应的野生型肽段序列来自配对外周血的全外显子数据。最后,利用NetMHCpan-3.0算法在线计算所有野生型及突变型肽段与HLA-A*02:01分子的结合力(http://www.cbs.dtu.dk/services/NetMHCpan-
3.0/)。按照结合力不同分成3类,其中结合力<50为强结合,50~500为弱结合,>500为无结合,选取突变型肽段强结合而对应野生型肽段无结合的配对抗原肽,送合成。
1.2.3 体外亲和力测定 T2细胞复苏之后,在IMDM完全培养基(IMDM培养基+10%FBS和1%PS)中培养至第七代,将细胞悬液转移到50 ml离心管中,细胞计数,调整细胞浓度0.5×106个/ml。在37℃细胞培养箱中,T2细胞(0.5×106个/ml)、β2微球蛋白和候选肽段在96孔U底板(美国BD公司)的200μl体系中共孵育4 h。L235肽段为阳性对照[13],不加入肽段只包含T2细胞的IMDM完全培养基为阴性对照。
孵育结束后,使用流式细胞仪检测T2细胞表面的HLA-A2分子表达量。T2细胞用PBS离心(2 000 r/min离心5 min)洗涤后,将T2细胞和PE-抗HLA-A2分子的抗体在4℃避光孵育40 min,孵育结束后再用PBS洗涤2次,洗去残留的抗体后使用200μl PBS重悬,转入流式管,使用FACSCantoⅡ流式仪收集细胞;采用FlowJo软件(TreeStar公司)进行分析,以平均荧光强度(MFI)来代表肽段刺激引起的T2细胞表面HLA-A2分子的表达量。
为了确认候选肽段的亲和力常数,我们将T2细胞、β2微球蛋白和不同浓度(0、0.4、2、10、20μg/ml)的HLA-A2限制性抗原肽共同孵育4 h后,经PE-抗HLA-A2抗体标记T2细胞后,由FACSCantoⅡ流式仪收集T2细胞并检测细胞表面HLA-A2分子的表达,选择以呈现50%的最强MFI的候选肽段浓度(即Kd值)来表示HLA-A2限制性候选肽段的亲和力。拟合曲线的Kd值由Graphpad Prism 6.0软件(Graphpad software Inc.,CA,USA)计算得出,用于代表抗原肽的亲和力水平。
1.2.4 酶联免疫斑点试验 使用密度梯度离心法从新鲜采集的膀胱癌患者20 ml全血中分离外周血单 个 核 细 胞(peripheral blood mononuclear cells,PBMCs)。在含有10%胎牛血清、100 U/ml青霉素和100 g/ml链霉素的RPMI1640培养基中,用肽段(2μg/ml)在37℃下刺激PBMCs(0.25×106个/孔)20 h。孵育结束后收集细胞,按照说明书(human IFN-γELISpot kit,U-CyTech,Utrecht,Netherlands)检测抗原肽特异性IFN-γ分泌量。板晾干后用ELISpot计 数 仪(BioReader Model 4000;Bio-Sys GmbH,Karben,Germany)对斑点进行计数。以单个肽段每2.5×105个细胞的斑点形成单位(spot forming units,SFUs)减空白对照的斑点形成单位计算抗原肽特异性IFN-γ分泌细胞数。
1.3 统计学分析 使用SPSS21软件(IBM SPSS Software,USA)对数据进行统计分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 CDKN1A突变抗原肽的预测 根据TCGA数据库分析,CDKN1A基因在膀胱癌中的表达量为115.12,位于较高方位。利用TCGA数据中412例膀胱癌和配对外周血,结合美国国家生物信息学中心的序列检索和突变位点与HLA-A*0201的亲和力预测,我们筛选获得了一个在膀胱癌中高表达的基因CDKN1A,其在肿瘤全外显子测序结果中发现272位含有1个错义突变,所产生的突变肽段FVTETPLEV和外周血中的野生型抗原肽相比,第61位的氨基酸残基从G变为V,使其与HLA-A*0201的预测亲和力提高了600倍(表2)。

表2 CDKN1A基因编码的HLA-A*02:01限制性预测肽段的信息Tab.2 Information of CDKN1A coded HLA-A*02:01 restricted prediction peptides
2.2 CDKN1A突变抗原肽的亲和力测定 将上述两个抗原肽合成后,我们进一步采用T2细胞进行亲和力的体外测定,将两个抗原肽分别和T2细胞共培养4 h后,与CDKN1A突变肽段孵育的T2细胞表面HLA-A2分子的MFI显著高于野生型抗原肽段的MFI,显示突变肽段与HLA-A2分子的亲和力要显著高于野生型肽段,与生物信息学预测结果一致(图1)。当将不同浓度的突变型和野生型抗原肽分别与T2细胞共孵育之后,突变型抗原肽随着孵育浓度的增加,其MFI的值也随之升高,而野生型抗原肽的MFI并未随浓度变化而增大。对不同浓度的突变型肽段MFI进行曲线拟合和计算后,CDKN1A突变型抗原肽的Kd值为3.724 mg/ml(图2)。
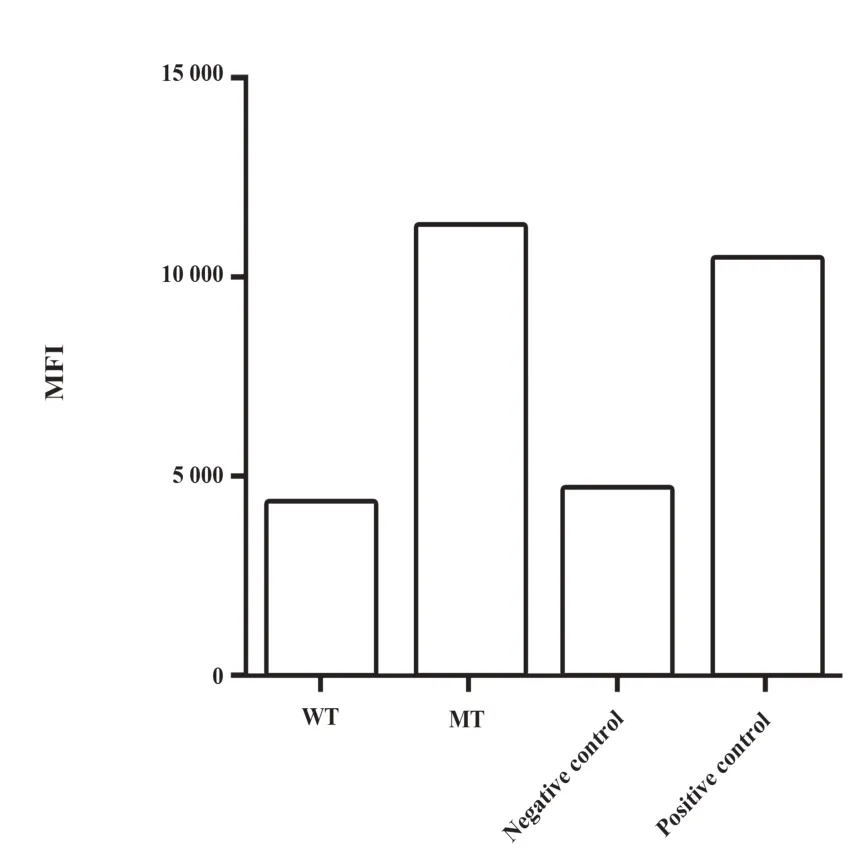
图1 CDKN1A突变型和野生型抗原肽与HLA-A2的结合力测定Fig.1 Detection of affinity between CDKN1A coded peptides and HLA-A2 molecule
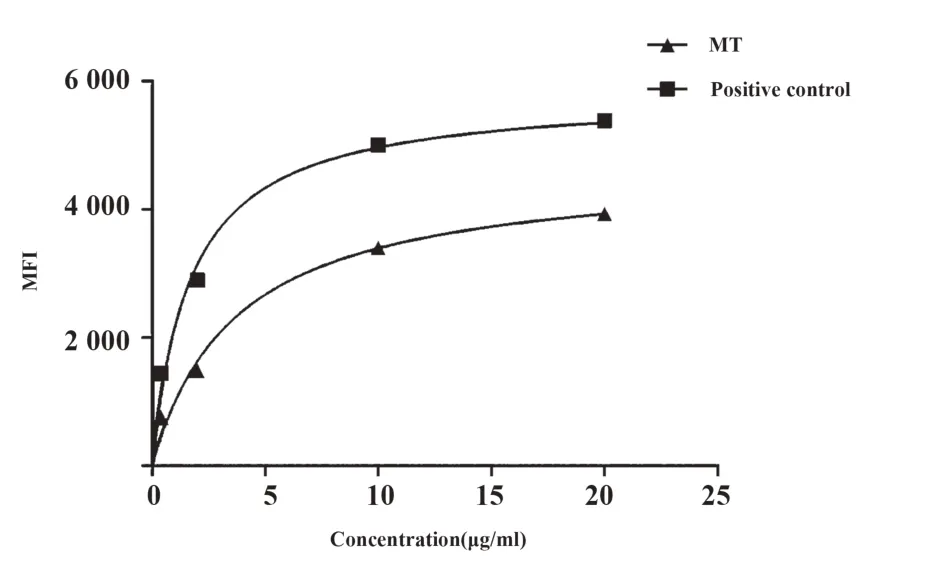
图2 基于T2细胞体外实验的抗原肽亲和力常数测定Fig.2 Determination of affinity constant of peptide based on T2 cell experiment in vitro
2.3 CDKN1A突变型和野生型抗原肽在膀胱癌患者中的免疫反应性评价 我们在40例HLA-A2阳性膀胱癌患者中进行外周突变型和野生型抗原肽特异性免疫反应测定,将外周PBMCs分别用野生型和突变型抗原肽刺激后,酶联免疫斑点实验检测CDKN1A野生型和突变型抗原肽特异性分泌IFNγ的细胞数(SFUs)(图3)。结果显示,在40例膀胱癌患者中,具有突变型抗原肽特异性的阳性反应率(SFUs>5)为25%(10/40),而野生型抗原肽特异性的阳性率为7.5%(3/40),两组反应率之间有显著性差异(P=0.034)。

图3 CDKN1A基因编码突变型和野生型抗原肽在40例HLA-A2(+)膀胱癌患者外周血单个核细胞中的特异性免疫反应检测Fig.3 Immunoreactivity of CDKN1A coded WT and MT peptides which detected in 40 HLA-A2(+)bladder cancer patients peripheral blood mononuclear cells
进一步比较40例患者中阳性反应性的突变型和野生型抗原肽特异性的平均SFUs,结果如图4所示突变型抗原肽特异性的SFUs为4.16,野生型抗原肽特异性的SFUs为2.44,两者之间差异具有统计学意义(P=0.045)。上述结果表明,CDKN1A突变型抗原肽在膀胱癌患者外周的免疫反应性要高于野生型抗原肽。
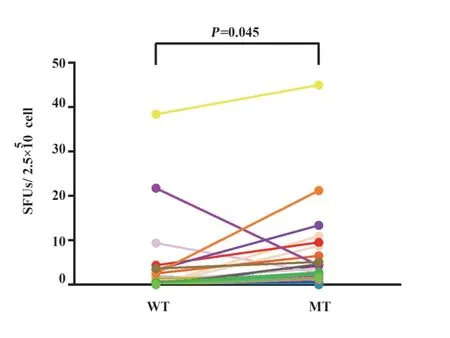
图4 CDKN1A突变型和野生型抗原肽的应答水平比较Fig.4 Comparison of CDKN1A coded MT and WT peptide response
3 讨论
本研究利用TCGA公共数据库中的WES数据筛选获得了在膀胱癌中高表达的CDKN1A基因编码的HLA-A2限制性的突变型抗原肽,该肽段和野生型肽段相比,具有和HLA-A2分子更高的结合力,并在膀胱癌患者外周表现出较高和较为广泛的免疫反应性,为将该突变抗原肽应用于临床提供了理论基础。
CDKN1A基因全称为细胞周期依赖性激酶抑制剂-1A,该基因编码的蛋白属于强效的细胞周期依赖性激酶抑制剂,又称为p21蛋白,p21蛋白可与细胞周期依赖性激酶CDK2或者CDK4复合物结合并抑制其活性,在G1期发挥调节细胞周期的作用[14]。该基因的表达受抑癌蛋白p53的严格控制,通过p53介导的细胞周期G1期阻滞,以应对各种应激刺激[15]。CDKN1A基因是膀胱癌肿瘤抑制基因,该基因突变与膀胱癌发生发展密切相关[16]。伴随着CDKN1A基因在肿瘤细胞中的突变,不仅会影响其生物学功能,同时所产生的突变型位点导致的突变抗原肽也可能成为肿瘤新抗原,被T细胞识别,导致T细胞的激活和特异性杀伤肿瘤细胞。本研究通过生物信息学的方法,获得了在膀胱癌中多个CDKN1A基因的突变位点,其中预测能够与HLA-A2结合的抗原肽仅此一对,分析该突变位点,可以发现虽然位于编码区,但是并不影响蛋白功能。而由此产生的HLA-A2限制性的突变抗原肽成为具有应用潜力的肿瘤新抗原的候选抗原肽,不仅具有比野生型抗原肽更高的与HLA-A2的结合力(亲和力),同时在膀胱癌患者中具有较广的免疫反应性和免疫应答水平。
另外我们也注意到,WT抗原肽在膀胱癌患者的PBMC中也刺激产生了少量的免疫应答。最近发表的一项关于从健康人体内获取肿瘤新抗原特异性T细胞的研究,表明肿瘤新抗原对应的野生型肽段也能够诱导与突变型肽段反应类似的抗原特异性T细胞[17],这表明野生型肽段本身也具有一定程度的免疫原性,能够部分支持我们在膀胱癌患者中检测到WT特异性T细胞反应的结果。
一项针对TCGA数据库中的膀胱癌分子特征的研究,显示膀胱癌中的高突变负荷主要来源于载脂蛋白B mRNA编辑酶催化多肽(apolipoprotein B mRNA-editing enzyme catalytic polypeptide,APOBEC)家族介导的基因突变,具有APOBEC相关突变特征的膀胱癌患者的5年生存率达到了75%,高突变负荷带来的大量肿瘤新抗原也为膀胱癌患者的生存提供了获益[18]。另一项针对肿瘤新抗原反应性的肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes,TILs)的研究,表明膀胱癌中存在肿瘤新抗原反应性TILs,这可能有助于解释免疫检查点抑制剂在膀胱癌中有效的原因,也为未来靶向新抗原的过继性T细胞治疗提供了理论依据[19]。
在此项研究中筛选获得的肿瘤新抗原,可以作为治疗性疫苗开展临床应用,如黑色素瘤、胰腺癌等,有临床研究在黑色素瘤中筛选得到潜在的肿瘤新抗原,制备成为疫苗后,回输到患者体内,大多数患者的黑色素瘤得到控制,未得到控制的患者经过免疫检查点抑制剂治疗后,也达到临床治愈的标准[11]。更重要的是随着免疫检查点抑制剂在包括膀胱癌在内的多种肿瘤中的临床治疗的成功[20],将所筛选获得肿瘤新抗原联合免疫检查点抑制剂的应用也正成为肿瘤免疫治疗联合应用的策略之一,如卵巢癌、黑色素瘤等,研究发现接受肿瘤新抗原和免疫检查点抑制剂组合治疗的卵巢癌患者表现出了较好的临床获益,同时在卵巢癌小鼠模型中,联合使用肿瘤新抗原疫苗明显提高了免疫检查点抑制剂的治疗效果[21]。
在此项研究中,我们只挑选了CDKN1A基因编码的HLA-A*02:01限制性肽段进行了合成,还有其他HLA亚型限制的肽段未纳入我们的研究范围。另有研究表明,MHC-Ⅱ类分子限制的肽段(主要引起CD4+T细胞的抗肿瘤免疫应答)也有可能成为肿瘤新抗原,但是MHC-Ⅱ类分子的结构更加复杂,表位长度更长,变量更多,并且需要更多的数据来支撑模型,所以预测算法尚未完善。
我们所筛选获得的CDKN1A基因编码突变抗原肽可以直接用于治疗性疫苗的临床研究,通过对患者组织样本中CDKN1A基因突变的筛查,进行个性化的疫苗使用或是和免疫检查点抑制剂联合使用,从而为膀胱癌的临床治疗提供更有针对性的方案。