免疫训练①
——先天免疫记忆的发现和研究进展
苏 婷 刘靖华(南方医科大学基础医学院,广东省蛋白质组学重点实验室,广州510515)
1 先天免疫记忆的发现和免疫训练概念的提出
先天免疫是由固有免疫细胞,如单核/巨噬细胞、NK细胞等介导的非特异性、作用弱而短暂的第二道防线,而获得性免疫是淋巴细胞亚群在接受抗原刺激后产生的特异性、作用强而持久的第三道防线;是否产生特异性免疫记忆是区分两种免疫模式的重点。疫苗就是基于获得性免疫机制,诱导机体产生针对减毒或灭活病原体的特异性免疫记忆,从而在二次感染中发挥显著保护作用。然而,有报道称卡介苗(bacillus calmette-guerin,BCG)可为感染高死亡率地区儿童提供非特异性免疫保护,显著降低其总死亡率;麻疹和牛痘接种研究也发现,接种者会产生对异源感染的抗性[1-2]。之后在小鼠和细胞水平研究陆续发现,BCG的交叉免疫范围扩展到了曼氏血吸虫、白色念珠菌以及流感病毒等。NETEA等[3]发现,用白色念珠菌刺激BCG接种过的血液样品可检测到大量单核细胞来源的IL-1β和TNF-α;他们将固有免疫细胞与BCG的非特异性免疫作用联系起来,提出“免疫训练”的概念。免疫训练是指原发感染或疫苗接种可诱导宿主的固有免疫细胞产生对二次感染的增强抗性,且可为异源感染提供交叉保护。
2 免疫训练的效应细胞及发生机制
2.1 免疫训练的效应细胞 免疫训练的现象首先在经典的固有免疫细胞,如单核/巨噬细胞、NK细胞中被发现,因此,免疫训练也被称为先天免疫记忆。深入研究发现,外周免疫细胞如肺泡巨噬细胞、脑小胶质细胞,非免疫细胞如造血干细胞、上皮细胞等也可表现出免疫记忆的特性。
2.1.1 单核/巨噬细胞 单核/巨噬细胞系统是固有免疫的重要组成成分,参与了吞噬与清除病原体、抗原呈递、激活和调节免疫应答等进程。BISTONI等[4]发现减毒白色念珠菌会刺激小鼠产生对金黄色葡萄球菌的抗性,且此作用有赖于巨噬细胞的激活。用李斯特菌和鼠疫耶尔森菌感染处于疱疹病毒潜伏期的小鼠,也可检测到巨噬细胞的活化和IFN-γ表达量的上升[5]。真菌、病毒等感染可“训练”循环免疫细胞增强对异源二次感染的免疫应答已被广泛证实。值得注意的是,外周巨噬细胞的免疫训练研究也取得了突破进展。YAO等[6]发现呼吸道病毒感染可诱导产生长期记忆表型的肺泡巨噬细胞;在中枢神经系统中,细菌脂多糖的二次刺激也可引起小胶质细胞炎症反应的增强[7]。这些发现大大扩展了免疫训练的效应细胞的领域。
2.1.2 NK细胞 NK细胞作为固有免疫系统的另一重要组分,可对预先接触的抗原产生特异性记忆,且已致敏NK细胞移植后依然保留这种记忆。用痘苗病毒或单纯疱疹病毒预处理NK细胞,再次用病毒感染时可检测到IFN-γ表达增强;将携带特异性巨细胞病毒受体的NK细胞移植给幼稚小鼠,幼稚小鼠会产生强烈免疫反应[8-10]。这些经病原微生物“训练”而增强的免疫应答不依赖于T、B细胞的活化,是固有免疫细胞的特殊先天记忆。
2.1.3 造血干细胞与祖细胞 疫苗接种后或动物实验中可观察到持续数月到数年的非特异性保护,然而固有免疫细胞生命周期短暂的现实,提示分化形成固有免疫细胞的造血干细胞和祖细胞(hematopoietic stem cells and progenitor cells,HSPCs)可能参与了先天免疫记忆的形成。基于这种假设,MITROULIS等[11]用β-葡聚糖刺激小鼠,观察到HSPCs的增殖及IL-1β等促炎因子的表达,且增殖后的HSPCs表现出对LPS刺激的耐受性。用BCG刺激小鼠造血干细胞,其分化产生的幼稚巨噬细胞也表现对结核杆菌的抗性[12]。这些都提示造血干细胞与祖细胞具有免疫训练的特性。
2.1.4 其他组织细胞 某些具有抗菌特性的非固有免疫细胞也可经训练表现记忆特性。NAIK等[13]将小鼠的皮肤上皮干细胞与TLR7共培养进行伤口测试,发现受试上皮组织愈合加快并免疫白色念珠菌的感染。SCHNACK等[14]首次证明了冠状动脉平滑肌细胞经氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL)刺激后,在接受二次刺激时释放更多的炎症因子如IL-6、IL-8和MCP-1。这些研究成果提示免疫训练可能是细胞共有的潜在特性。
2.2 免疫训练的发生机制 大量研究表明,甲基化、乙酰化等表观遗传学修饰可能参与了这种非特异性记忆的形成,免疫代谢的转变是支持这一过程的重要机制。
2.2.1 表观遗传学修饰 免疫训练的显著特征是经病原体刺激的细胞抗感染相关细胞因子的转录明显增加。基因转录水平的调控与组蛋白修饰有关,结合在抗感染相关细胞因子启动子区域的组蛋白的修饰状态,可能是免疫训练发挥作用的关键。
启动子上的组蛋白3在第4位赖氨酸(H3K4)的一甲基化(H3K4me1)和三甲基化(H3K4me3)以及在第27位赖氨酸的乙酰化(H3K27Ac)与固有免疫细胞基因活化相关,而第9位赖氨酸(H3K9)和第27位赖氨酸(H3K27)的甲基化是抑制性标记[15]。早在BCG的研究中就发现,产生免疫记忆的单核细胞通过NLR2介导的H3K4me3增加促进炎症因子的表达[16];BCG刺激的造血干细胞转录组中也可检测到H3K4me3和H3K27Ac的增加[12]。其他类型的组蛋白修饰起协同作用。抑制性信号H3K9me2的减少是H3K4me3增加的前导因素[17];用LPS刺激巨噬细胞后检测潜在的514个启动子,发现H3K4me1的激活与维持是二次感染时H3K27Ac增强的必要条件[18]。
目前认为,初次感染时,促炎因子编码基因启动子区域的H3K9me2的减少和H3K4me1、H3K4me3及H3K27Ac的增加,更易结合转录激活因子如NF-κB(nuclear factor kappa-B)、AP-1(activator protein 1)和STAT1(signal transducers and activators of transcription1),促进IFN-γ、TNF-α、IL-6、IL-8等的表达以对抗外来感染[19];之后,表观遗传学修饰被部分保留,当细胞遭遇二次感染时,转录激活因子得以迅速启动基因转录,产生更强烈的免疫应答。
长链非编码RNA(long non-coding RNA,lncRNA)通过特异性结合DNA、RNA或蛋白质,也可参与基因表达的调控;lincRNA-Cox2、Lethe等lncRNA就与先天免疫的激活有关[20]。新近研究发现免疫基因引发的一种新型lncRNA——IPLs可促进免疫趋化相关基因IL-8和CXC趋化因子亚族的启动子上H3K4me3的积累,参与先天免疫记忆形成[21]。这一发现扩展了免疫训练的表观遗传学修饰研究领域。
2.2.2 免疫代谢调控 细胞代谢提供免疫训练的激活与维持所需能量,以及表观遗传学修饰所需的酶和原料。相关研究提示,经免疫训练的细胞中,有氧糖酵解替代了氧化磷酸化,出现快速摄取利用葡萄糖的Warburg效应。
真菌细胞壁上的β-葡聚糖是诱导免疫训练的关键成分。CHENG等[22]发现,β-葡聚糖通过结合受体Dectin-1激活Akt/mTOR/HIF-1α通路,使单核细胞有氧糖酵解升高、葡萄糖消耗及乳酸产生增加;转录组分析也发现糖酵解相关基因启动子区域的H3K4me3和H3K27Ac增加。受此启发,ARTS等[23]整合代谢组和转录组数据,发现谷氨酰胺分解和胆固醇合成途径也发生了上调。谷氨酰胺分解产物延胡索酸可激活免疫训练,这是因为组蛋白去甲基化酶KDM5发挥作用需要α-酮戊二酸的辅助,与之结构相似的延胡索酸和琥珀酸则竞争性拮抗这一过程[24]。同时,谷氨酰胺的代谢产物推动三羧酸循环(TCA cycle),促进ATP生成与乙酰辅酶A的积累;后者为H3K27Ac提供乙酰基,促进组蛋白的表观遗传学活化。
关于甲羟戊酸激酶缺乏症患者的研究阐述了胆固醇合成途径上调促进免疫训练发生的机制。BEKKERING等[25]发现患者的单核细胞在免疫和表观遗传水平上表现免疫训练的特性;原因是甲羟戊酸激酶的缺乏导致甲羟戊酸的积累,内源性地激活胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R),进一步增强糖酵解,促进炎症因子的释放,诱发患者的无菌性炎症。
这些发现提示,表观遗传学的修饰与免疫代谢的转变之间存在紧密的内在联系,通过调控关键代谢途径,可增强或抑制免疫训练达到治疗的目的(图1)。
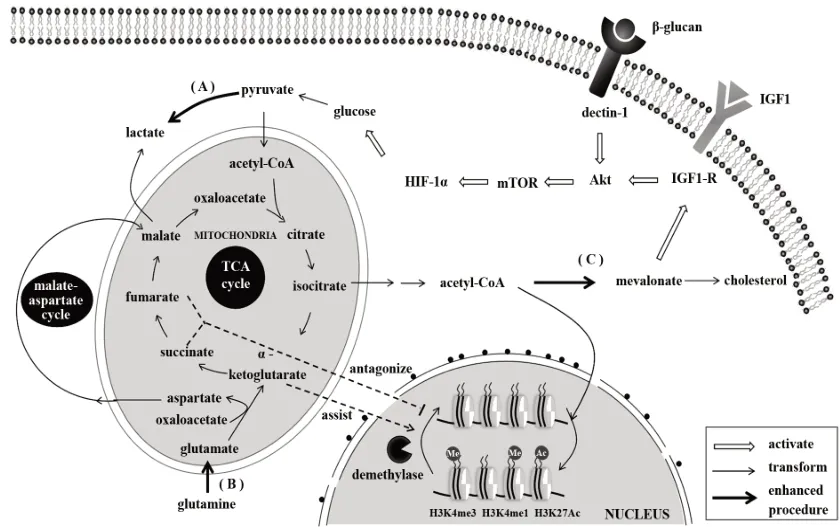
图1 免疫训练中的表观遗传学-免疫代谢调控Fig.1 Correlate regulation of immunometabolic transformation and epigenetic mudulation in trained immunity
3 免疫训练的临床应用
先天免疫细胞及其他组织细胞的记忆特性对于机体抵御多种外源性或内源性感染具有重要意义。在适应性免疫低效或失效的领域,如自身免疫病及肿瘤的免疫耐受,免疫训练或可发挥治疗作用。
3.1 疫苗的交叉保护 早期研究发现,BCG可降低新生儿、低体重儿童和成年人的总体死亡率;后续研究也表明,接种BCG的个体可交叉免疫流感病毒、肺炎链球菌及乙型肝炎病毒等病原体[26]。另外,麻疹疫苗和脊髓灰质炎疫苗也可诱导一定的非特异免疫抗性[27]。免疫训练的交叉保护作用或可降低疫苗接种成本,对于发展中国家儿童抵御多种传染病有重要意义。
3.2 对抗慢性炎症及自身免疫疾病 免疫训练诱导的IL-6、IL-1β和TNF-α表达的持续增加是慢性炎症发生的机制之一[28]。动脉粥样硬化危险因子ox-LDL可诱导人单核细胞产生持续的mTOR活化、活性氧形成及HIF-1α积累[29];致动脉粥样硬化溶血磷脂酰胆碱也可上调人主动脉内皮细胞糖酵解酶途径,增强甲羟戊酸合酶及组蛋白乙酰化酶的活性[30]。抑制免疫训练关键表观遗传学修饰的发生及阻断代谢通路的转变,或可抑制动脉粥样硬化的发生发展。另有研究发现Ⅰ型糖尿病患者的血清中单核细胞比例上升且可被TLR诱导表达更多的IL-1β和IL-6;IL-1阻断剂成功降低Kilham大鼠病毒诱导的Ⅰ型糖尿病发生率,说明免疫训练可为Ⅰ型糖尿病治疗提供新思路[31-32]。Akt/mTOR/HIF-1α是真菌诱导免疫训练的经典通路,短期应用靶向mTOR的特异性高密度脂蛋白可促进移植肾的长期存活,说明在器官移植后的免疫抑制治疗中,免疫训练也大有可为[33]。
3.3 逆转免疫耐受及改善免疫缺陷 免疫反应是促炎因素与抗炎因素角力抗衡的过程。既然免疫训练可增强免疫应答,可否用来打破免疫耐受的不利平衡?内毒素血症后期小鼠可因免疫麻痹发生死亡。用β-葡聚糖刺激内毒素血样中的单核细胞的实验发现,约60%耐受基因的组蛋白修饰被逆转,使单核细胞恢复敏感状态[34]。通过诱导持续性慢性炎症,BCG联合干扰素α-2b灌注成为非肌层浸润性膀胱癌的标准治疗。因此,免疫训练可重新激活固有免疫细胞,对于治疗脓毒症所致的免疫麻痹、逆转肿瘤微环境的免疫耐受具有重要意义。
HIV病毒特异性攻击T淋巴细胞导致患者免疫力低下,并继发机会性感染使HIV感染者死亡。如前所述,既然训练免疫诱导的增强抗性不依赖于T、B淋巴细胞的增殖活化[8,10],可否用于治疗免疫缺陷?遗憾的是,诱导免疫训练以对抗HIV患者的多重感染的研究尚未见报道。
4 总结与展望
虽然免疫训练的概念尚新,但先天免疫记忆的研究已持续近一个世纪。目前已发现可诱导免疫训练的物质有疫苗、病毒、真菌、寄生虫以及各种炎症相关细胞因子;可被诱导产生训练免疫的效应细胞从固有免疫细胞,如单核细胞、巨噬细胞和NK细胞,扩展到了各类间充质干细胞以及局部黏膜抗炎非免疫细胞。有理由推测,所有细胞系都可能具有记忆病原微生物感染的能力。NETEA等[35]提出免疫记忆的发展是一个连续过程。免疫训练是原始适应形式,由表观遗传学改变产生非特异性增强的炎症反应;获得性免疫记忆是其进化模式,增加了基因重组介导的选择特异性。认可免疫记忆是所有生物体免疫防御的一般特征,对有效治疗感染和免疫介导的疾病具有重要意义。
尽管目前有关免疫训练的探索已取得丰硕成果,但仍有诸多重要问题亟待解决。首先,如何解释经训练的细胞仅对部分病原体产生抗性增强?例如,BCG诱导的免疫训练虽可交叉保护多种感染,但最新研究发现其对H7N9流感病毒无效[36]。其次,不同病原微生物或炎症因子诱发免疫训练的具体分子机制是否相同?有关β-葡聚糖诱导的免疫训练的机制研究较为详细,但对其他刺激物的作用机制尚未明晰。最后,免疫训练的临床应用还处于实验室研究阶段,如何尽快将其转化为临床实践需要深入探讨。对于这些问题的研究,不仅有助于开发新的有效的疫苗或者药物以提高免疫力低下人群(如HIV患者及免疫减退的老年人)的抗感染能力,而且可以为自身免疫疾病及肿瘤等的治疗提供新的思路和防治措施。