复合益生菌发酵全价料对Z型鸭生长性能、血清生化指标及表观消化率的影响
■刘 泽 郭云霞 郭晓军 杨会英 赵婷婷 张 昭 张月肖 郝庆红*
(1.河北农业大学,河北保定 071001;2.保定市畜牧工作站,河北保定 071051;3.武强县农业农村局,河北衡水 053000;4.武强县百润有限公司,河北衡水 053000)
随着药物性饲料添加剂有序地退出历史舞台,抗生素替代产品的开发应用成为动物营养领域的研究热点。微生物发酵饲料富含益生菌和多种活性代谢产物,如功能性寡聚糖、活性小肽、抗菌肽等,可提高动物免疫力和生长性能[1],实现从减抗到无抗养殖转型具有重要意义。日粮经过微生物发酵后,抗营养因子极显著下降[2-3],粗蛋白含量显著增加,粗脂肪和粗纤维含量显著下降,饲料营养价值得到提升[4-5]。另外,微生物发酵还可显著增加饲料中乳酸和乙酸含量,pH降至4.0以下,从而抑制沙门氏菌的增殖[6]。发酵饲料在畜禽上应用,可显著增加断奶仔猪平均日增重,而料重比极显著下降[7-8],而且饲喂母猪发酵饲料还可提高初生仔猪的生长性能[9]。用50%和100%的发酵菜籽粕饲喂雏鸡,可促进初生雏鸡的增重速度和较低的料重比[10]。添加10%的发酵脐橙粕可使肉雏鸭粪便中氮、磷、钾等的排放极显著减少,同时血清谷丙转氨酶活性及尿素、高密度脂蛋白胆固醇含量显著升高[11]。另外还可增加盲肠拟杆菌门丰度,而脱硫弧菌、内考拉杆菌属的数量显著下降,增强肠道健康和营养物质吸收,进而促进机体生长[12]。综上表明,微生物发酵饲料可降解大分子物质和抗营养因子,同时提供大量有效活菌,进而促进饲料营养成分的消化吸收,从而降低养殖成本,提高养殖经济效益。然而,不同微生物、不同的发酵过程,会产生不同的活性代谢产物,从而影响发酵饲料的品质。本研究利用自主研发得到的芽孢益生菌对Z型鸭配合料进行发酵处理,并通过饲喂试验,明确Z型肉鸭日粮中发酵饲料适宜的添加比例,旨在为微生物发酵饲料在畜禽日粮中的应用提供理论依据。
1 试验材料及方法
1.1 材料
1日龄的肉公鸭(Z型鸭)由武强县牧兴肉鸭养殖专业合作社提供。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)JM-21、枯草芽孢杆菌(Bacillus subtilis)B-1、地衣芽孢杆菌(Bacillus licheniformis)Y5-39:河北省饲用微生物技术创新中心及河北农业大学生命科学院制药工程系自主筛选。
1.2 饲养管理及试验设计
试验在河北武强县牧兴肉鸭养殖专业合作社进行。试验鸭1~3日龄采用网上平养,4日龄后采用双层叠层笼养。日常管理按照武强县牧兴Z型鸭养殖专业合作社常规饲养管理要求进行,各组保持一致。试验期间各组肉鸭自由采食颗粒料和饮水,每天观察鸭群的精神状况,记录各组死亡数,按武强县牧兴肉鸭养殖专业合作社免疫程序进行免疫接种和鸭舍。
选择体重相近的1日龄肉公鸭480只,随机分为4组,每组6个重复,每个重复20只。试验期43 d,试验分为3个阶段,1~10日龄饲喂Z型鸭初期料,11~28日龄饲喂Z型鸭中期料,29~43日龄饲喂Z型鸭后期料。试验组发酵料分别按各期饲料进行发酵,分别按干物质比例7%、14%、21%的添加量添加到日粮中,混匀后饲喂,配制与对照组日粮相等营养浓度的日粮。基础日粮配方及营养水平见表1。
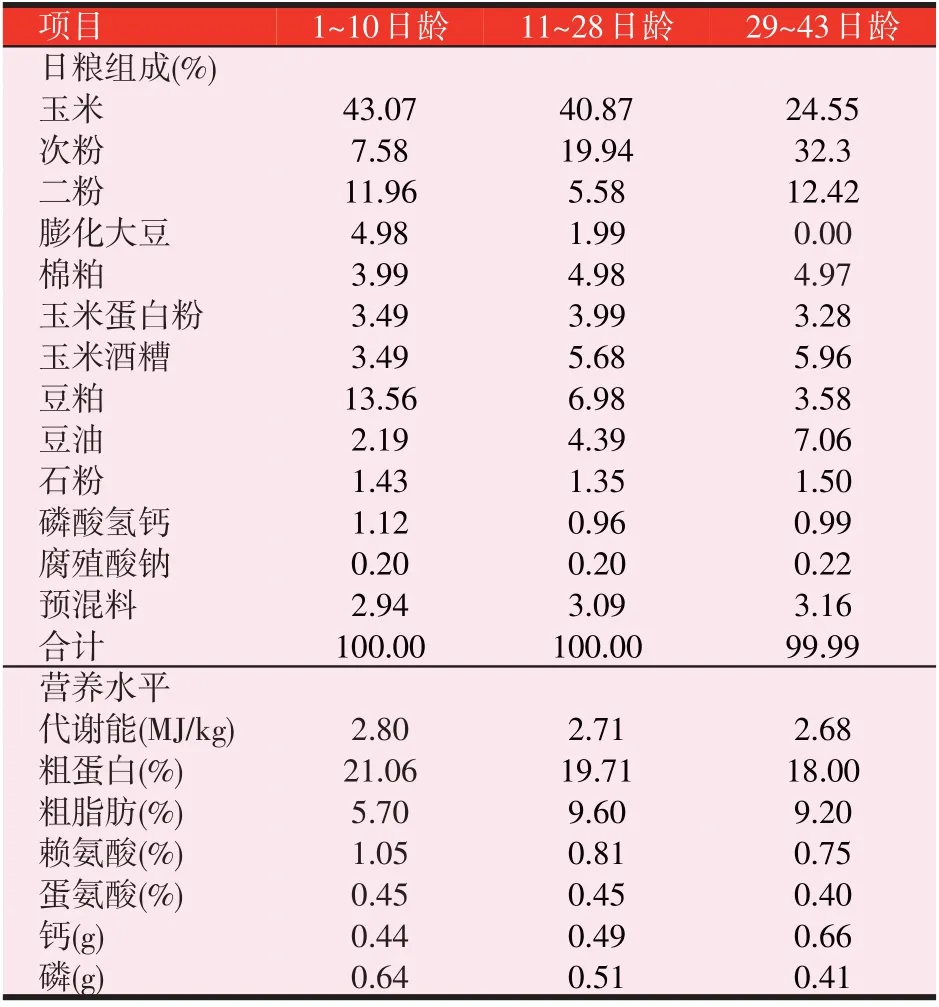
表1 基础日粮组成及营养水平(风干基础)
1.3 发酵全价料的制备
具有抗腹泻功能及毒素降解功能的芽孢益生菌,枯草芽孢杆菌(Bacillus subtilis)B-1、地衣芽孢杆菌(Bacillus licheniformis)Y5-39和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)JM-21,按3∶5∶2比例进行混合制成复合菌剂(1×108CFU/L),以3%接种量与配合饲料均匀混合,使发酵饲料中含水量最终为40%,将混合均匀的发酵料装入带有出气阀的青贮袋(25 kg规格),用扎带扎好后,室温静置发酵7 d,发酵前后各阶段饲料营养成分见表2。

表2 发酵前后各阶段饲料营养成分
1.4 样品采集及检测
1.4.1 生长性能和发病率
以重复为单位,准确记录每日投料量,并于第2 d晨饲前称剩料量,计算每只肉鸭的平均日采食量。正式试验开始前和结束后,空腹称重,计算平均日增重和料重比。试验期观察肉鸭的发病情况和死亡情况,试验结束后统计存活率。
1.4.2 屠宰性能及器官指数
试验结束早晨(空腹12 h),每组中取6只体重接近平均体重的肉鸭,称活重后颈动脉放血致死,参考《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)[13]进行屠宰性能测定,计算屠宰率、半净膛率、全净膛率、胸肌率、腿肌率,并测定内脏器官发育指数,计算公式如下:
屠宰率(%)=屠体重/活重×100
半净膛率(%)=半净膛重/活重×100
全净膛率(%)=全净膛重/活重×100
胸肌率(%)=双侧胸肌重/全净膛重×100
腿肌率(%)=双侧大小腿净肉重/全净膛重×100
器官发育指数(%)=器官重量(g)/活体重(g)×100
1.4.3 血清生化指标及激素水平
试验结束当天,晨饲前每重复随机取6只肉仔鸭,翅下静脉采集10 mL血液,4℃静置过夜,8 000×g离心5 min,分离血清置于-20℃保存备用。
1.4.3.1 血清常规生理指标
总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿素氮(BUN)、肌酐(CRE)、尿酸(UA)、葡萄糖(Glu)、谷草转氨酶(AST)、谷丙转氨酶(ALT)等采用全自动生化分析仪(OLYMPUS-AU600)测定。
1.4.3.2 血清激素
血清生长激素(GH)、胰岛素(INS)、胰岛素样生长因子-1(IGF-1)含量,采用酶标仪(芬兰,Labsystems Multiskan MS,352型)测定,试剂盒购自江苏酶免实业有限公司。
1.4.4 养分表观消化率测定
于正式期第29~33 d每天08:00和17:00以每个重复为单位收集新鲜粪样100~200 g,然后混匀,加入10%H2SO410 mL固氮,-20℃保存,连续收集3 d,65℃烘箱烘干,粉碎保存,使用盐酸不溶灰分(AIA)法测定粪样中粗蛋白、粗脂肪、钙、磷表观消化率的方法参考刘燕[14]。公式如下:
某养分表观消化率(%)=100×[1-(饲粮中AIA含量/粪中AIA含量)×(粪中该养分含量/饲粮中该养分含量)]
1.5 数据统计
数据经Excel处理后用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用Duncan’s法进行多重比较,以P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
2 结果与分析
2.1 复合益生菌发酵全价料对Z型鸭生长性能的影响(见表3)

表3 复合益生菌发酵全价料对Z型鸭生长性能的影响
由表3可知,与对照组相比,10日龄体重试验Ⅰ组显著降低6.67%(P<0.05),试验Ⅱ组和Ⅲ组分别增加4%(P>0.05)和8.0%(P<0.01),其中试验Ⅰ组极显著低于试验Ⅱ组和Ⅲ组(P<0.01);28日龄体重试验Ⅱ组比试验Ⅰ组增加20.30%(P<0.05),而与其他组间差异不显著(P>0.05);1~10日龄平均日增重,与对照组相比,其中试验Ⅰ组显著降低7.55%(P<0.05),试验Ⅲ组极显著增加9.50%(P<0.01),试验Ⅱ组增加了4%,但差异不显著(P>0.05);11~28日龄平均日增重,与对照组相比,试验Ⅱ组极显著增加16.84%(P<0.01),试验Ⅰ组显著降低6.34%(P<0.05);29~43日龄和全期平均日增重各组间无显著差异。与对照组相比,试验Ⅰ、Ⅱ组和Ⅲ组采食量分别极显著下降9.87%、12.59%和13.59%(P<0.01)。与对照组相比,试验Ⅰ、Ⅱ组和Ⅲ组料重比分别极显著下降18.15%、20.46%和18.53%(P<0.01)。
2.2 复合益生菌发酵全价料对Z型鸭屠宰性能及器官发育指数的影响(见表4)
由表4可知,与对照组相比,各试验组肉鸭屠宰率、半净膛率、腿肌率、胸肌率、心脏指数、脾脏指数、肌胃指数差异均不显著(P>0.05)。试验Ⅱ组和试验Ⅲ组全净膛率显著增加4.95%(P<0.05)和5.44%(P<0.05)。肝脏指数试验Ⅱ组和试验Ⅲ组分别显著下降13.15%(P<0.05)和19.92(P<0.05)。肾脏指数试验Ⅱ组显著下降21.74%(P<0.05)。腺胃指数试验Ⅰ组和Ⅱ组极显著低于其他组(P<0.01)。
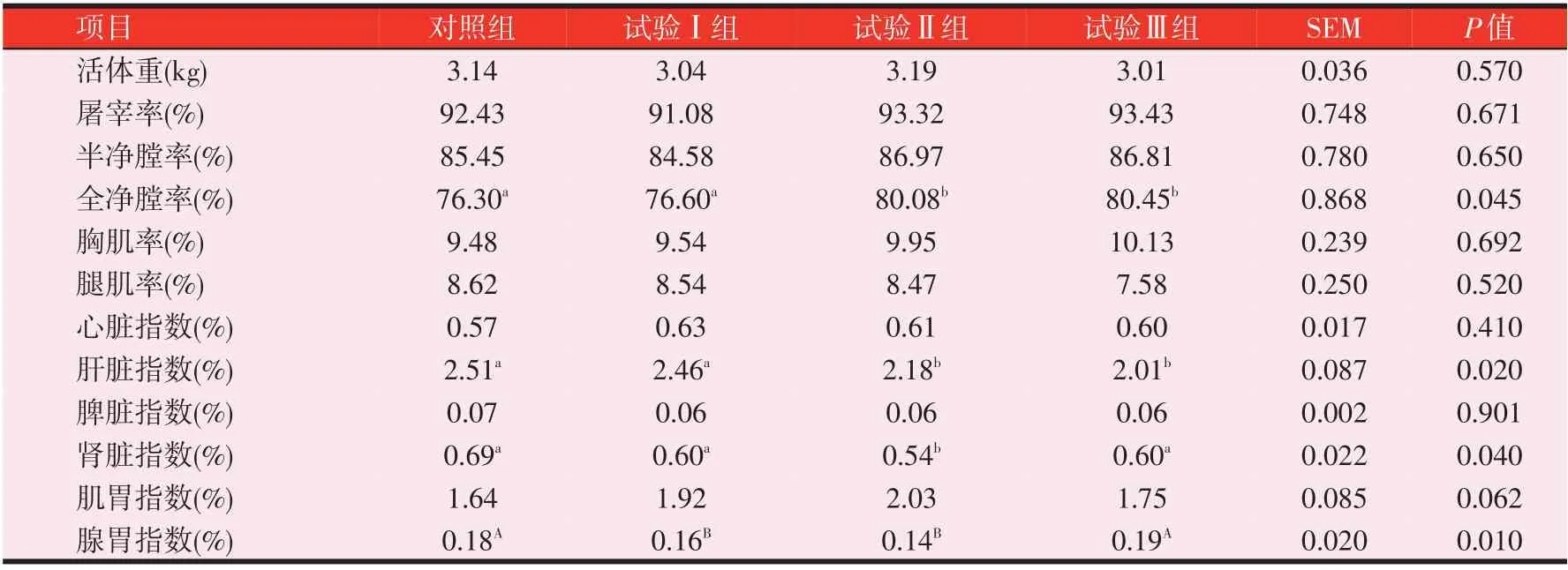
表4 复合益生菌发酵全价料对Z型鸭屠宰性能及器官指数的影响
2.3 复合益生菌发酵全价料对Z型鸭血清生化指标的影响(见表5)
由表5可知,与对照组相比,各试验组血清TC、HDL-C含量差异不显著;LDL-C含量试验Ⅰ组显著下降17.51(P<0.05),试验Ⅱ组和Ⅲ组分别下降24.75%(P<0.01)和13.64%(P<0.05);试验Ⅰ、Ⅱ组和Ⅲ组TG含量分别下降30.46%(P<0.01)、45.70%(P<0.01)和43.05%(P<0.01),试验Ⅱ组和Ⅲ组与试验Ⅰ组 相 比 分 别 下 降21.90%(P<0.05)和18.10%(P<0.05);AST活性显著下降,试验Ⅰ组、Ⅱ组和Ⅲ组分别下降50.72%(P<0.01)、66.42%(P<0.01)和57.15%(P<0.01),其中试验Ⅱ组和Ⅲ组极显著低于试验Ⅰ组(P<0.01);AST/ALT比值与AST趋势一致。UA含量试验Ⅱ组和Ⅲ组分别下降24.00%(P<0.01)和31.42%(P<0.01),极显著低于对照组,而试验Ⅲ组显著低于试验Ⅱ组(P<0.05)。
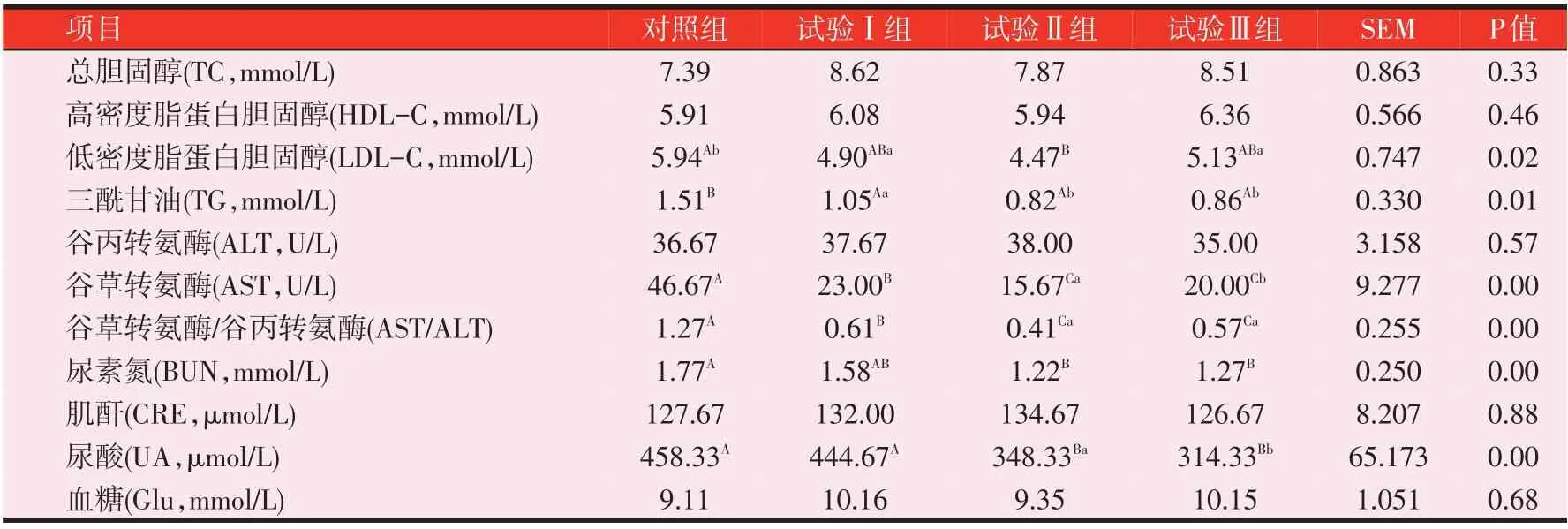
表5 复合益生菌发酵全价料对Z型鸭血清生化指标的影响
2.4 复合益生菌发酵全价料对Z型鸭血清激素的影响(见表6)
由表6可知,与对照组相比,试验Ⅰ、Ⅱ组和Ⅲ组GH含量分别极显著增加32.68%(P<0.01)、32.57%(P<0.01)和19.28%(P<0.01),其中试验Ⅰ、Ⅱ组极显著高于试验Ⅲ组(P<0.01);INS含量试验Ⅰ、Ⅱ组和Ⅲ组分别极显著增加了25.62%(P<0.01)、25.20%(P<0.01)和34.20%(P<0.01),其中试验Ⅲ组极显著高于试验Ⅰ、Ⅱ组(P<0.01);IGF-1含量试验Ⅰ、Ⅱ组和Ⅲ组分别极显著增加了33.10%(P<0.01)、24.89%(P<0.01)和25.76%(P<0.01),其中试验Ⅰ组极显著高于试验Ⅱ组和Ⅲ组(P<0.01)。
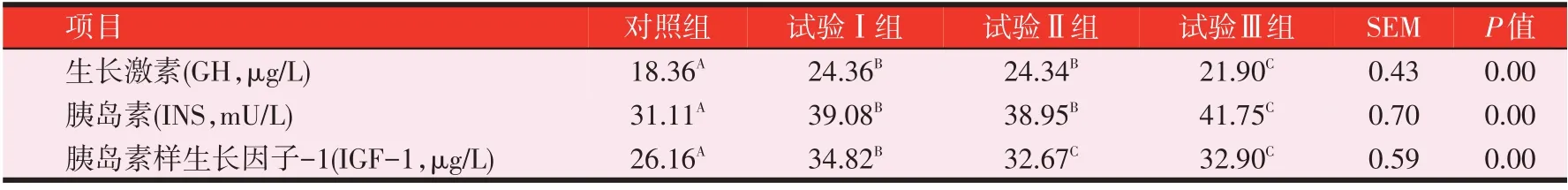
表6 复合益生菌发酵全价料对Z型鸭血清激素的影响
2.5 复合益生菌发酵全价料对Z型鸭营养物质表观消化率的影响(见表7)
由表7可知,粗蛋白的消化率显著提高,其中试验Ⅰ、Ⅱ组和Ⅲ组比对照组分别增加了11.32%(P<0.05)、9.17%(P<0.05)、8.90%(P<0.05)。淀粉的消化率试验Ⅰ、Ⅱ组和Ⅲ组比对照组分别增加9.01%(P<0.05)、11.37%(P<0.05)、10.65%(P<0.05)。脂肪、钙和磷的表观消化率无显著变化(P>0.05)。
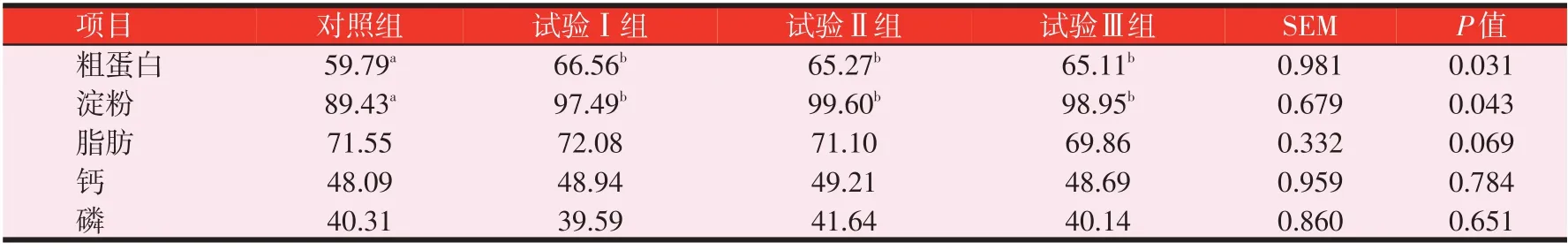
表7 复合益生菌发酵全价料对Z型鸭营养物质表观消化率的影响(风干基础,%)
3 结果与讨论
3.1 复合益生菌发酵全价料对Z型鸭生长性能的影响
生长性能直接反映动物的营养状态和健康状况。发酵饲料将饲料中大分子物质降解,利于幼龄动物消化吸收,且发酵过程中产生有机酸[15],酸化饲料不仅可抑制有害菌的生长,减弱大肠杆菌导致肠毒症的能力[16],同时还可激活与蛋白质和碳水化合物代谢相关的蛋白酶、淀粉酶等消化酶类,从而提高饲料中营养物质的利用率。试验结果表明,发酵饲料营养浓度分析发现,发酵后饲料中酸溶蛋白含量显著增加,蛋白酶活性增强,蛋白酶抑制因子显著下降,同时发酵饲料中乳酸菌活菌数量极显著增加,而在乳酸菌或有机酸存在下,pH下降明显。通过饲喂试验发现,与对照组相比,在1~10日龄平均日增重以试验Ⅲ组最高,11~28日龄组平均日增重试验Ⅱ组最高,而29~43日龄平均日增重试验Ⅰ组最高,且1~10日龄体重增加最快,29~43日龄体重增加速度减缓。推测可能由于雏鸭阶段生长速度快,肠道分泌消化酶能力不足,且易受饲料中的抗营养因子、抗原蛋白导致过敏反应,使得饲料的消化利用率降低,而大剂量的添加发酵饲料可利用发酵饲料中的酸溶蛋白等小分子物质,提高其在肠道的消化吸收率,同时蛋白酶活力、乳酸菌数量增加,可通过调整肠道菌群的平衡,同时饲料pH较低,可抑制肠道中沙门氏菌的数量,增加乳酸菌和双歧杆菌的数量[17],改善动物肠道微生态区系,促进肠道健康,使得料重比显著下降[18]。小剂量添加发酵料可在育肥后期得到明显的效果,推测在育肥后期肠道发育完善,消化能力增强,使得发酵饲料小剂量即可达到最佳的增长速度。
3.2 复合益生菌发酵全价料对Z型鸭屠宰性能及器官指数的影响
屠宰性能是评价胴体品质的一个重要指标,屠宰率和全净膛率是衡量畜禽产肉性能的重要标准,一般屠宰率在80%以上,全净膛率在60%以上,可认为肉用性能良好[19]。影响屠宰性能的因素包括日龄、宰前活重、饲料营养、饲喂方式等,另外,内脏器官重量也是影响屠宰性能的重要因素,内脏器官指数越大,屠宰性能就越低[20]。试验结果显示,各组屠宰率均大于90%,但各组间差异不显著。全净膛率各组均在76%以上,且随着发酵料添加量的增加呈显著上升,其中试验Ⅱ组和试验Ⅲ组与对照组相比显著增加了4.95%和5.44%。与Yan等[12]报道的添加7.5%的发酵饲料可增加鹅的体重和日增重结果一致。可能是由于饲喂发酵料促进了淀粉酶、蛋白酶等消化酶的活性[21],进而提高机体的消化吸收及营养物质沉积。
肝脏作为机体内重要的免疫器官,同时也是家禽体内的蛋白质代谢的主要器官。在强度育肥的过程中,随着肉鸭的生长,肝脏代谢负担过大,导致肿大。血清生化指标中ALT和AST以及AST/ALT作为肝脏健康状态的重要指标,只有当肝细胞受到严重损伤引起线粒体膜明显损伤后,血清中AST才会显著升高[22]。试验结果显示,AST活性和AST/ALT试验各组与对照组相比呈极显著下降,表明饲喂发酵料可促进肝脏功能健康,这与肝脏器官指数显著下降趋势相一致。另外,肝脏也是外源性有毒有害物质的重要靶组织,也是毒性评价的重要指标。LEE等[23]研究得出,当蛋鸡饲料中含有高剂量黄曲霉毒素(2.0 mg/kg)时能够增加产蛋鸡肝脏指数,应对机体对毒素的降解。试验结果显示,肝脏指数降低也可能与发酵配合饲料可显著降低真菌毒素的含量有关,这有待后续的研究证实。
3.3 复合益生菌发酵全价料对Z型鸭血清生化和激素指标的影响
血清生化指标可反映动物的生理代谢和健康情况。TG是机体酶储存能量的主要形式。HDL-C是机体内具有抗动脉粥样硬化的脂蛋白,可将组织内多余的胆固醇经胆固醇转运蛋白的作用,转运至肝脏或将胆固醇转移给LDL形成LDL-C进入肝脏,然后经肝脏脂蛋白受体吸收转变为胆汁酸排出体外,从而调节胆固醇[24]。试验结果显示,通过饲喂发酵料,HDL-C含量与对照组相比增加,但差异不显著,LDL-C和TG含量均显著下降趋势,这与在肉鸡饲喂发酵饲料[25]或发酵菜籽饼[10]的结果一致。饲料经发酵后可能具有一些成分可抑制肝脏中TG合成的活性。周露等[26]报道发酵饲料可显著降低育肥期文昌鸡血清TG的含量,可能是由于微生物发酵产生纤维素等物质,抑制文昌鸡日粮中TG的消化吸收,从而引起血液中TG含量降低。
UA是家禽蛋白质代谢的终产物,是反应蛋白质代谢的重要指标[24],UA主要通过肾脏排泄,当肾脏损伤时,血清中UA含量就会增加。试验结果显示,与对照组相比,随着发酵料饲喂量的增加,UA含量均显著下降,其中试验Ⅱ组和Ⅲ组下降幅度较大。表明饲喂发酵料可促进蛋白质分解代谢,对肾脏功能具有积极的促进作用。
GH、INS、IGF-1在动物生长发育过程中发挥着重要的作用。GH是由动物腺垂体分泌的一种肽类激素,协调一系列生理过程,包括对骨骼、肌肉和脂肪的影响,最终诱导生长,尤其对幼龄动物作用最为显著[22]。吴先华等[27]研究证实,饲喂15%的发酵豆粕可显著提高断奶仔猪血清中GH的含量。在代谢方面,GH可使储存的TG分解为游离脂肪酸,这与饲喂发酵饲料后,血清中TG含量显著下降一致。IGF-1是内分泌生长因子,最初由肝脏产生,是生长激素GH的重要介质。研究表明,GH直接激活生长激素受体(GHR),刺激IGF-1的合成,IGF-1作用于靶细胞发挥生长激素的生理功能[28]。饲喂发酵玉米-豆粕型日粮可显著增强CCAT/增强连接蛋白β(C/EBP)与IGF-1启动子结合,促进C/EBP和IGF-1蛋白在肝脏中的表达,进而促进猪的生长[29]。INS是由胰岛β细胞受内源性或外源性物质刺激时分泌的一种蛋白质激素,具有调节血糖的作用。利用地衣芽孢杆菌和酵母菌替代莫能菌素可显著提高育肥羊的生长性能,血清中GH、IGF-1和INS的含量均显著增加[30]。试验结果显示,饲喂发酵料可显著增加胰岛素的分泌,而血清葡萄糖浓度变化不大,推测可能是由于发酵用复合益生菌剂能产生促进胰岛素分泌的成分。
3.4 复合益生菌发酵料对Z型鸭营养物质表观消化率的影响
营养物质的消化吸收是提高饲料报酬的关键。微生物发酵饲料,能够促进幼龄动物肠道的发育及各种营养物质(氮、氨基酸、纤维素、钙等)的消化吸收[31]和饲料适口性[32]。曲浩杰等[33]研究报道,采用全收粪-套算法对湿料基础的发酵料和风干基础的发酵料进行对比发现,风干发酵料的粗蛋白、干物质、能量真实利用率和代谢能水平显著增加。试验结果表明,饲喂复合益生菌发酵饲料可显著促进蛋白质和淀粉的表观消化率,其中以14%添加组效果最好。
4 结论
复合益生菌发酵饲料替代14%的基础日粮,可显著增加血清GH、INS和IGF-1含量,促进蛋白质代谢,显著降低了BUN和UA含量及AST活性和AST/ALT比值,提高饲料中蛋白质和淀粉的表观消化率,全期料重比显著下降,提高育肥效果。

