化瘀方对脓毒症大鼠脾脏损伤的保护作用机制研究
孔庆寅,陈 伟
(上海中医药大学附属龙华医院,上海 200032)
脓毒症是指由感染引起的全身炎症反应综合征,是目前重症监护室患者死亡的主要原因之一,其发病机制复杂且尚未阐明,针对脓毒症救治策略的研究仍未取得根本性突破[1-2]。目前研究发现脓毒症发病过程中存在炎症反应亢进和免疫抑制,在发病早期即出现免疫功能损害,免疫炎症反应紊乱可能是其发生、发展的主要机制[3-4],因此改善免疫功能可能是防治脓毒症病程进展的关键。本课题组前期实验研究发现,化瘀方可能通过抑制TLR4介导的炎症反应而改善脓毒症大鼠的心肌损伤[5]。脾脏作为人体最大的免疫器官,含有大量的B、T淋巴细胞,在脓毒症患者免疫应答中发挥着关键作用,因此本实验在前期研究基础上进一步探究了化瘀方对脓毒症大鼠脾脏的影响及其作用机制,旨在为脓毒症的免疫治疗提供新的思路与方法。
1 实验材料与方法
1.1实验动物 6~8周龄健康SPF级雄性Wistar大鼠50只,体重(200±20)g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005,合格证号:20170005002968。于上海中医药大学实验动物中心一楼分笼饲养,喂养标准饲料,自由摄取食物和水,室温(20±2)℃,相对湿度40%~80%,通风洁净,适应性喂养1周后选取活动正常者纳入本次实验安排。
1.2药物、试剂与仪器 化瘀方由丹参30 g、大黄15 g组成,饮片为上海康桥中药饮片公司生产,购自上海中医药大学附属龙华医院中药房。脂多糖(LPS)购自德国Sigma公司,货号:T300RS;RT reagent Kit、TB Green qPCR试剂盒购于日本TAKARA公司,货号分别为RR047A和RR420A;ELISA试剂盒购于碧云天,货号:Sde15797;AmnioMAXTM- II Complete Medium培养基购于Gibco公司,货号:11269-016;CD4-Cy7、CD8-PE抗体购于上海司鼎公司,货号分别为SD0037和SD0045。高通量组织研磨器购自宁波新芝公司;组织研磨仪购自上海净信科技公司;离心机购自上海安亭科学仪器厂;数字显示隔水式电热恒温培养箱购自上海跃进医疗器械厂;台式高速离心机购自德国Eppendorf公司;qPCR仪购自瑞士Roche公司;电热恒温箱购自上海一恒科学仪器公司;PCR仪购自美国Applied Biosystems公司;凝胶成像系统购自上海天能公司;金属浴、涡旋混合器购自中国Kylin-Bell公司。
1.3分组、预处理及造模 50只Wistar雄性大鼠适应性喂养1周后,采用完全随机的方式分为空白组、模型组、化瘀方低剂量组、化瘀方中剂量组、化瘀方高剂量组,每组10只。空白组、模型组给予生理盐水2 mL灌胃,化瘀方低、中、高剂量组分别给予0.25 g/mL、0.5 g/mL、1 g/mL化瘀方2 mL灌胃,均1次/d,连续7 d。第8天,空白组大鼠尾静脉注射生理盐水6 mL/kg,其余组参考文献[6]方法于尾静脉注射LPS 6 mL/kg进行脓毒症造模。
1.4标本采集与检测
1.4.1血清肿瘤坏死因子-α(TNF-α)水平检测造模6 h后,抽取各组大鼠腹主动脉血浆约10 mL,静置30 min,离心15 min得血清样本,按照双夹心法 ELISA试剂盒使用说明测定血清中TNF-α水平。
1.4.2脾脏病理学观察 将大鼠处死后迅速取出脾脏,放入4%多聚甲醛中进行固定,制备病理切片进行HE染色,显微镜下观察其病理改变。
1.4.3脾脏组织中T细胞检测 研磨脾脏,制备脾脏细胞悬液,加入CD4-Cy7和CD8-PE抗体,流式细胞仪上机检测CD4+T、CD8+T比例,计算CD4+T/CD8+T比值。
1.4.4脾脏组织中TLR4 mRNA表达检测 取新鲜脾脏组织100 mg研磨成粉状,加入1 mL Trizol试剂,振荡混匀,裂解10 min,12 000 r/min(离心半径9.5 cm)离心10 min取上清,加入后氯仿,振摇15 s,室温静置10 min,12 000 r/min(离心半径9.5 cm)离心15 min,管底可见微量白色沉淀即为总RNA,完全溶解RNA后,紫外分析测定所抽提RNA的浓度。除去RNA中的基因组DNA,在冰上进行反转录反应,在冰上配制PCR反应液20 μL。GAPDH-rat上游序列:TTCAACGGCACAGTCAAGG,下游引物序列:CTCAGCACCAGCATCACC;TLR4-rat上游引物序列:TGGTGGCTGTGGAGACAAAA,下游引物序列:AGGCTTGGGCTTGAATGGAG。RT-PCR反应:变性95 ℃ 30 s,1个循环。定量分析:95 ℃ 5 s,60 ℃ 30 s;40循环分析模式:融解曲线95 ℃ 5 s,60 ℃ 1 min,1个循环。降温:50 ℃ 30 s,1个循环。反应结束后确认RT-PCR的扩增曲线和溶解曲线,并进行数据分析。采用QuantStudioTMReal-Time PCR Software(AppliedBiosystems)进行数据分析,使用溶解度曲线评估PCR引物的可靠性,用2-ΔΔCT法计算目的基因相对于内参基因beta actin的倍数来表示基因的相对表达量。

2 结 果
2.1各组大鼠脾脏组织病理学表现 空白组大鼠脾脏结构完整正常,胞核饱满,细胞排列整齐,无炎症因子浸润,无充血水肿;模型组大鼠淋巴窦扩张,背膜增厚,炎症细胞浸润明显,网状细胞增多,脾小结增大,部分胞核溢出破裂;化瘀方各组脾脏淋巴窦轻度扩张,背膜增厚,炎症细胞浸润现象较模型组明显减轻,脾小结增大,偶见胞核溢出破裂现象,化瘀方高剂量组损伤最轻。见图1。
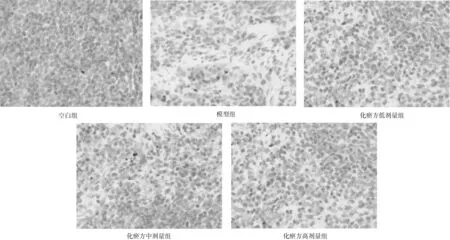
图1 空白组和脓毒症各组大鼠脾脏组织病理学HE染色表现(×200)
2.2各组大鼠血清TNF-α水平比较 空白组、模型组、化瘀方低剂量组、化瘀方中剂量组、化瘀方高剂量组血清TNF-α水平分别为(33.93±3.71)pg/mL、(145.40±5.10)pg/mL、(105.97±10.67)pg/mL、(85.05±8.48)pg/mL、(61.74±6.38)pg/mL,模型组明显高于空白组,化瘀方各组均明显低于模型组,且化瘀方中、高剂量组明显低于化瘀方低剂量组,化瘀方高剂量组明显低于化瘀方中剂量组,差异均有统计学意义(P均<0.05)。
2.3各组大鼠脾脏组织中CD4+T、CD8+T比例及CD4+T/CD8+T比值比较 与空白组比较,模型组大鼠脾脏组织中CD4+T和CD4+T/CD8+T比值明显降低(P均<0.05),CD8+T明显增高(P均<0.05)。化瘀方各组大鼠脾脏组织中CD4+T和CD4+T/CD8+T比值均明显高于模型组(P均<0.05),且高剂量组明显高于中、低剂量组(P均<0.05),中剂量组明显高于低剂量组(P均<0.05);CD8+T均明显低于模型组(P均<0.05),且高剂量组明显低于中、低剂量组(P均<0.05),中剂量组明显低于低剂量组(P<0.05)。见表1。

表1 各组大鼠脾脏组织中CD4+T、CD8+T比例及CD4+T/CD8+T比值比较
2.4各组大鼠脾脏组织中TLR4 mRNA表达量比较 空白组、模型组、化瘀方低剂量组、化瘀方中剂量组、化瘀方高剂量组大鼠脾脏组织中TLR4 mRNA表达量分别为0.098±0.029,0.705±0.078,0.280±0.037,0.145±0.062,0.120±0.056,模型组明显高于空白组,化瘀方各组均明显低于模型组,且化瘀方中、高剂量组明显低于化瘀方低剂量组,化瘀方高剂量组明显低于化瘀方中剂量组,差异均有统计学意义(P均<0.05)。
3 讨 论
脓毒症发病机制相当复杂,涉及体内多个系统,临床表现差异大,目前针对脓毒症治疗策略的研究仍未取得根本性进展[6]。脓毒症的重要致病因子内毒素主要由细菌繁殖或坏死过程中产生,其主要化学成分LPS是革兰阴性杆菌细胞壁的重要组成成分,它可以激活单核细胞和巨噬细胞,并引起多种炎症介质如TNF-α、IL-1、IL-6等的释放,随即出现炎症反应失控并持续放大,伴随着自我破坏,最终形成瀑布效应,表现为炎症细胞活化迅速扩散和炎症介质的泛滥[7-9]。一般认为,脓毒症由炎症反应开始,若炎症未得到控制,可能导致机体免疫抑制甚至免疫麻痹[10]。早期脓毒症死亡的通常原因系促炎症反应导致细胞因子风暴,使组织器官细胞凋亡,而脾脏细胞凋亡最严重,其猛烈程度与脾脏淋巴细胞凋亡相契合。而淋巴细胞中又以B细胞和CD4+T细胞凋亡最严重,CD8+T细胞反而升高。淋巴细胞的大量凋亡,特别是CD4+T细胞凋亡促进了抑制细胞因子释放增加、T淋巴细胞克隆无反应性[11-12]。淋巴细胞大量减少,免疫稳态被打破,机体就会出现迟发性超敏反应丧失、清除病原能力减退、继发性感染易发等免疫抑制表现,免疫细胞凋亡与免疫无反应性又促进脓毒症的发生[13]。在脓毒症发生发展中,TLR4信号通路扮演着重要角色。脓毒症发生时,TLR4受体通过识别LPS检测革兰阴性杆菌,LPS作为革兰阴性细菌细胞壁的重要组成成分,也是TLR4的主要配体。LPS首先与LBP相结合,然后与细胞表面的CD14分子相结合,共同活化TLR4信号传导途径,从而活化NF-κB,并进一步诱导多种促炎细胞因子如TNF-α和IL-6的产生[14-15]。TLR4信号通路与脓毒症炎症反应密切相关,其信号通路中的相关分子还可以作为脓毒症治疗的靶点,具有良好的生物医学应用前景。
中国古代医籍中并无“脓毒症”概念,但许多古籍如《黄帝内经》《伤寒论》及《温热论》等可见大量类似脓毒症的描述,可归属于“伤寒”“温病”的范畴,均属正虚邪实,热毒内盛、痰血瘀滞、气阴两虚等为脓毒血症的基本病机[16-17]。“毒”为脓毒症感染之源,“毒”之无形无处不在,如六淫之邪、时疫之气。毒邪外感,人体之正气耗损,伤及脏腑而生内毒[18]。热毒炽盛则耗伤气阴,瘀毒阻隔经络终致气阴亏虚及气滞血瘀[19]。瘀滞络脉是脓毒症的重要部位,《类经》中说:“深而在内者为阴络……浅而在外者为阳络。”正虚而邪盛,毒邪由表浅之阳络深入阴络,病邪盘踞脏腑之络,疾病迁延难愈,脏腑功能难以恢复[20-21]。脓毒症的治疗需“扶正”与“祛邪”双管齐下,单纯性对抗性治疗只能完成“祛邪”的任务,而完善对靶器官的保护性治疗才能解决“扶正”的问题[22],故杀菌、解毒、扶正、化瘀为脓毒症的核心治疗理念。化瘀方为通腑化瘀清热解毒之大黄联合活血化瘀之丹参组成,大黄具有通便泻热、清热解毒、消痈散肿、破血行瘀等功效;丹参可以活血、凉血、清心,丹参提取物具有一定的抑菌作用。临床应用化瘀方治疗脓毒症可有效改善临床症状,减轻炎症反应。
本实验通过尾静脉注射LPS进行脓毒症造模,可以导致促炎细胞因子的剧烈释放,真实表现脓毒症急性感染状态。尾静脉注射LPS 6 h后,脾脏组织HE染色切片显示模型组大鼠淋巴窦扩张,背膜增厚,炎症细胞浸润明显,网状细胞增多,脾小结增大,部分胞核溢出破裂,化瘀方各组中脾脏也有不同程度炎症细胞浸润,但化瘀方高剂量组脾脏损伤最轻,结果证明大鼠尾静脉注射LPS建立脓毒症模型成功并对脾脏组织造成损伤,化瘀方一定程度上可减轻脓毒症大鼠脾脏损伤。各组大鼠血清TNF-α水平检测显示,脓毒症过程中TNF-α表达明显增加,造成过度炎症反应;化瘀方可以抑制TNF-α释放,从而减轻炎性损伤。T淋巴细胞和TLR4 mRNA表达检测显示,模型组大鼠脾脏组织中CD4+T和CD4+T/CD8+T比值明显降低,CD8+T和TLR4 mRNA表达量明显增高;化瘀方各组大鼠脾脏组织中CD4+T和CD4+T/CD8+T比值均明显高于模型组,CD8+T和TLR4 mRNA表达量均明显低于模型组,且高剂量组变化更明显。表明化瘀方可以抑制脓毒症所致T淋巴细胞凋亡,下调大鼠脾脏组织TLR4 mRNA的表达。
综上所述,化瘀方可以减轻脓毒症大鼠脾脏损伤,其机制可能与抑制脓毒症所致T淋巴细胞凋亡,提高机体免疫力,调控TLR4信号通路,抑制炎症因子的产生有关。
利益冲突:所有作者均声明不存在利益冲突。

